ハロゲン化アルキルはアルコールやアルデヒドなど様々な分子に変換できるため重要な分子です。本記事ではハロゲン化アルキルの性質や反応などについて紹介していきます。
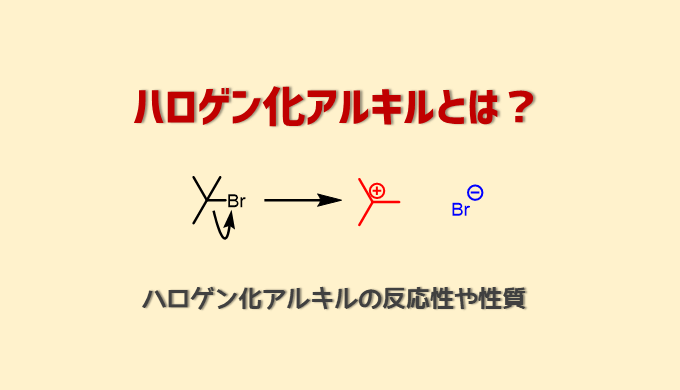
ハロゲン化アルキルとは?
ハロゲン化アルキル(R-X : X=F, Cl, Br, I)はハロゲンで置換されたアルカンのことです。
ハロゲン化アルキルの特徴は反応性の高さです。
こうした特徴はハロゲンに由来します。ハロゲンは第17族元素の総称です。ハロゲンは電気陰性度が高くアニオンになりやすい性質があります。そのためハロゲン化アルキルのハロゲンは外れやすい≒反応性が高いです。
ハロゲン化アルキルの性質
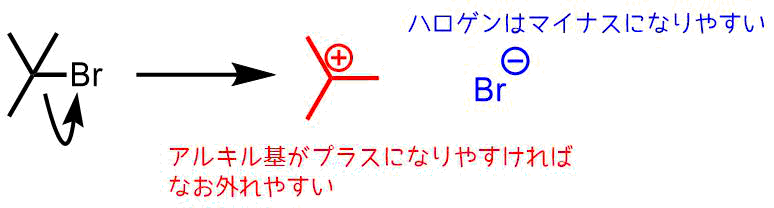
電気陰性度の高い順ではF, Cl, Br, Iとなりますが、ハロゲン化アルキルの反応性の順番はI > Br > Cl >Fの順番になります。なぜなら、アニオンの安定性は原子半径が大きいもののほうが大きいからです。
ここで同じ分子の炭素側の状況を見てみましょう。ハロゲンは電気陰性度が高いので電子がハロゲン側に引っ張られいていますが、炭素側から見れば炭素ーハロゲン結合の炭素側の電子が不足している状態になっています。このように原子間に生じる電子の偏りを分極といいます。電子の分極はδを使って表します。δ+は共有結合をしているが、電子不足な状態を示しています。

ハロゲン化アルキルは分極している
ハロゲン化アルキルのように分極した共有結合をもつ分子は反応性が高いです。
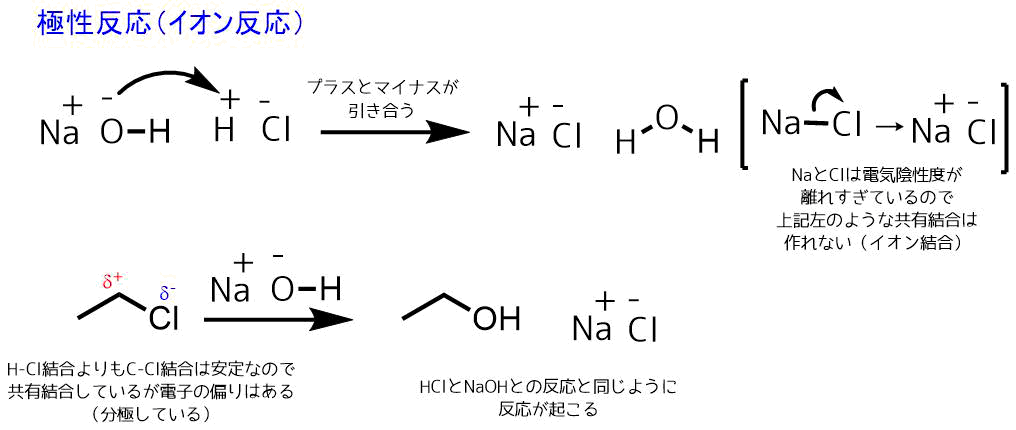
NaOHと塩酸の反応とクロロエタンの反応は似ている。水酸化物イオンはマイナスの分子(電子豊富)でプラスの分子(電子不足)な物質と反応する。クロロエタンはHClのようにイオンにはなっていないが炭素上の電子は塩素に引っ張られて電子分布に偏りが生じているため、同じように反応する。
ハロゲン化アルキルの反応
ハロゲン化アルキルの反応で重要なのは「求核置換反応」と「脱離反応」です。
この章で登場する「SN2・SN1反応」は求核置換反応の形式を表す言葉です。E1反応やE1反応は脱離反応の形式を表す言葉です。(置換:Substitution, 求核:Nucleophilic, 脱離 : Elimination)
有機化学で重要な立体化学、イオンの安定性(カルボカチオン)、反応機構を考える第一歩として良い例なので講義やテストでもよく取り上げられます。
まずは一般的な反応を見ていきます。
ハロゲン化アルキルの合成
ハロゲン化アルキルは実際の有機合成で最もよく利用する物質のひとつです。ハロゲン化アルキルは様々な分子に変換できるからです。鈴木宮浦カップリング反応などでも使います。
ハロゲン化アルキルの合成はアルコールまたはアルケンから合成することが多いです。炭素-水素結合に導入する反応(ウォールチーグラー反応)も重要でよく使います。
アルコールから合成
アルコールからハロゲン化アルキルを合成する方法は原始的な方法でありながら工業的なスケールでも利用できる実用的な方法です。最も簡単なのはアルコールとハロゲン化水素を混ぜて加熱する方法です。
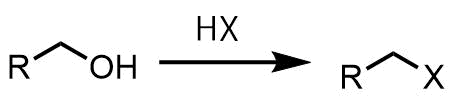
ハロゲン化水素を使ったアルコールのハロゲン化
HBrとアルコールを還流すればブロモアルキルができます。生じる水をディーンスターク装置などで取り除けば、より効率的にハロゲン化アルキルを合成できます。
アルケンから合成
アルケンの不飽和結合に対して付加反応によってハロゲンを導入する方法も重要な反応です。アルケンに対してハロゲン化水素やハロゲン分子を作用させることによって合成することが可能です。
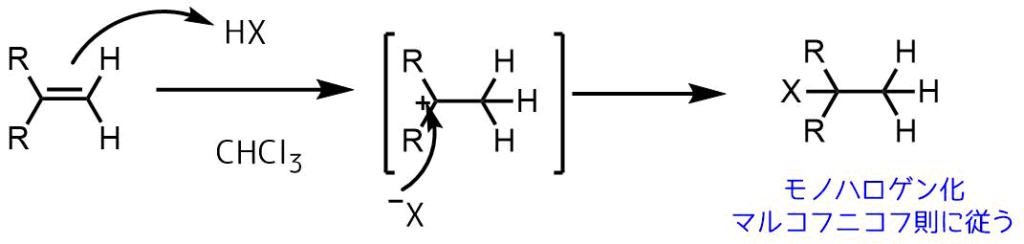
アルケンへのハロゲン化水素の付加
アルケンのハロゲン化の欠点は選択性にあります。不飽和結合の両端のどちらにハロゲンが導入されるかという問題です。これは基本的にマルコフニコフ則というルールに従うため予測は可能ですが、副生成物(狙った位置にハロゲンが入らなかった分子)が生成するのを完全に避けるのは難しいです。
脱離基(スルホナートやハロゲン化物)から合成
脱離基とはスルホナート(トシル基やメシル基など)やハロゲン化アルキルなどを指します。
先ほどアルコールからハロゲン化アルキルを合成するという反応を示しましたが、実はこの反応は安価かつ簡便ですが、合成上は優れた反応とはいいがたい面があります。例を挙げると
- ハロゲン化水素などの強酸を使う→危険、酸に弱い分子に使えない
- 加熱する必要がある →危険、反応性が低いことを意味する、熱分解が起こる
- 水の生成(脱水反応)→可逆的、水による加水分解が別の部位で起こる
などがあります。この原因のひとつがアルコールの脱離能の低さにあります。アルコールからハロゲン化アルキルを合成するのにNaClを使わない理由は-OHの脱離能が低い(外れにくく反応性が高い)からです。酸を使うとアルコールの分極した酸素にプロトンが付加した形になります。こうなると水として脱離しますが、水もそこまで脱離能が高いわけではないので、加熱・脱水が必要なります。ここで、アルコールをスルホン酸エステルに変換します下の例はメシル基を使っています。アルコールをメシル化して変換するとスルホナートは外れやすいため、簡単に塩化アルキルが合成できます。この反応ではNaClやKCl, TBAClなどの塩を使って塩化アルキルを作ることもできます。強酸を使わず水も出てこないのでより安全な反応条件になります。マイルドな反応条件といったりしますね。
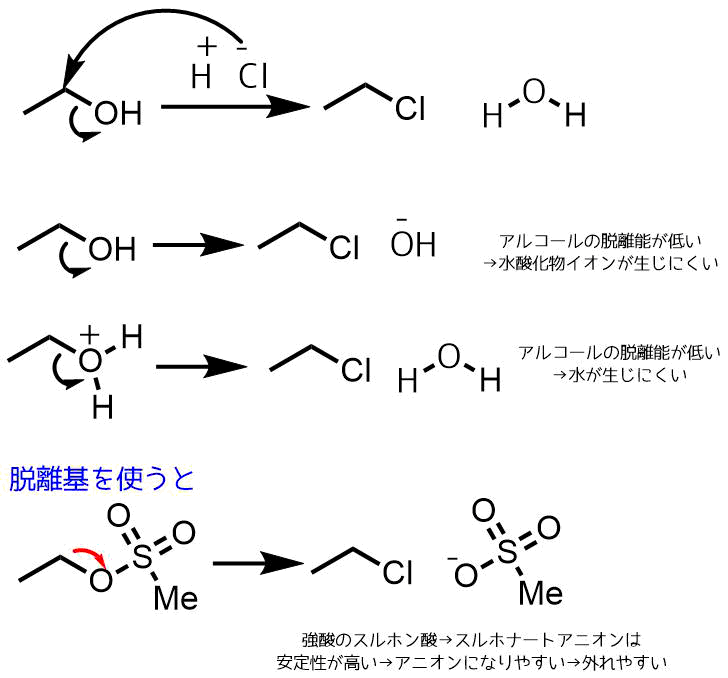
脱離基を使う理由
カルボン酸から合成
カルボン酸を原料として脱炭酸を経てハロゲン化アルキルアルキルを合成する方法もあります。酢酸鉛を使うKochi反応や単体ハロゲンを使うハンスディーカー反応があります。他の反応条件と比べて用いることは少なめです。炭素数を減らしたハロゲン化アルキルを合成するのに有用です。
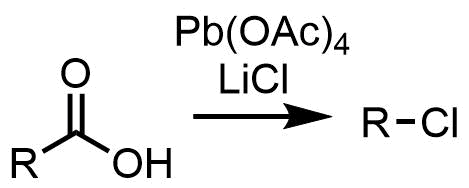
Kochi反応
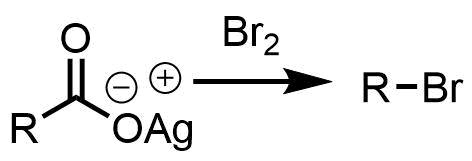
ハンスディーカー反応
ウォールチーグラー反応
ウォールチーグラー反応はNBSを使ったアリル位やベンジル位のハロゲン化反応のことです。一般的にはNBSを使った臭素化反応です。NBSを使わずとも単体ハロゲンを使うことで同様の反応を起こすことが可能ですが、ハロゲンの毒性やジブロモ化など過剰ハロゲン化の制御が難しいため、NBSを用いることが多いです。合成上重要なハロゲン化方法でよく利用されます。
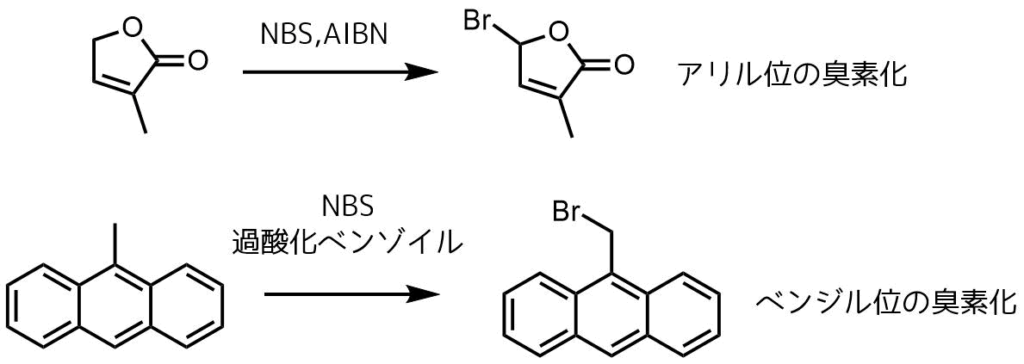
ウォールチーグラー反応
ハロゲン化アルキルを使った反応
求核置換反応(アニオンとの反応)
求核置換反応は最も基本的かつ重要な反応形式のひとつです。ブロモメタンのようなハロゲン化アルキルは炭素がプラスに分極しているため、マイナスの分子と反応を起こします。マイナスの分子(電子豊富な物質)を「求核試薬」と呼びます。
求核試薬が電子不足な炭素を攻撃して結合形成が起こると求核試薬とハロゲンが置換した分子ができます。求核試薬による求核攻撃によって置換反応が起こるので求核置換反応と呼びます。
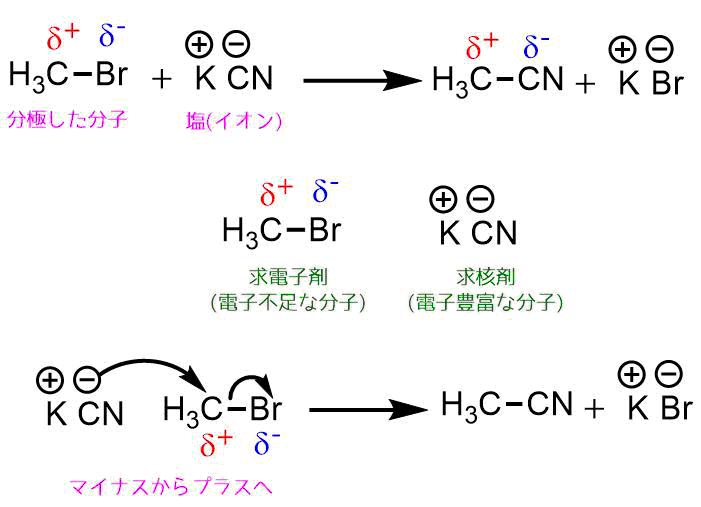
求核置換反応の例
SN2・SN1反応
求核置換反応といってもいくつか反応の仕方があります。「SN2・SN1反応」がその一つです。詳しくは以下のリンクで説明していますが、上の反応はSN2反応です。SN2反応では求核試薬と求電子試薬(ハロゲン化アルキル)両方が反応速度に関わているます。具体的には、求核試薬の濃度を2倍にすれば反応速度は二倍になります。同時に求電子試薬を2倍にすると反応速度は2×2=4倍になります。sn2反応とは?反応例と反応機構を簡単に解説
一方でSN1反応は求核試薬が攻撃する前にハロゲンが外れてカルボカチオンが生じ、そのカルボカチオンに対して求核試薬が攻撃する反応です。
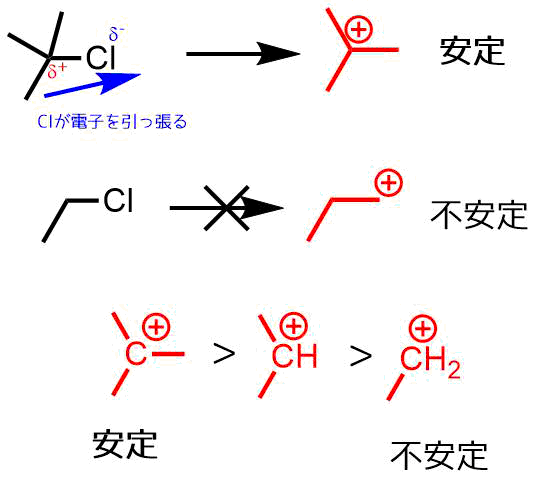
カルボカチオンの安定性
第三級ハロゲン化アルキル(ハロゲンが結合している炭素にアルキル基が3つ結合)はハロゲンが外れると第三級カルボカチオンができます。カルボカチオン(炭素プラスイオン)はアルキル基が結合しているほうが安定です。そのため第三級ハロゲン化アルキルではこのカルボカチオンが生成しやすいです。このカルボカチオンが生じてから求核置換反応が起こる形式をSN1反応と呼びます。
カルボカチオンが求核試薬と反応するということは、SN2反応の時と違って、いくら求核試薬の濃度を高くしても、カルボカチオンが生成しないと反応が起こらないことを意味しています。つまり反応速度は求電子試薬・ハロゲン化アルキルのカルボカチオン生成速度に依存するということです。(1分子的ということでSN1)
どちらが起こりやすいかはハロゲン化アルキルが第何級か?によって変わります。第二級や第一級ハロゲン化アルキルはSN2反応が起こります。
求核試薬が炭素に対して結合形成をするために近づいてくるため、立体的に空いている第一級ハロゲン化アルキルやハロゲン化メチルのほうが反応性が高いです。
脱離反応
これまで求核置換反応について説明してきましたが、同じ基質で置換反応ではなく脱離反応も起こりえます。脱離反応は新しい原子と結合形成せず、抜けていくだけです。そうなると手が余るので二重結合ができます。
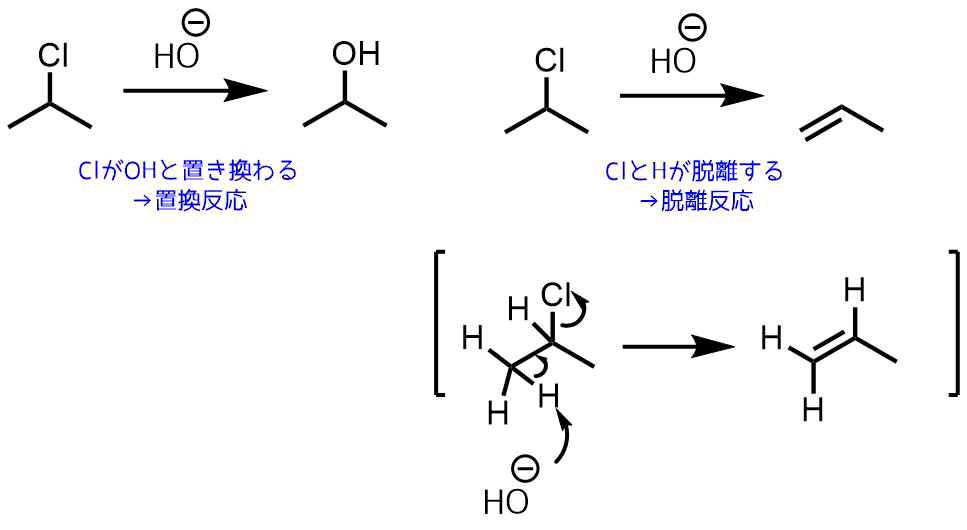
置換反応と脱離反応(理論的にどちらも起こりうる)
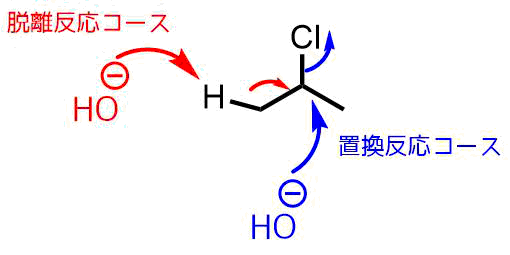
置換反応と脱離反応どっち?
脱離反応か置換反応かどちらが起こるかは反応条件によって変わります。
- 立体障害
- 求核試薬の求核性
が大きく影響を与えます。
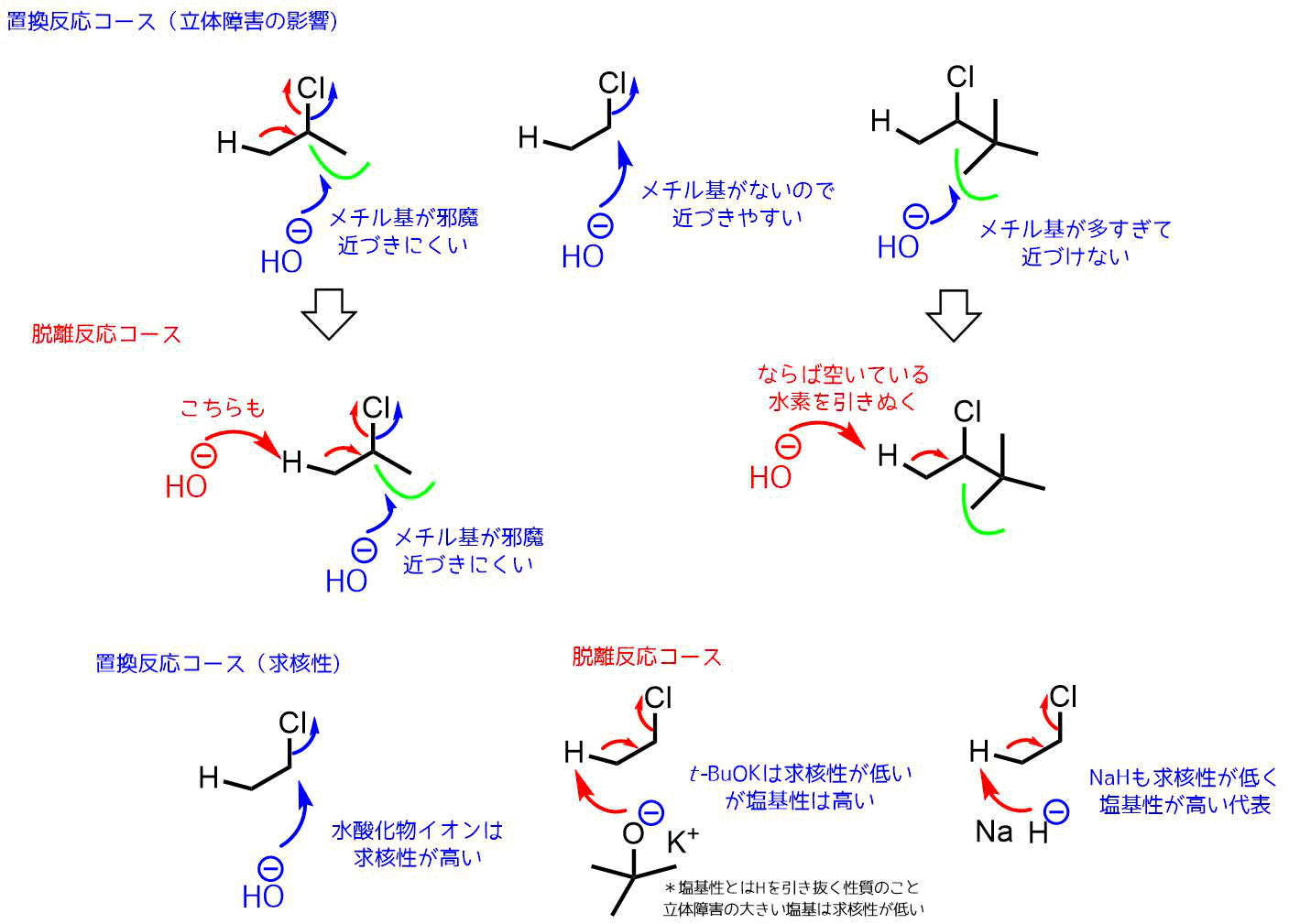
脱離反応と置換反応に影響を与えるもの
立体障害
置換反応を起こすには脱離基(ここではハロゲン)が結合している炭素に接近する必要があります。この時接近される側に炭素鎖が沢山生えていると接近しにくくなって、置換反応は起こりにくくなります。これが立体障害です。立体障害が大きい基質(ハロゲン化アルキル)では置換反応は進行しにくいです。
求核性
求核性の高さも重要です。求核性とは平たく言えば置換反応の起こしやすさです。求核性の高いものにはアミン類やチオール類、シアン化物イオンなどがあります。アルコキシドやヒドロキシドなども求核性はありますが、同時に強塩基であるため、水素を引く抜く脱離反応も並行して起こってしまいます。立体障害の大きい塩基、t-BuOKやKHMDS、トリエチルアミン、DIEPAなどは置換反応を起こしにくく脱離反応が優勢になります。
塩基性はいわゆるプロトンを引き抜く性質のことです。塩基性が高いからといって求核性が高いとは言えません。
また、求核性の高くても条件によってはその求核性を低下させることもあります。例えばシアン化物イオン-CNは優れた求核試薬ですが、水中などでは水分子がアニオンを溶媒和して反応性を低下させてしまいます。

プロトン性溶媒と非プロトン性溶媒
実際の例をみてみよう
第三級アルコールを塩酸と硫酸で反応させた時を考えてみます。
塩酸を用いた場合基質が第三級アルコールのため、カルボカチオン生成を経由するSN1反応で進行します。塩酸では塩化物イオンが求核試薬として働いて塩化アルキルが生成します。一方で硫酸を使った場合はカルボカチオンが生成するまでは一緒ですが硫酸アニオンの反応性は著しく低いため、置換反応が進行しません。代わりに不安定なカルボカチオンがなくなるようにカルボカチオンの隣の炭素の水素が脱離してアルケンが生じます。これはE1反応といいます。
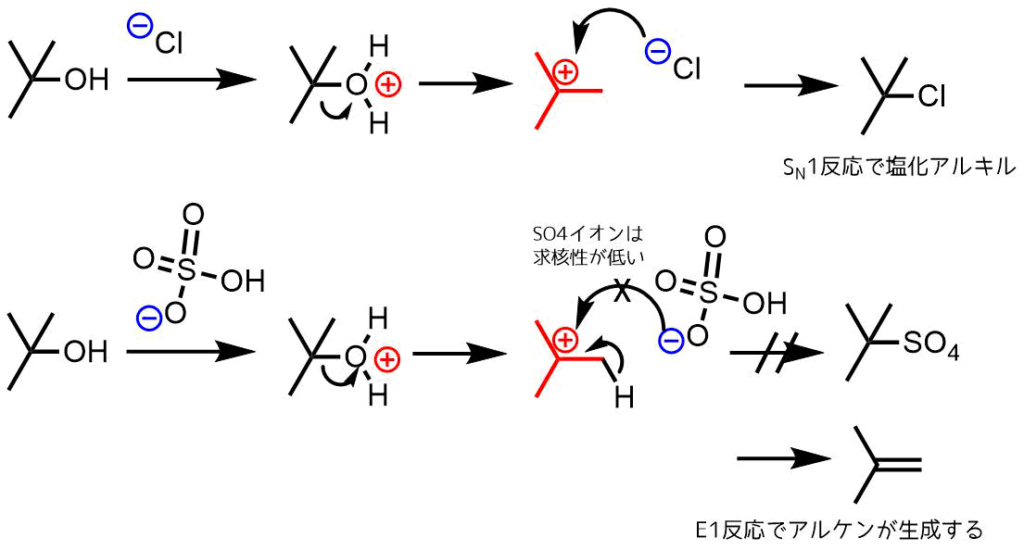
脱離反応と置換反応の競合
E1反応はアルケンの合成に使われます。
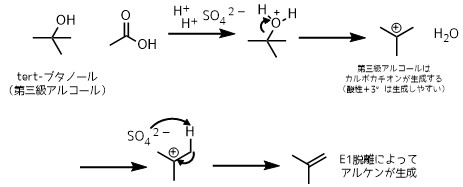
E1脱離によるアルケンの生成(酢酸溶媒中硫酸でアルケン合成)
E2反応
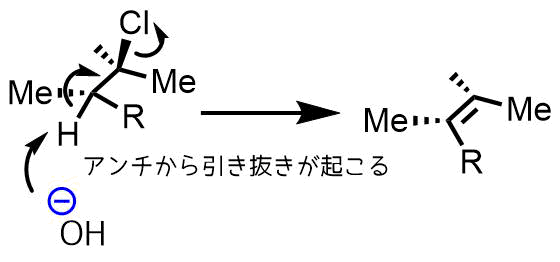
第二級ハロゲン化アルキルなどの場合はカルボカチオンが生成しにくいのでE2反応が優先します。水酸化ナトリウムなどの強塩基を使った場合、ハロゲンが結合している炭素の隣の炭素上(β位)の水素が塩基で引き抜かれて塩素が脱離してアルケンが生成する反応が起こります。塩基の引き抜きとハロゲンの脱離が同時に起こるため2分子的であるからE2反応といいます。
引き抜かれる水素の位置によって生成するアルケンが異なる場合があります。この選択性はZaitsev則というルールにならえば予測できます。一般的に多置換アルケンが主生成物になります。Zaitsev則に従えば下図の三列目の反応生成物は生成しにくいことがわかる。(引き抜かれてカルボカチオンが生成するとしたらと考えればわかりやすい)
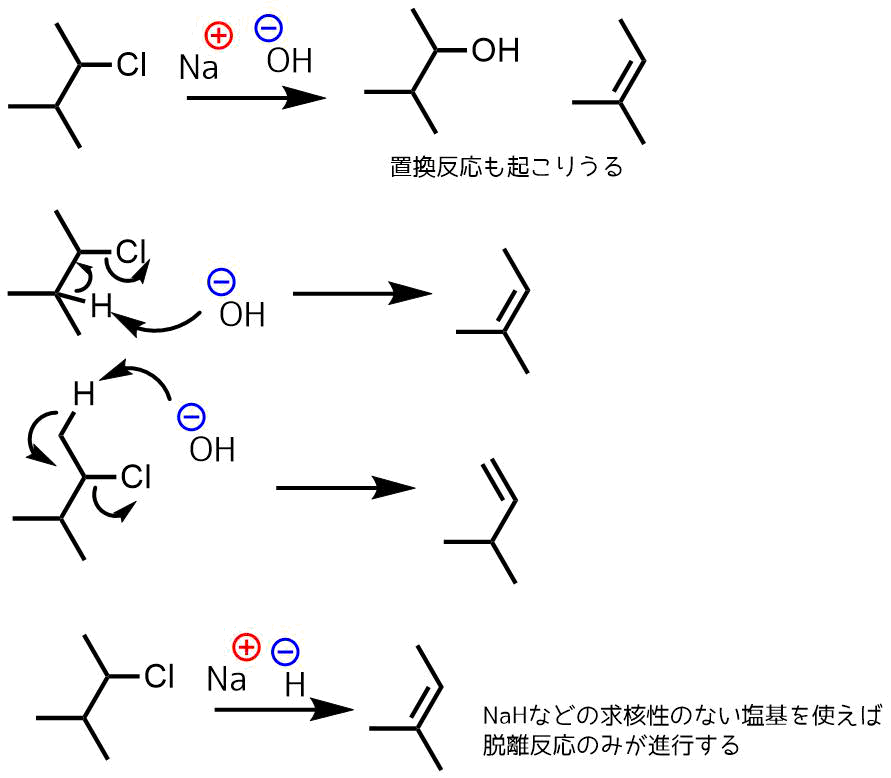
E2脱離反応
脱離反応を優先的に起こすためには例えば求核性の低い塩基NaHを使うとヒドリド(H-)は置換できないので脱離反応が優先します。
ハロゲン化アルキルの命名法
ハロゲン化アルキルの命名法ですが、ハロゲンの優先度はかなり低いです。カルボン酸があれば名前~酸のようになります。下に優先度の一覧を載せておきます。
官能基の優先順位
カルボン酸>エステル>アミド>ニトリル>アルデヒド>ケトン>アルコール>アミン>アルケン>エーテル>ハロゲン
化合物の命名を行うときは「主鎖」を決定します。主鎖とは番号を付与する基準となる炭素鎖のことです。
アルカンのように官能基がないものは単純です。最も長い炭素鎖を選べば、それが主鎖となります。ブチルやメチルはアルファベットが若い順番に書きます。番号は優先されません。(b>m )
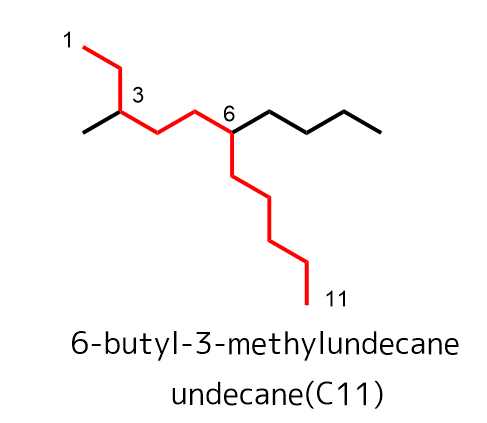
主鎖の番号
先ほどの優先度は主鎖の決定に影響します。優先度の高いカルボン酸があると炭素鎖の長さに関わらずカルボン酸側を1として数を数えることになります。
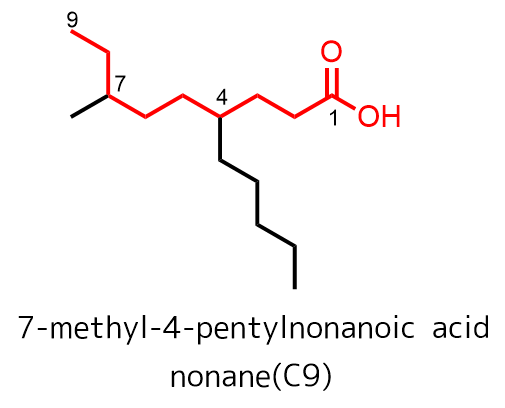
カルボン酸が優先的に主鎖
以上を踏まえてハロゲン化アルキルの命名法を解説します。
ハロゲン化アルキルの場合優先度が低く、もっとも長い炭素鎖を主鎖とします。長い主鎖のどちらを1にするかは若い番号で最初に側鎖が表れるほうを1とします。下の例えは上の炭素を1とすることで3番目の炭素に側鎖メチル基が登場します。下にすると6番目まで側鎖が登場しません。
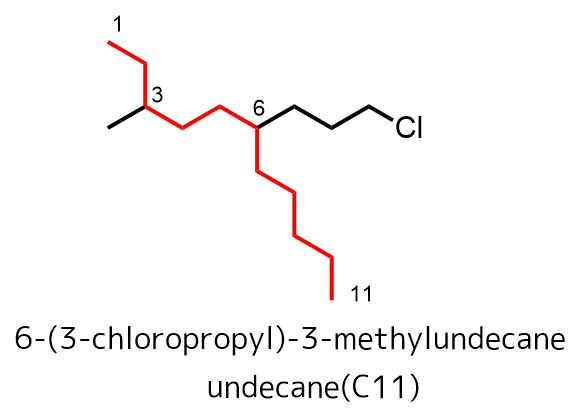
ハロゲン化アルキルの主鎖優先度は低い
あとはそこまで難しくはないと思います。ハロゲンはメチルなどと同じ扱いです。主鎖の何番目に登場するかで命名します。
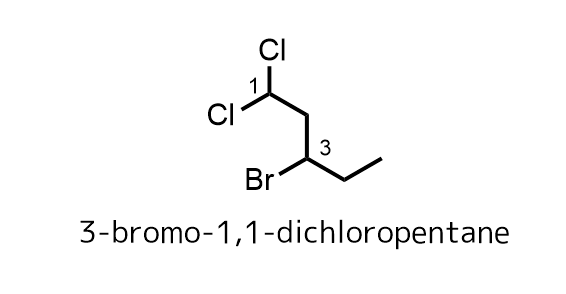
ハロゲン化アルキルの命名法