SN2反応は有機化学で最も基本的な反応の一つです。大学の有機化学で登場します。
有機化学反応を学ぶ上で重要な複数の概念を学習できることから、有機化学の講義では時間をかけて説明する反応です。
今回はこのSN2反応についてできるだけ簡単に紹介してきます。
SN2反応は2分子置換反応
SN2反応は有機化学で登場する反応機構の一つです。
SN2反応は有機化学の講義で時間をかけて説明する重要な概念です。
なぜなら、最もシンプルな反応の一つでありながら、化学物質の反応性、反応速度、立体化学、基本的な矢印の書き方、溶媒効果、立体障害など有機化学反応で重要な様々な概念を学ぶことができるからです。
それでは早速説明していきます。
置換反応とは?
まず、SN2反応は基本的な化学反応「置換反応」です。
基本的な化学反応は4種類あります。
- 置換反応
- 付加反応
- 脱離反応
- 転位反応
です。特に置換反応は多様な分子を作るのに不可欠な反応なのです。
置換反応は置換基同士が入れ替わる反応です。以下の反応では2分子中のBとDが入れ替わっています。
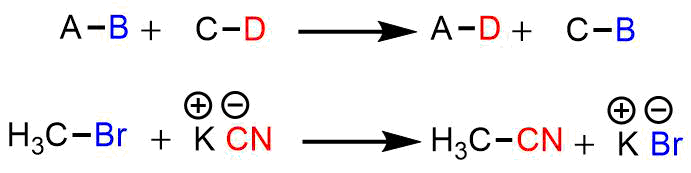
置換反応の例
ブロモメチルとシアン化カリウムとで置換反応が起こるとアセトニトリルと臭化カリウムが生成します。
この置換反応は「求核置換反応」であり「SN2」反応でもあります。
求核置換反応
置換反応にもいくつか種類があります。
求核置換反応は求核剤が求電子剤に対して求核攻撃することによって起こる反応です。
- 求核剤:電子が豊富な分子、マイナスに帯電している分子や非共有電子対を持つ分子(アミン等)
- 求電子剤:電子不足な分子、プラスに帯電している分子
- 攻撃:攻撃によって分子が別の分子と結合を形成する
ブロモメタンとシアン化カリウムは求核置換反応を起こします。
この時、求電子剤はブロモメタンです。臭素は炭素よりも電気陰性であるため、臭素側に電子が集まって炭素側の電子が不足しています。さらに臭素は原子半径が大きいため、結合が切れやすいです。
求電子剤はシアン化カリウムです。シアン化カリウムは塩です。シアン化物イオンは電子豊富な分子であるため、電子不足な分子に対して電子を与えることができます。
つまり、電子が不足しているブロモメタンの炭素に電子豊富なシアン化物アニオンが攻撃してアセトニトリルが生成します。
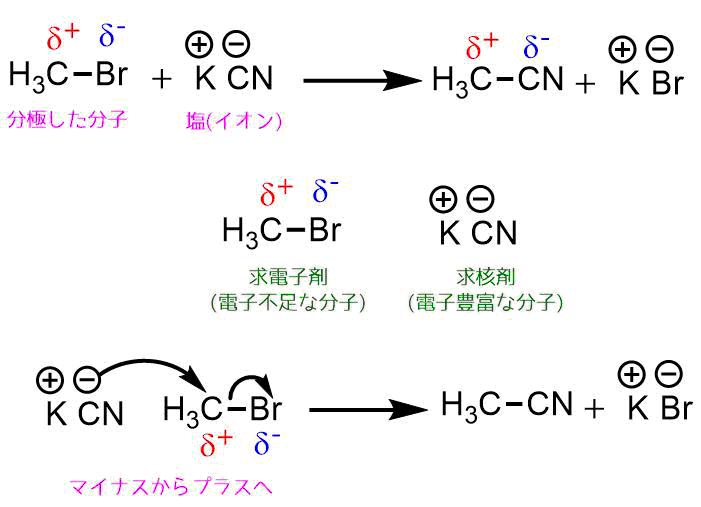
求核置換反応の例
置換される側の臭素は脱離基と呼ばれています。求核置換反応は求電子剤の脱離基の種類によって反応性が変化します。つまり外れやすい脱離基を持つ分子ほど反応性が高いです。「脱離能が高い」とも言います。
脱離能の高い物質の特徴としては、アニオンが安定に存在できる物質→電気陰性で原子半径の大きい物質です。
脱離能の高い置換基としてはヨウ素、臭素、スルホン酸エステルなどがあります。
SN2はなぜ二分子求核置換反応というのか?
SN2反応が「2分子反応」なのはなぜでしょうか?
SN2反応は結合の形成と開裂が1段階で同時に起こります。
先にCNが結合してからBrが外れるということが起こりません。
下の図の一番上の例は先にCNが攻撃してBrが外れるという経路です。CNが結合形成してからBrの結合が開裂しています。この反応経路で生成する中間体は炭素の手が5本になっているので起こりません。
次に2番目の例です。これでは先にBrが外れてからCNが結合しています。これはSN1反応と呼ばれるものです。実際にはブロモメタンでは生成する中間体CH4カチオンが不安定なため進行しません。
3番目の例ではCNの結合形成とBrの結合開裂が同時に起こっています。この状態は遷移状態といい、超短寿命でとりだせません。このような反応がSN2反応と呼ばれます。
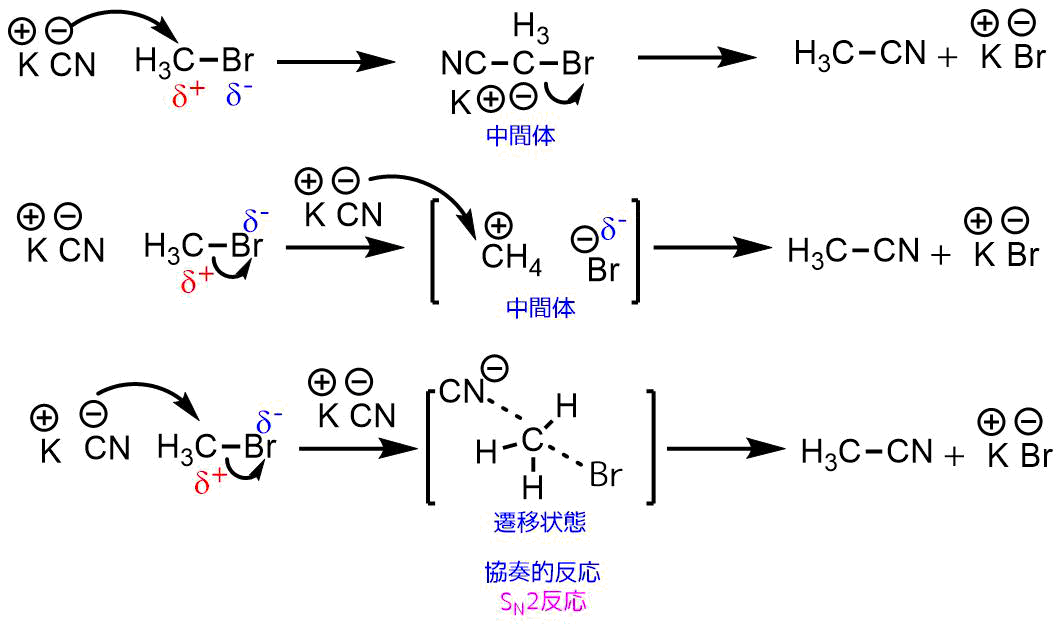
求核置換反応の形
これらの違いが何に影響するのか?というと反応速度に影響します。
化学反応では塩酸と水酸化ナトリウムの中和反応のように瞬間的に起こる反応から24時間以上かけてゆっくりと進行する反応があります。このように反応の速度は反応の種類、条件によって異なります。
反応は分子同士の衝突によって起こるため、より早く反応を起こさせるためには濃度を高くするのが有効です。例えば二番目の真ん中の反応ではまずBrが外れます。その後CNが結合形成します。この時いくら求核剤CNの濃度を高くしても、Brがはずれて中間体ができなければ反応は進行できませんよね?この反応はブロモメタンの臭素の外れる速さに支配されています。中間体は不安定なため、中間体ができてしまえばすぐにCNと反応します。このように全体の反応速度はブロモメタン一分子の臭素が外れる速度にかかっているわけです。もしも反応速度を上げたいのではればブロモメタンの量を増やします。例えば二倍にすれば反応速度は2倍になります。
それではSN2反応はどうなっているか?というとKCNの濃度を2倍濃くするとブロモメタンに衝突する確率が上昇するため反応速度は2倍になります。また、ブロモメタンの量を二倍にしてもKCNと衝突する確率が上がるので2倍になります。つまりブロモメタンとKCNの「2分子」が反応速度の上昇に関わっています。だから二分子求核置換反応(SN2反応)と呼ばれます。両方とも濃度を2倍にすれば4倍になりますね。
立体反転
SN2反応では脱離基の正反対180°から求核剤が攻撃するため、キラルな化合物の場合は立体が反転します。これをワルデン反転といいます。
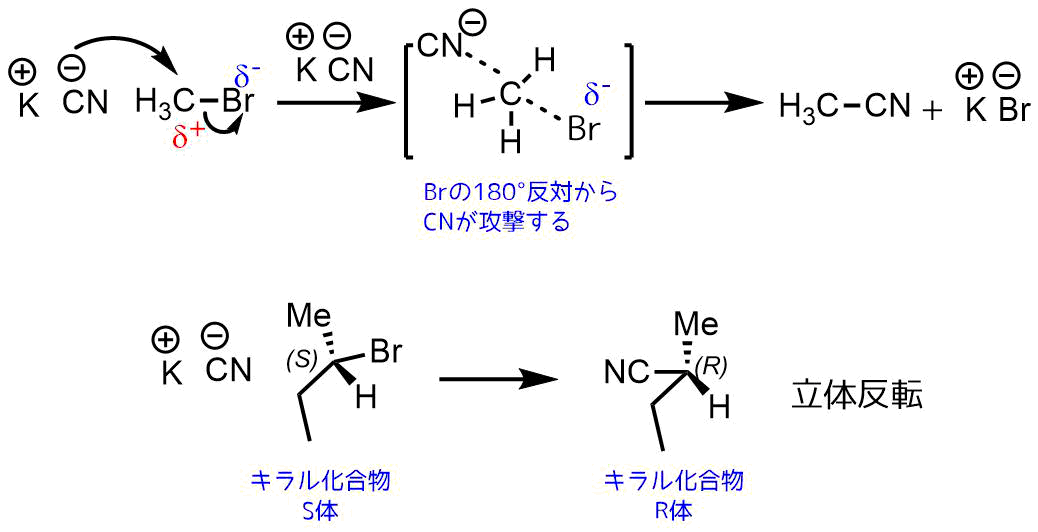
求核置換反応の立体反転
溶媒効果 非プロトン性極性溶媒は反応を加速する
求核置換反応では攻撃種がアニオン性の化合物であることが多いです。
このようなアニオン性化合物は水やアルコールなどのプロトン性極性溶媒中では水素結合を受けて反応性が低下してしまします。これを溶媒和といいます。
一方でDMFやTHFなどのプロトンを持たない非プロトン性極性溶媒ではアニオン性化合物は溶媒和されないため反応性が低下されません。そのため反応速度が向上することが知られています。そのため求核置換反応を実施するときは非プロトン性極性溶媒(THF、DMF、MeCN)などを使用することが多いです。



