ヒュッケル則は環状の分子が芳香族性を示すか?示さないかを推測するためのルールです。
芳香族の分子は非常に安定なため、化学分子は芳香族になろうとする方向に反応が進行することが多く、これが、反応予測のカギになります。
化学の超重要な基本項目「ヒュッケル則」はテストでも頻出しますし、理解しておくと必ず役に立ちます。
この記事ではヒュッケル則についてなるべく簡単にわかりやすく紹介します。
ヒュッケル則の理解にはシグマ結合とパイ結合の基本が必要!
ヒュッケル則の基本は4n+2個のπ電子を有する環状の分子です。
つまり、ヒュッケル則を理解するには「π電子の数が数えられなければいけません」
数えられる人は下の図の分子が芳香族性を示すか示さないかを予測できますか?
ヒュッケル則の難しいところは「二重結合の数」を数えてもダメなところです。4n+2の電子の数は「環の共鳴系に参加するπ電子の数」を意味しています。
右下のピロールはその代表例です。

芳香族性を示すものと示さないもの
芳香族性を正しく予測するには化学の基礎知識として
- 結合と電子の関係がわかる
- シグマ結合とパイ結合が何か?どれかがわかる
- 原子価結合法(混成軌道や立体構造)を知っている
- 孤立電子対が何か知っている
- 共鳴の意味が分かって、共鳴式が書ける
これだけの知識が必要になります。ですから「芳香族性をきちんと予測できる」⇒「化学の基礎をきちんと理解している」ことなので、芳香族性の予測は高度な知識を有するので分からなくてもおかしくないのです。
事実、化学専攻の大学院生でもきちんと理解し、説明できる人は意外と少ないのが現実です。
以降はざっと必要な知識を紹介します。
結合と電子
原子と電子
結合と電子の関係をざっと紹介します。
原子には原子番号の数だけ「電子」があります。
電子を2, 8, 18, 32…の部屋(電子殻)ごとに並べていきます。
その最外電子殻に入った電子を価電子といいます。
価電子だけを点にして書いた表記をルイス構造式と呼びます。

原子の電子はどうなってるか?
結合と電子
代表的な分子「メタン」には4つの結合がありますが、一つの結合には2つの電子が関与しています。
炭素と水素の電子を互いに共有するので共有結合といわれています。ここに挙げた結合は全てシグマ結合です。
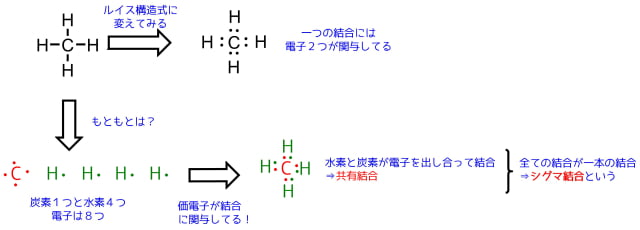
メタンの結合と電子の関係
二重結合と電子
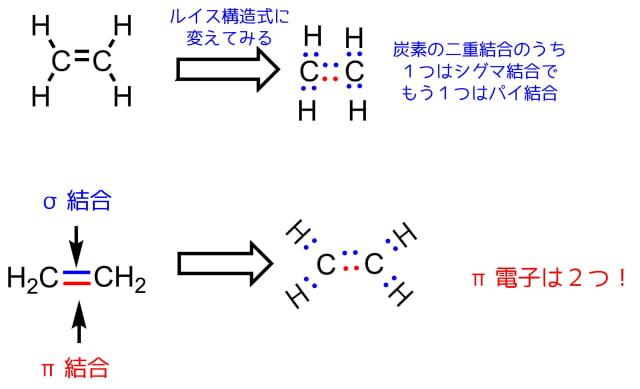
エチレンの構造とπ結合
エチレンはメタンにはない二重結合があります。二重結合のうち一つはこれまでと同じσ結合ですが、もう一方はπ結合という結合です。(三重結合は一つがσ結合、二つがπ結合)
二重結合をもつ分子はSP2混成軌道といって平面構造を取ります。
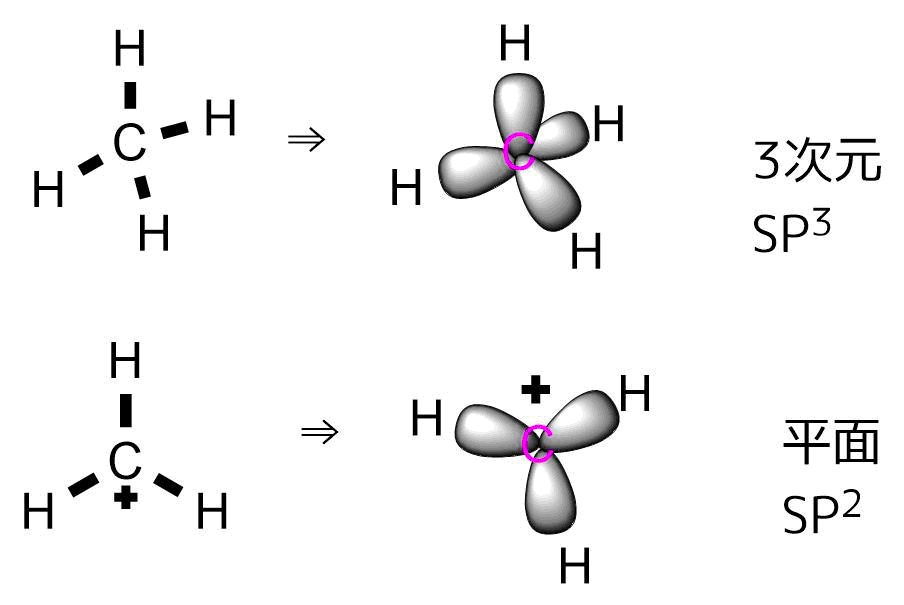
SP3とSP2混成

CH4(左)と+CH3(右)の立体構造 CH3のほうは平面になっているのがわかる。
孤立電子対の存在
窒素の価電子を見ると2つセットの価電子、孤立電子対がある。
孤立電子対は電子をもたないプラスイオンに対して孤立電子対を渡して結合を作ります。
このように孤立電子対は電子が足りないところに動く性質があります。
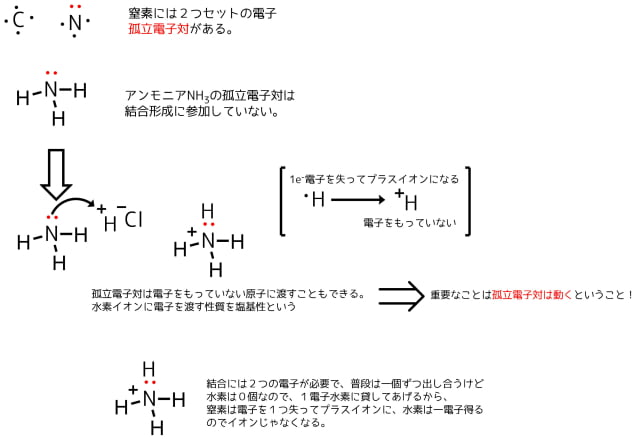
孤立電子対は電子を欲するところに流れる
電子の非局在化と共鳴
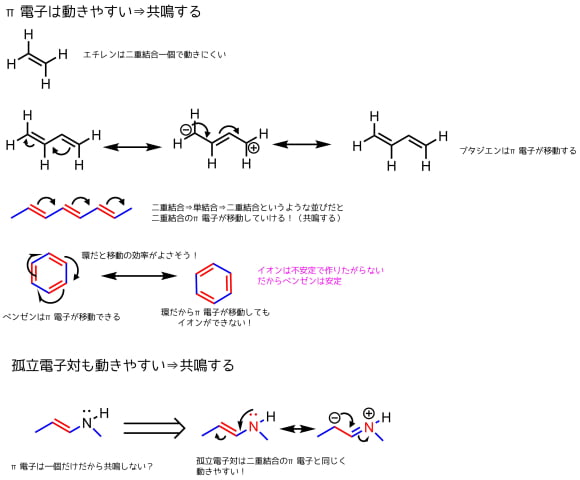
π電子は動きやすいという特徴があります。
単結合と二重結合の繰り返し構造があると移動します。
π電子だけでなく孤立電子対も動けます。
π電子が移動した構造を紙に書くと、元の構造とは違ったものになっていると思います。
こうなるとどの構造が存在しているか?という問題が生まれますが、移動しうる場所全体に分布しているというような感じになります。電子は特定の場所にとどまるのではなく、全体に非局在化しています。
ベンゼンは環のすべての炭素上にπ電子が均等に分布するような形になっていると想定されます。
孤立電子対も動きやすいので、二重結合のπ電子と同じように移動できます。孤立電子対は隣の炭素の空のπ軌道に入るのでπ電子と同じ電子配置をとります。
ヒュッケル則 4n+2のπ電子を数えて芳香族性を示すかどうか推測する
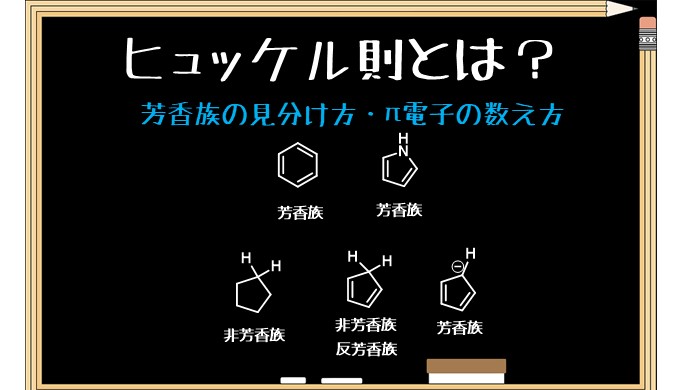
芳香族性を示すかどうかはまずπ電子の数を数えるところから始まります。
下の図ではヒュッケル則を満たすのは環状であり、π電子が6個あるベンゼンだけです。
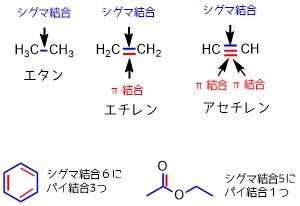
シグマ結合とπ結合の数
それでは次に一番最初に示した分子が芳香族性を示すかを考えてみましょう。
下の図の上段はもうわかると思います。ベンゼンは芳香族性を示します。
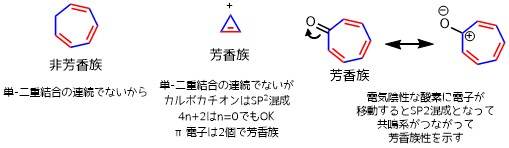
中段・左の化合物はπ電子は4つで満たしません。右の化合物はベンゼンと同じくπ電子が6つで芳香族性を示します。
下段は右2つが問題です。一番右のピロールは一見π電子が4つしかないですが、窒素があるため、孤立電子対があります。
孤立電子対は電子が必要とされるなら移動するので、安定な芳香族性を実現するために孤立電子対が環に流れていきます。これによりπ電子が6つとなり芳香族性を示します。
右から二番目も同様です。窒素の孤立電子対はありませんが、マイナスイオンがあります、これは余った電子があるということなので、ピロールの時と同様に芳香族性を示します。

シクロペンタジエン(最下段の左から二番目)は反芳香族性といって、4nを満たす分子で特別に不安定な性質を示します。
ヒュッケル則のひっかけ
ひっかけ問題みたいなものも結構ありますが、その多くは電子の移動を考える必要がある問題です。
原子が外れたら(水素を取る、σ結合を切る)元の構造ではなくなるのでだめですがそうでなければOKです。ピロールのような問題はたくさんあります。