初めてでもできる!反応条件と気をつけるポイントを分かりやすく解説します。
鈴木宮浦カップリングってとっても便利ですよね。
有名でも意外と反応をかけた経験がない人もいるかも知れません。
大学の有機化学実験などでやってる人もいそうですね!
初めて反応を仕込む時は緊張しますよね!
そんな方のためにも鈴木宮浦反応を初めて仕込んでも失敗しないための指南書を作ってみました。(2019年02/1修正追記)
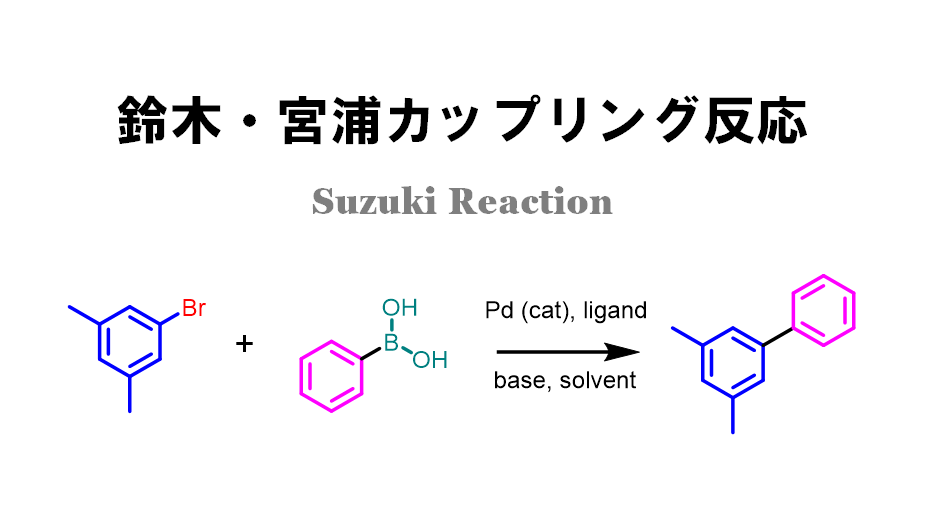
鈴木宮浦カップリング反応とは?
鈴木&宮浦先生が発明した2種類が異なる原料同士をつなぎ合わせる反応です。
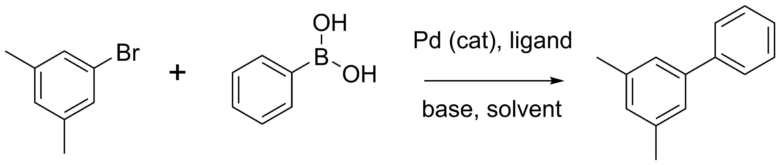
この反応を使えば、異なる種類のベンゼン環同士などをつなげることができます。両先生はこの功績により、ノーベル賞を受賞されています。
私は大学生の頃、思いました「なんだよ簡単そうじゃないか?これでノーベル賞なのか?」と。しかし
炭素同士をつなぐのは難しいのです。絵で書くのは簡単ですが…
1.カップリング反応:2つの原料をつなぎ合わせる反応(A+A→A-A)
2.クロスカップリング反応:2つの異なる原料をつなぎ合わせる反応 (A+B→A-B)
他のクロスカップリング反応と比べて何が良い?
鈴木宮浦カップリング反応の優れている点は使用する試薬の安定性の高さにあるとおもいます。
これまで報告されていたクロスカップリング反応では反応性の高い「有機金属試薬」を用いる必要がありました。
高知・フュルストナークロスカップリング:グリニャール試薬
熊田クロスカップリング:グリニャール試薬
村橋俊一らによる報告:有機リチウム化合物
根岸クロスカップリング:有機亜鉛化合物
Stille カップリング:有機スズ化合物
これらの有機金属試薬は水に対して非常に弱く、壊れやすいため、脱水溶媒を使わなければいけません。
鈴木宮浦カップリング反応で使う原料は有機ホウ素化合物で、空気や水に対して安定です。脱水溶媒でなくても反応が進行します!水を溶媒に加えることもあるくらいです。
また、溶媒中の酸素に対してもそれほど気を使わなくても平気です。
鈴木宮浦カップリング反応の利点
- 水中に安定なところ
- 空気中でも進行する(酸素に鋭敏ではない)
- 反応温度は室温でも進行(極低温あるいは高温条件ではない)
- 原料、副生成物ともに毒性が低く、弱塩基性水溶液で除去可能
- 反応が温和で官能基許容性が高く、副生成物も生じにくいため、ワンポット反応にも応用可能
- 高いスケーラビリティ(チッソ株式会社では液晶材料6割の製造、メルク社のロサルタン製造に鈴木宮浦カップリング反応を使用している)
- 原料のボロン酸の調達が容易(アルケン、アルキン、R-Xより合成可能 or 購入可能)結晶性もよく精製も容易
- 立体障害の影響を受けにくい
鈴木宮浦カップリング反応の欠点
利点に比べて欠点はほとんどない。あえて挙げるなら、
- 塩基を使う必要がある。
- 脱水条件での反応は仕込みにくい
- アルケニルハライドでの反応は起こりにくい
- 塩基性条件のため、原料によってはアルドール様反応、ラセミ化などが起こる可能性がある?
- 非塩基性条件下ではアリールホスフィンが副生成物で生じやすい
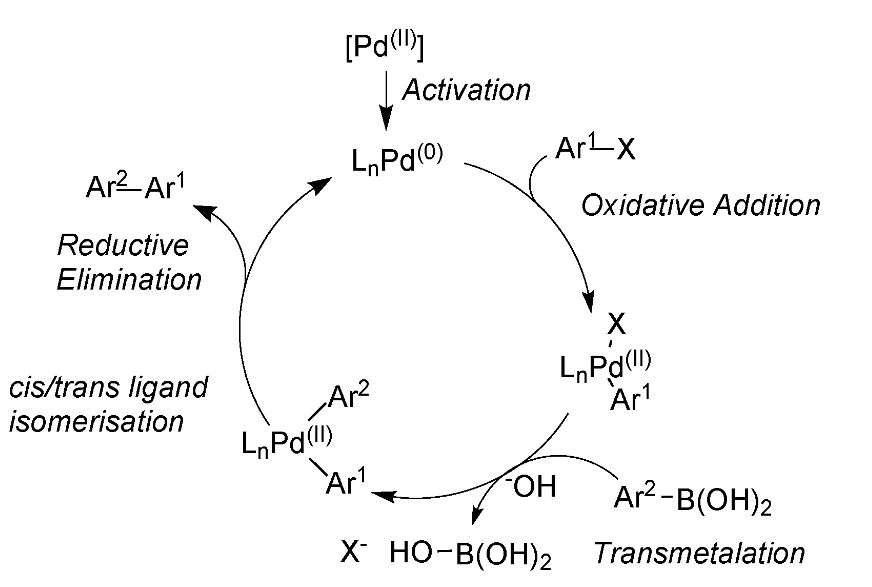
反応機構
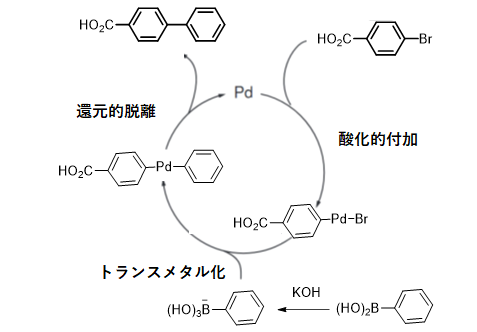
0価Pdに対してAr-Brが酸化的付加します。ボロン酸はそのままではB-C結合が強い共有結合性の結合であるためトランスメタル化が進行しないですが、塩基によるホウ素のアート型錯体を形成させると、炭素の求核性が上がり、Pd-Br結合へのトランスメタル化が進行できる。その後、還元的脱離により反応が進行する。
反応条件
反応条件として考えるべきことは、
- 触媒
- リガンド
- 塩基
- 溶媒
- アリールハライド、有機ホウ素化合物
- 温度、時間、気相
があります。
1. 触媒
鉄やニッケル、ルテニウム触媒などでも反応が進行することが報告されているが、基本的にはPdを使う。
| Pd(0) | Pd(PPh3)4, Pd2(dba)3, Pd/C |
|---|---|
| Pd(II) | PdCl2(dppf), PdCl2(Py3)2,PdCl2[P(o-tolyl)3]2, PdCl2(PPh3)2, Pd(OAc)2 |
| Ni(II) | NiCl2(dppf), NiCl2(PPh3)2, NiCl2, NiI2 |
パラジウムは0価も2価どちらもよく使われます。Pd/Cでも反応が進行します。
0価はPd(PPh3)4(テトラキス)がよく使われてファーストチョイスとなっています。室温でも反応が進行することが多いです。その一方でテトラキスは不安定で、アルキルボランを基質として用いる反応では進行しにくい点は欠点です。
二価のPdCl2(PPh3)2やPd(OAc)とホスフィンリガンドの組み合わせがよく用いられる。
ホスフィンが邪魔なときは、酢酸パラジウムや塩化パラジウム(II)を使用することが多い。
PdCl2(dppf)は還元的脱離が進行しやすく、アルキルボランとの反応でも高収率で反応が進行します。(the best choice)
触媒量の量
初期検討濃度は10-15 mol% 最適化により 濃度は0.1 mol%以下まで落としても反応は進行します。
2. リガンド(配位子)
リガンドは嵩高く、電子豊富なリガンドが良い。ホスフィンリガンドがよく使われるが、カルベン錯体なども使われています。
N-ヘテロ環カルベン錯体(NHC)はホスフィンリガンドよりも高い触媒活性と安定性、寿命を有する点が特徴です。カルベン錯体はホスフィンリガンドよりも空気に敏感な場合がありますが、in situで発生させることもできます。
よく使われるホスフィンリガンドとしては
Fu ligand(P(tBu)3), Sphos, Xphos, Johnphos, (t-Bu)3P, PCP pincer
があります。リガンドも酸素に弱いものがあります。Fu ligandなど電子豊富なアルキルホスフィンは弱いので気をつけましょう。(トリメチルホスフィンなどのトリアルキルホスフィンは空気中で発火します)
反応が進行しにくい時は嵩高く、電子リッチなリガンドを検討するとよいです。
反応性の高いAr-Iやジアゾニウム塩、アシルクロライドなどはリガンドなしで進行するという報告があります。
嵩高いアリールハライドを使う場合は嵩高くないリガンドを選んだほうが反応が進行しやすいようです。
電子豊富なリガンドは酸化的付加を促進させる。たとえば酸化的付加が進行しにくいアリールクロライドでも進行するようになる(Fuリガンド、Sphos, Xphos, PCP pincer, )
酸化的付加の過程は律速段階と一般に考えられている。
進行しにくい反応にはSphosを使うべき?
Buchwaldらは鈴木宮浦カップリング反応にSphos、Xphosが優れいていると報告している。Sphosは立体障害の大きなビアリールカップリングに有用です。
buchwaldらはリガンドの検討を通してSphosの有用性について示した論文を出しています。
[blogcard url=”https://pubs.acs.org/doi/abs/10.1021/ar800036s”]
試薬はそこそこの値段がしますが試してよいと思います。
[blogcard url=”https://www.tcichemicals.com/eshop/ja/jp/commodity/D5036/”]
3. 塩基
塩基はボロン酸をアート錯体化するのに使用する。
使用される塩基の例としては、
代表例:Na2CO3, K2CO3, Cs2CO3, Ba(OH)2, K3PO4,TlOH, KF, CsF, Bu4NF, NaOH, KOH, NaOMe, TEA, DIEA
などが使われている塩基です。水酸化タリウムは大分子のカップリング反応において劇的に反応性が向上することが見出されています。有名な例では、Palytoxin合成時にテトラキスとTlOHを用いて反応していますね。その論文では、水酸化カリウムを水酸化タリウムにすることによって1000倍以上反応性が向上するという報告がされています。
一般的な条件下では安定な有機ボロン酸のC-B結合は塩基性水溶液中では加水分解が進むことがある。特に2-ボロン酸ピリジンなどのヘテロ環ボロン酸試薬などでは加水分解が進行しやすいので注意が必要です(多めにボロン酸試薬を入れるか後述の塩基なしでも進行するトリオールボレートを使用する)
4. 溶媒
他のクロスカップリング反応と比べて、溶媒の許容性は高く、一般的な溶媒であれば大抵の溶媒を利用することができます。これが鈴木宮浦クロスカップリング反応の特徴の一つでもありますね。特に脱気とか、脱水とかも気にしなくても良い点がGodです。
ベンゼン、トルエン、DME、THF、ジオキサン、DMF、水(しばしば有機溶媒との混合)、アセトニトリル、アルコール(Me,Et, I-Pr, Bu), イオン液体などが代表的に用いられている溶媒です。とくに理由がある場合はこれら以外の溶媒を使っても良いと思います。
トルエンを使用することが多いかもしれません。が、原料の溶解性などもあるので、溶けない場合はTHFやDMEなどを使いましょう。溶解性が悪いと反応が進行しにくい印象があります(個人的に)。
水を使う場合は相間移動触媒としてTBAIやTBABなどを使うと反応が促進される場合があります。反応性が悪いな?と感じたら入れてみても良いと思います。
濃度は特に決まりは無いと思いますが、200mMとか適当な濃度で行ないます。参考とする論文の溶媒量を見て、同じようにやれば良いと思います。
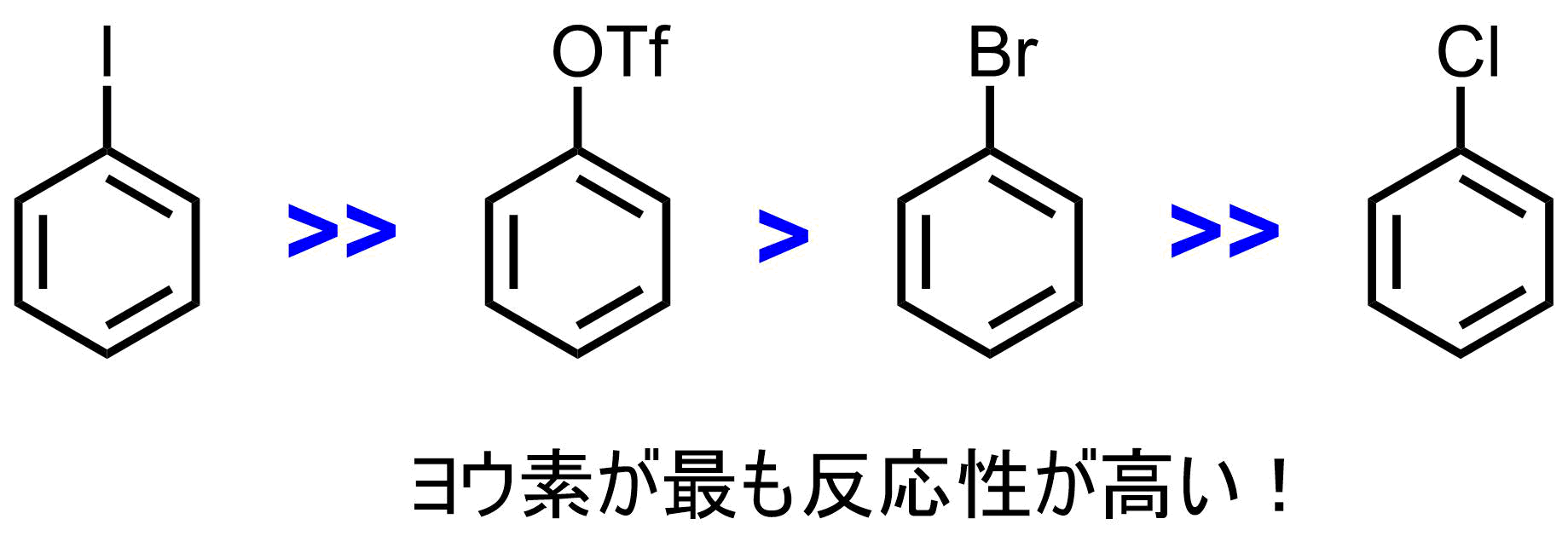
5. 原料(アリールハライド:Ar-X, Ar-BY2)
アリールハライドのハライドはI,Brがよく使われます。塩素も条件により使用可能。他にメシルやトシルも利用可能。
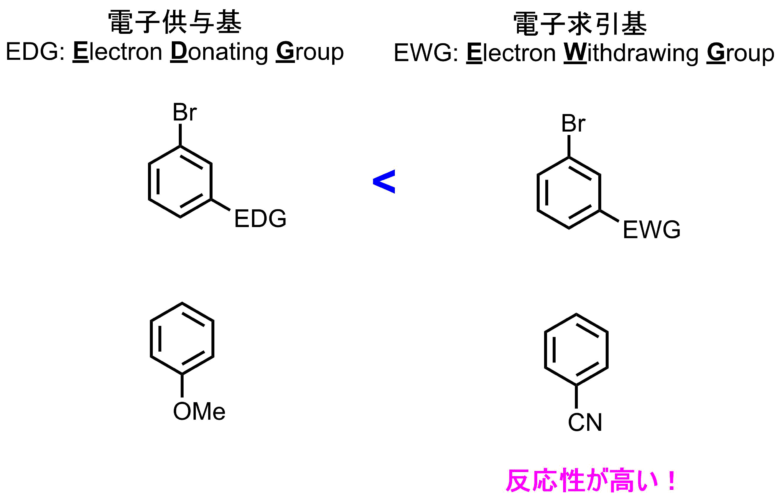
電子求引性基が結合した求電子剤は反応性が高く、供与性基がついたものは反応性が低くなります。
有機ホウ素化合物の選択は?
有機ボロン酸には
- アルキルボラン
- ボロン酸
- ボロン酸エステル
- トリフルオロボレート
- トリオールボレート
- MIDAボロネート
があります。
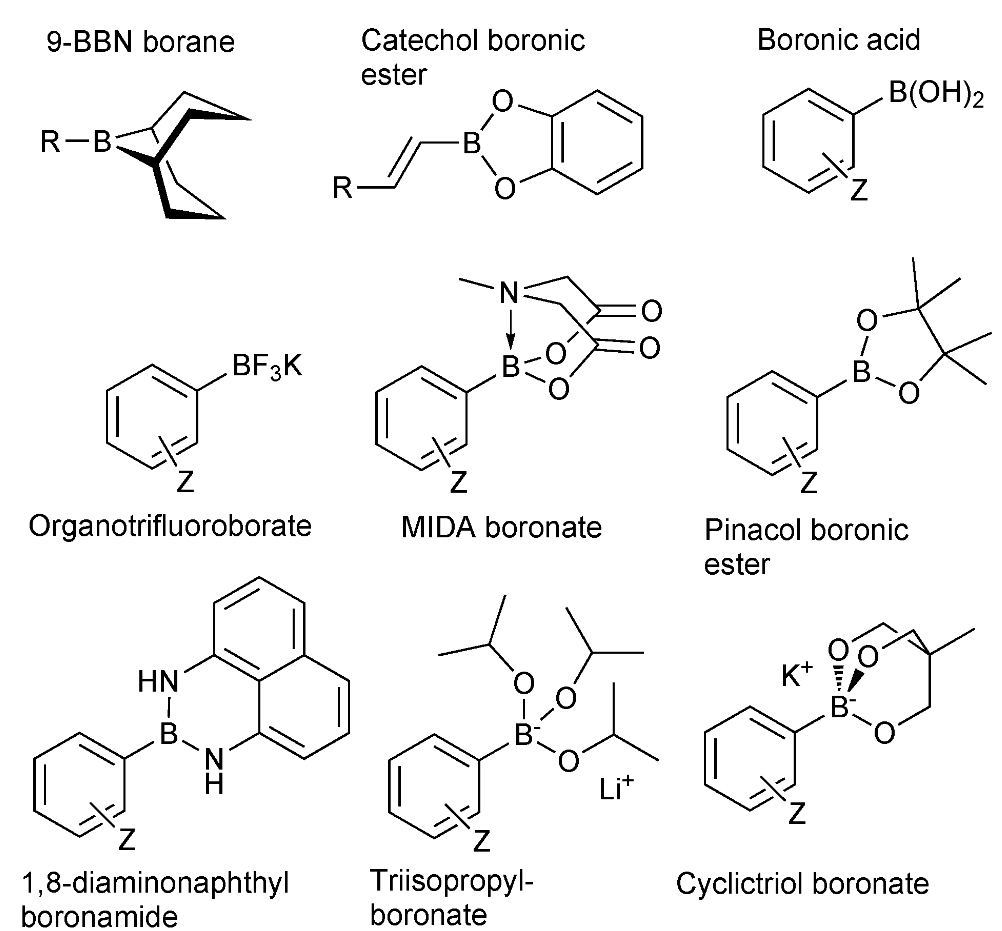
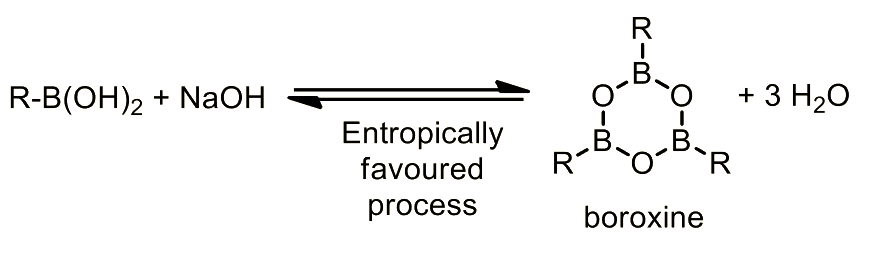
第一選択としてはボロン酸エステルを用いたほうが良いです。ボロン酸は、ボロン酸同士が脱水縮合して3量体(ボロキシン)を形成します。そのため、ボロン酸試薬を過剰量加える必要があります。
過剰なボロン酸使用を避けたい理由
1.過剰なボロン酸は副反応を起こす可能性
2.精製時にボロン酸が邪魔 → 精製で分離しにくい時あり(カラムとか)
したがって、ボロン酸を保護したボロン酸エステルを用いたほうが良い。
複素環のボロン酸(ピリジンのボロン酸とか)はB-C結合の加水分解が起きやすいため、塩基性水溶液条件は避けたほうが良いです。(ボロン酸エステルを使うほうがよい)
アリールボロン酸を使用する場合はボロン酸のオルト位が嵩高い場合脱ボロン酸が起こることがあるので、嵩高い方をアリルハライドにしたほうが良い。
ボロン酸エステルは一般的にボロン酸よりも反応性が低い。
1.アルキルボラン
アルキルボランは、アルケンや、アルキンのヒドロホウ素化で簡単に調整できる。(9-BBNとか)
2,3.ボロン酸とボロン酸エステル
アリールハライド→グリニャール試薬、有機リチウム試薬のトランスメタル化により容易に調整可能。
アリールハライド、トリフレートとbis-pinacolatodiboronから調整できる。
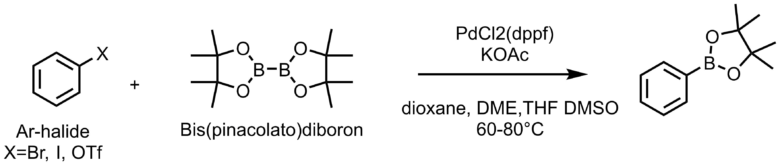 この反応では触媒はPdCl2(dppf)orDCM付加体を使うことが多いです。収率は60-80%くらい。溶媒はジオキサンが最も良く使われます。次にDMF>DMSO>トルエン、THF、DMEが使われます。塩基は圧倒的にAcOKを使用するのが多いですね。他はK2CO3やCs2CO3など。反応温度は80℃付近-100℃と高めで行うことが多いです。反応時間は-3hくらいで、反応が進行し難ければもっと長く48hくらいまでやることもありますが、あまり収率は上がらないかもしれません。
この反応では触媒はPdCl2(dppf)orDCM付加体を使うことが多いです。収率は60-80%くらい。溶媒はジオキサンが最も良く使われます。次にDMF>DMSO>トルエン、THF、DMEが使われます。塩基は圧倒的にAcOKを使用するのが多いですね。他はK2CO3やCs2CO3など。反応温度は80℃付近-100℃と高めで行うことが多いです。反応時間は-3hくらいで、反応が進行し難ければもっと長く48hくらいまでやることもありますが、あまり収率は上がらないかもしれません。
ボロン酸エステルの欠点としては調整したボロン酸試薬の精製が難しいところです。テーリングしたり綺麗なものがとってこれないことがあります。後述のホウ酸シリカゲルの使用が役立つかもしれません。
4. トリフルオロボレート
トリフルオロボレート(ーBF3K)は空気や水に安定で結晶性が良く取り扱いやすい有機ホウ素試薬です。トリフルオロボレート塩は、ボロン酸とKHF2をアセトン中などで調整することにより簡単に得ることができます。
トリフロボレート塩の欠点は、
1.有機溶媒に溶けにくいこと
2.反応性が低く塩基の使用が不可欠
1.有機溶媒はメタノールなどのアルコール溶媒や水などにしか溶けづらいため溶媒が限定されます。
2.トリフルオロボレートはアート錯体ですが、ホウ素上の負電荷が電気陰性度の高い3つのフッ素原子にもってかれるために反応性が低くなっています。そのため塩基を加えることによって活性化する必要があります。
Molander, Gary A., and Betina Biolatto. “Palladium-catalyzed Suzuki− Miyaura cross-coupling reactions of potassium aryl-and heteroaryltrifluoroborates.” The Journal of organic chemistry 68.11 (2003): 4302-4314.https://pubs.acs.org/doi/full/10.1021/jo0342368
5.トリオールボレート
トリオールボレート塩(-B(OR)3)はアート型錯体をとりつつ、ボロン酸はアルキルに保護された形をとっているため、空気や水に安定で、有機溶媒への溶解性も向上しています。そのため、反応に関してはトリフルオロボレート塩の上位版といえるでしょう。無水、無塩基条件で進行するのが魅力だが、購入が限られ、自前調整が必要な点が欠点
6.反応時間、温度、気相
反応時間はまちまちで1h-24h程度
反応温度も条件によって異なるが室温ー100℃くらい。また、マイクロ波も有効。
気相は他のクロスカップリングと比べて酸素の影響を受けにくいようである。不活性ガス置換や脱酸素などを行わなくても反応が進行する。一方で条件検討などを行うときなど、不活性ガス置換はしておいたほうが良いでしょう(あとで不活性ガス置換しなかったから?となったら面倒)。
参考・豆知識
・ボロン酸ピナコールエステルの精製
有機ボロン酸の原料合成及び、反応後の余ったボロン酸の除去時に、ボロン酸がテーリングしたり、原点に残ることが多く、きれいに分離できないことがあります。その時にホウ酸処理したシリカゲルを用いるときれいに分かれることがある。特にボロン酸ピナコールエステルに有効です。
引用)Hitosugi, Shunpei, et al. “A Facile Chromatographic Method for Purification of Pinacol Boronic Esters.” Chemistry letters 41.9 (2012): 972-973.
ホウ酸シリカゲルの調整
シリカゲル150gに対して5%ホウ酸-エタノール溶液(550mL)を加えて1h撹拌し、ろ過、エタノール(600 mL)で洗浄し、60℃1.5hで乾燥させて調整
- 溶媒の脱酸素する。アルゴンパージ、アルゴン雰囲気下、シュレンク管などを使ってみる
- マイクロ波合成装置があれば、試してみる
- アリールハライドを多めに加える(うまくいかないときホモカップリング体生成が優勢?)
- 原料が溶解しているか確認する。溶解性の悪いものはメタノールやクロロベンゼンや1,2ジクロロベンゼンなどを溶媒としても使える。
- BrはIに変えてみる
- 水中で反応させてみる。ミセル状に凝集して反応を加速できるかもしれない
- ボロン酸は薄い水酸化ナトリウム溶液で抽出して除去できるかもしれない。
・北海道大学大学院工学研究院の山本靖典先生の実験動画
実際に実験を仕掛けるところを動画で見れます。
・阪大で行われた鈴木章先生による講演「有機ホウ素化合物を用いるクロス・カップリング反応」
1時間4分に渡る長編ですが、日本語で大変参考になるのでぜひ視聴してみてください。
・unacademyのA sethi PhDの解説動画です。いくつかの反応例があるので参考になるかもしれません。
・反応機構(リガンドが存在してるVer.)