脱保護条件でまとめるアミンの保護基
アミノ基は窒素上の非共有電子対による反応性(求核性・塩基性)が高く、意図しない反応が進行する可能性があります。そのため、通常は反応性を抑えるために保護しておく必要があります。アセチル基やスルホニル基などの電子求引性の官能基を窒素上に置換する事によって、窒素上の電子密度を低下させることができます。これにより窒素の反応性が低下します。また、保護することで副反応の抑制だけでなく、極性の低下が起こり精製が楽になるというメリットもあります。
保護基を複数利用する予定がある場合は慎重に保護基の選択をする必要があります。保護基の選択基準として「脱保護条件」を中心にアミンの保護基をまとめます。
酸性条件で脱保護する保護基
有機合成では酸よりも塩基を多用するため、酸性で脱保護できる保護基はよく使用します。脱保護の条件は保護基によって異なりますが、概ねはTFA(トリフルオロ酢酸)や塩酸、硫酸などの酸を用いて脱保護します。
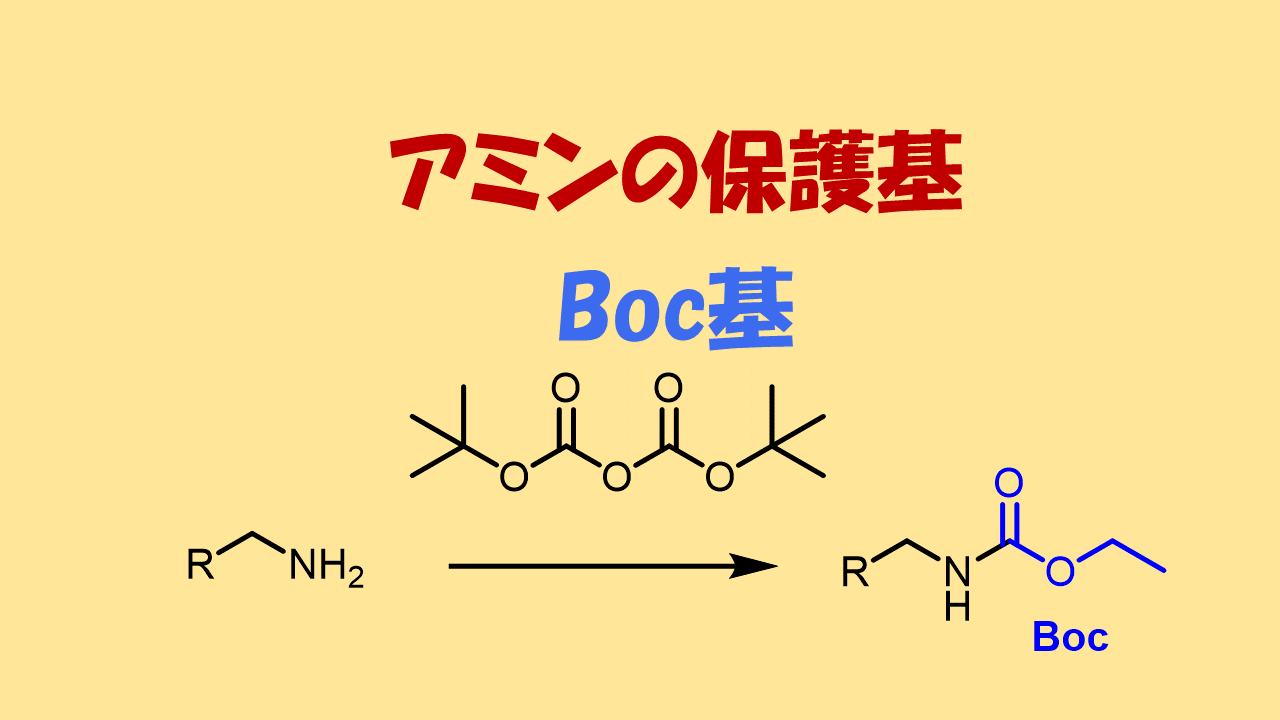
tert-ブトキシカルボニル基: Boc基(ボック基)
Boc基は最もよく使用されるアミンの保護基の一つです。Boc基は酸無水物との反応により導入します。第一級アミンであればBoc基を2つ導入することによってより強固な保護とすることが可能です。特徴としては、脱保護時に生じる副生成物が除去しやすい点です。参考とする反応例も多いので使いやすいと思います。脱保護反応も進行しやすいと思います。
還元条件で脱保護する保護基
還元条件で脱保護できる保護基は比較的丈夫なものが多く強固な保護基として多用されます。酸や塩基性条件に強いものが多いので、それらの条件で脱保護できる保護基と同時に使用することができます。還元としてはパラジウム炭素などを用いた接触水素化で脱保護することが多いです。
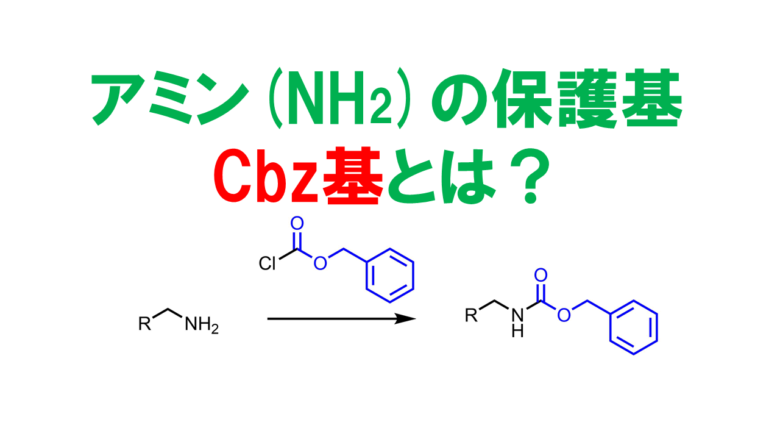
ベンジルオキシカルボニル基: Cbz基 or Z基(ゼット基)
ベンジルオキシカルボニル基はBoc基と同様にカルバメート系の保護基ですが、tertブチル基と比べてカルボカチオンが生成しにくいため酸性には強いです。Pd/Cやバーチ還元などで脱保護します。Boc基よりもコストが小さいため使いやすいです。またベンゼン由来のUV吸収性を付与することができるため、直鎖アルキルアミン類の精製時に助かるかもしれません。
塩基性条件で脱保護する保護基
塩基性条件での脱保護は求核攻撃を多用する有機合成においては使いにくい部分もありますが、多種の保護基あるいは不安定構造を有する化合物の場合に保護基の選択肢としては有りです。
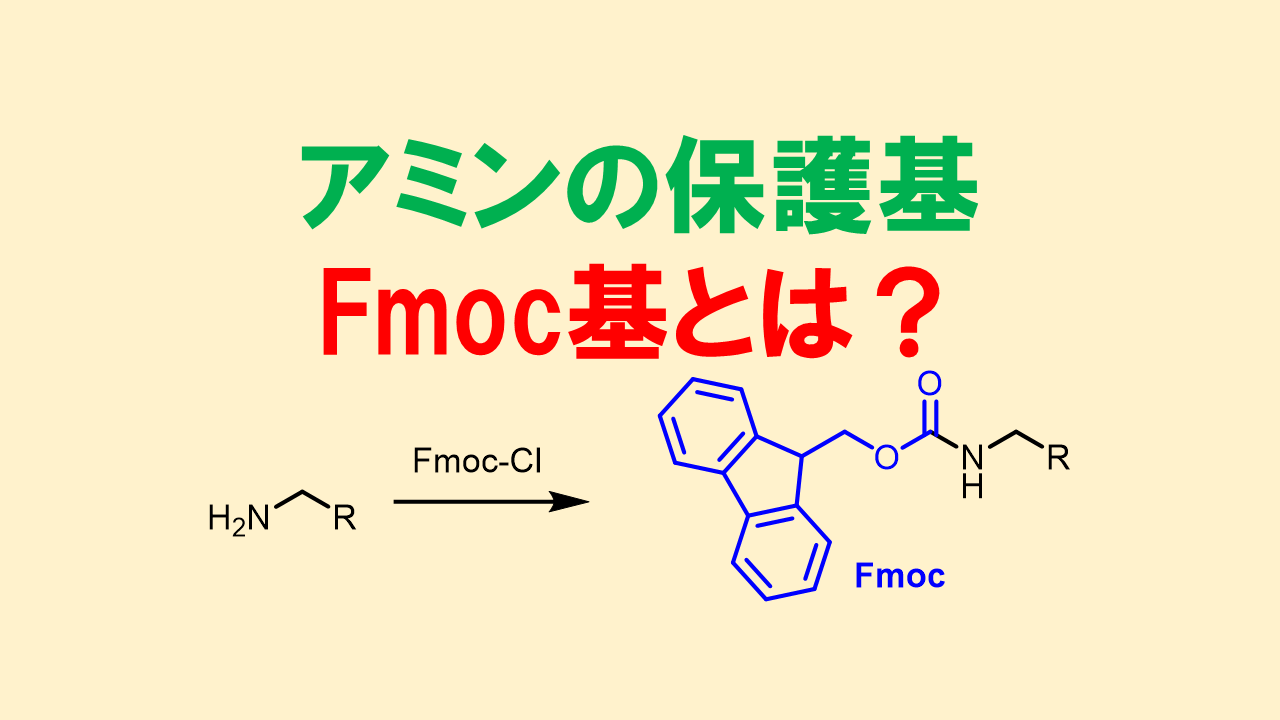
9-フルオレニルメチルオキシカルボニル基: Fmoc基(エフモック基)
Fmoc基はペプチド合成で最も利用される保護基です。Fmoc基の素晴らしい点は、塩基の中でも第二級アミン選択的な脱保護が可能という点です。Fmoc基の脱保護は主にピペリジンで行い、非常に早く完了します。酸性条件に耐え、弱塩基性程度なら耐えます。接触還元は反応してしまいます。脱保護時には除去が必要なフルオレン誘導体が生成する点はマイナスポイントです。
その他の条件で脱保護する保護基
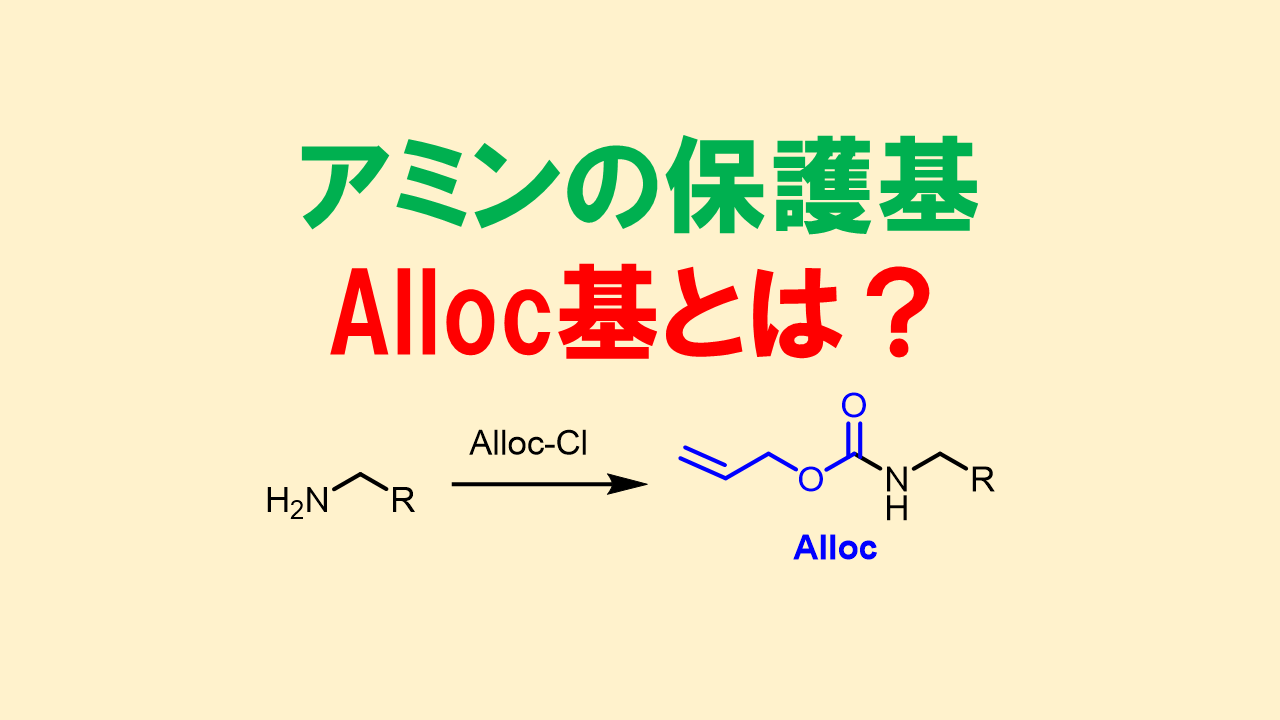
アリルオキシカルボニル基: Alloc基
Alloc基はパラジウム触媒(Pd(PPh3)4)で脱保護できる保護基で、他の保護基との直交性が高い点が特徴です。穏和な脱保護条件である点も良い点です。
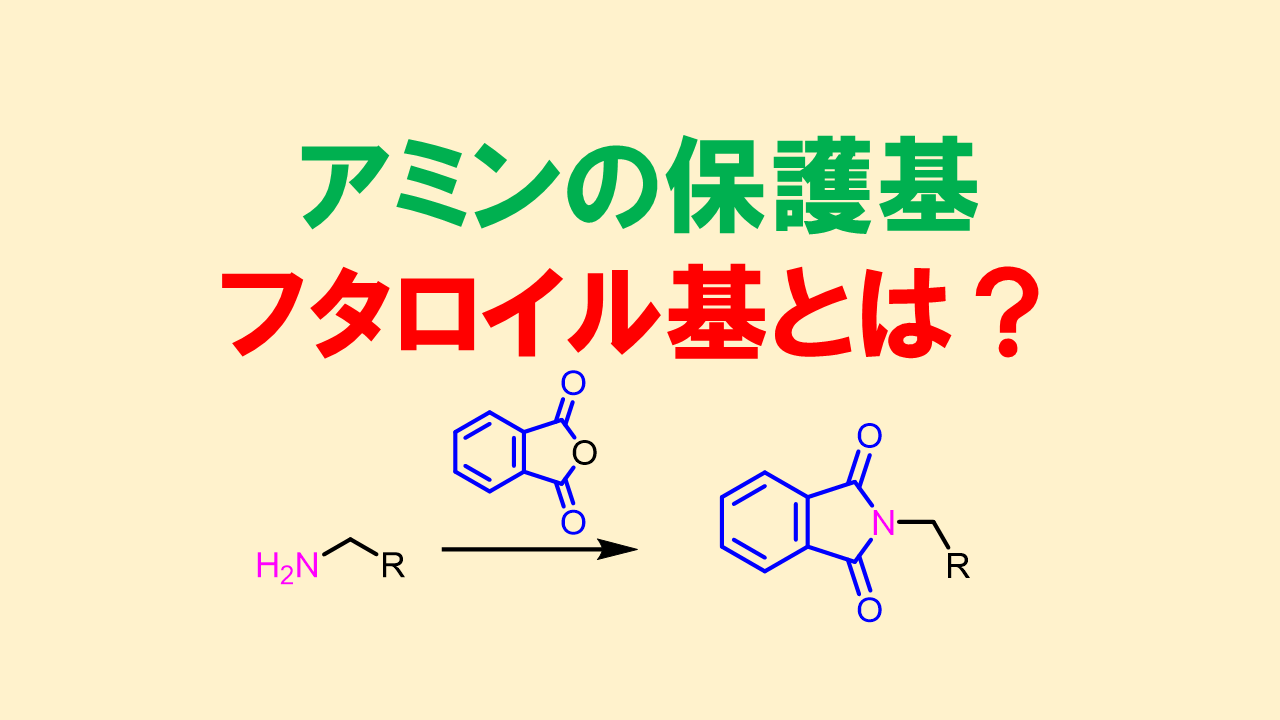
フタロイル基:Phth基
フタロイル基は第一級アミンに対して使われる保護基で、さまざまな条件下で安定な保護基です。一方で、強酸性や塩基性条件下では脱保護されたり、中途半端に外れてしまうというデメリットもあります。ヒドラジンを用いた脱保護方法はフタロイル基の脱保護ではスタンダードで有用です。
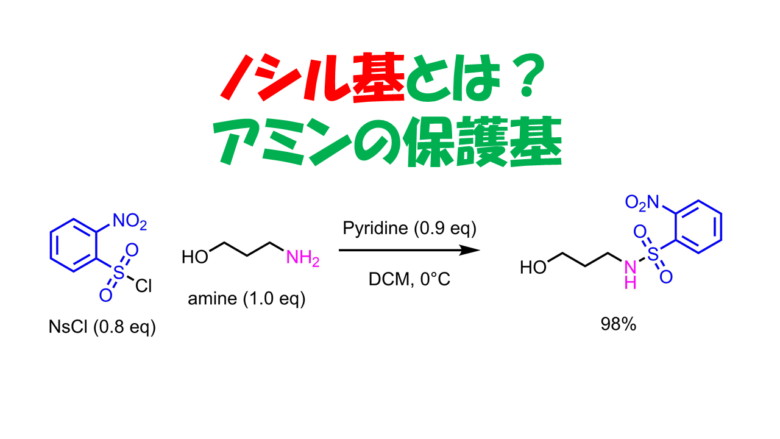
2-ニトロベンゼンスルホニル基:Ns基(ノシル基)
ノシル基はチオール(チオフェノール等)で脱保護できる保護基で直交性が高いです。さまざまな条件下で安定です。ノシル基で保護されたアミンのプロトンは酸性度が上昇するため、塩基で引抜いて求核置換させたり、光延反応によってアルキル化することができるため、アミン合成でよく使われます。
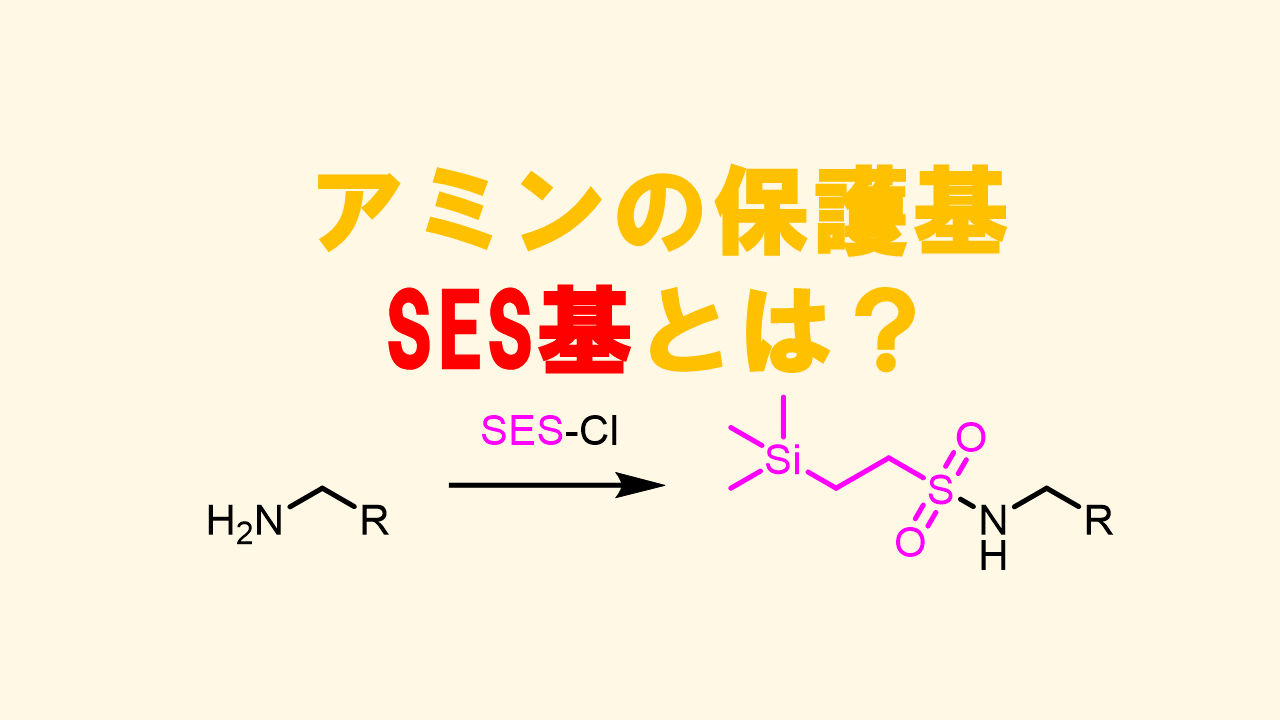
(2-トリメチルシリル)-エタンスルホニル基(SES基)
SES基はスルホニル系の保護基ですがフッ素源により容易に脱保護できて副生成物も揮発性のため精製が容易であるという特徴があります。スルホンアミド体はノシル基と同様に窒素化合物のビルディングブロックとしても使えます。
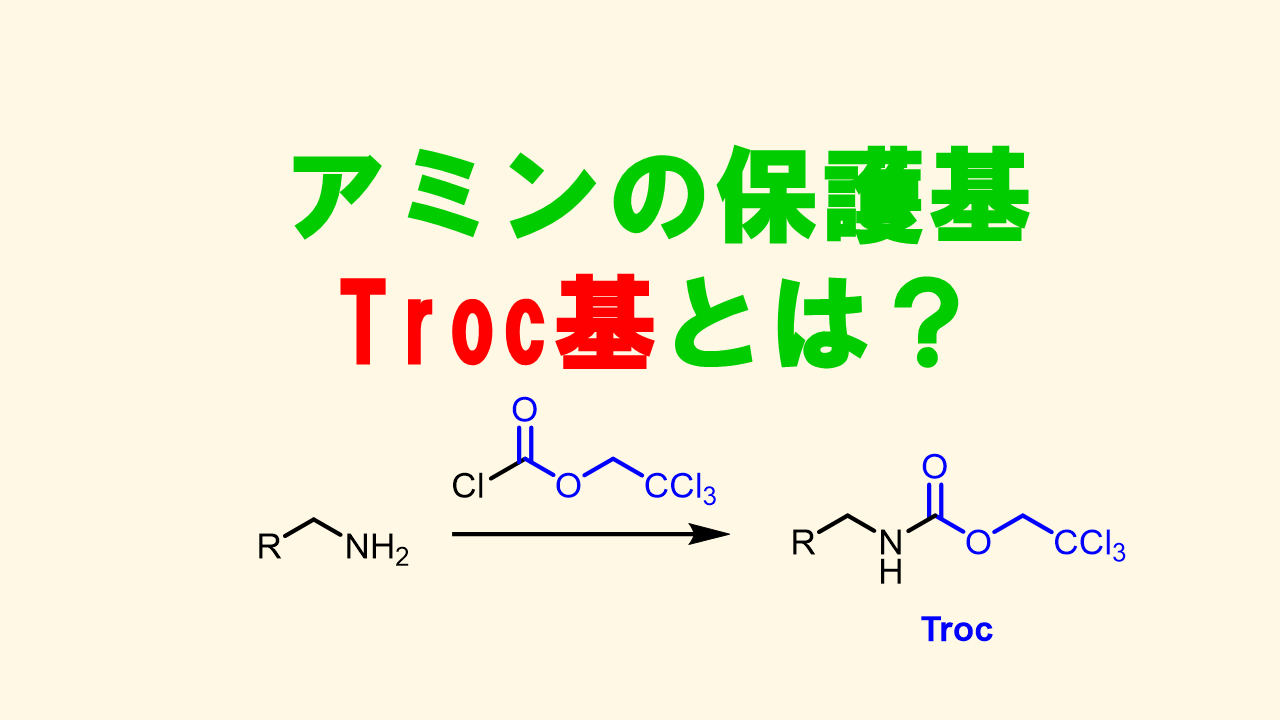
2, 2, 2-トリエトキシカルボニル基 (Troc基)
Troc基はZn-AcOH(一電子還元)によって温和に脱保護できる保護基です。酸塩基条件などに安定です。Troc基も直交性が高く、選択的な脱保護が可能です。
 Troc基によるアミンの保護 |亜鉛+酢酸で脱保護可能な保護基!
Troc基によるアミンの保護 |亜鉛+酢酸で脱保護可能な保護基!
アジド基

アジドでアミンの保護
アジドはR-N3という構造の化合物の総称であり、還元反応によってアミンを生成することからアミン合成の前駆体として利用されます。アジドは特段安定というわけではありませんが、アミンのような高い求核性はないので保護体として利用できます。一方で付加反応は起こしやすくその性質を利用した反応がシュタウディンガー反応です。シュタウディンガー反応は求核性あるホスフィンとアジドとの反応によりアミンを生成する反応です。
アジドはクリック反応(付加環化反応)を起こすためこれらから保護したい場合はかさ高いホスフィンにより保護する手法が開発されています。以下の論文ではクロスカップリング反応の配位子としても利用されるAmphosを使って保護できることを報告しています。
Meguro, Tomohiro, et al. “Transient Protection of Organic Azides from Click Reactions with Alkynes by Phosphazide Formation.” Organic letters 20.13 (2018): 4126-4130.
ニトリル基

ニトリルは比較的安定な物質であり、アミンのような求核性がないためアミンの保護体として利用できます。アミンからニトリルに変換して保護することはないと思いますが、アミンの前駆体として利用することも多いです。還元や加水分解を受けますが、同類の化合物群と比べてニトリルは反応性が低いので選択的に反応させることができます。