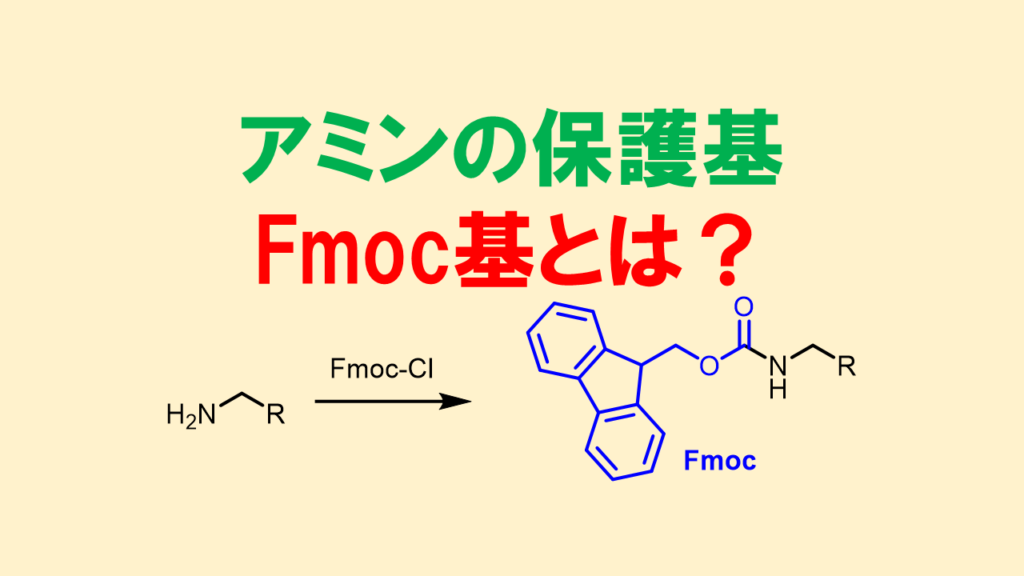
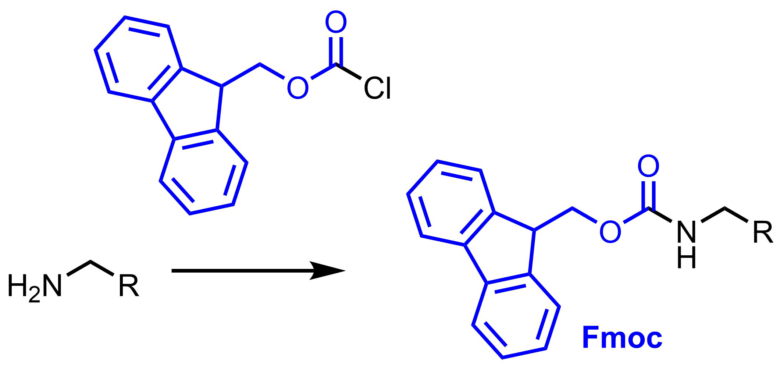
Fmoc基はFmoc法としてペプチド合成に多用されるアミンの保護基
Fmoc(エフモック)基は9-フルオレニルメチルオキシカルボニル基(9-fluorenylmethyloxycarbonyl group)の略で、カルバメート系のアミンの保護基です。塩基性条件でとりわけピペリジンなどの二級アミンにより速やかに脱保護されます。酸性や酸化条件に強いですが、還元(接触水素化)に弱く、塩基性条件においてもDIEAくらいなら耐えますが、DBUやTBAFといった塩基では脱保護されます。ピペリジンを用いた脱保護は速く、信頼性が高くペプチド合成でよく使用されています。
Fmoc保護の特徴・利点
Fmoc保護の利点や特徴は
- ペプチド合成を始めとしてたくさんの利用例がある
- 塩基性で脱保護できる保護基として有用
- Fmoc保護アミン体が販売されている
- 脱保護の信頼性が高い
Fmoc基はペプチド合成でも汎用され、よく使われるアミンの保護基であるBoc基とはオルソゴナルな保護基であることからよく組み合わせて利用されています。こうした背景があることから、Fmoc保護アミンがビルディングブロックとして購入可能なことも多いです。脱保護反応は定量的に進行することが多く信頼性が高いです。
欠点としては
- 保護化試薬(Fmoc-Cl, Fmoc-OSu)が比較的高い
- 脱保護時に生じる副生成物のために精製が必要
- 保護基の安定性は低め?
保護化試薬はよく使われる割に高めです。また、他のカルバメート系の保護基では脱保護時の副生成物がガスであるため濃縮するだけで目的物が得られますが、Fmoc基の場合、副生成物(フルオレン由来)の除去操作が必要になります。
Fmoc化の反応機構
Fmoc化の反応機構ー保護
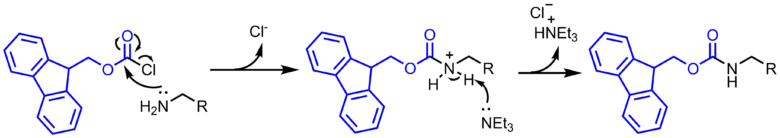
アミンがクロロギ酸のカルボニル炭素に攻撃します。脱離するのはより安定性の高い塩化物イオンです。アミンはプロトン化していおり、このプロトンをトリエチルアミンが奪って塩酸塩となり、Fmoc保護アミンが生成します。
Fmoc化の反応機構ー脱保護
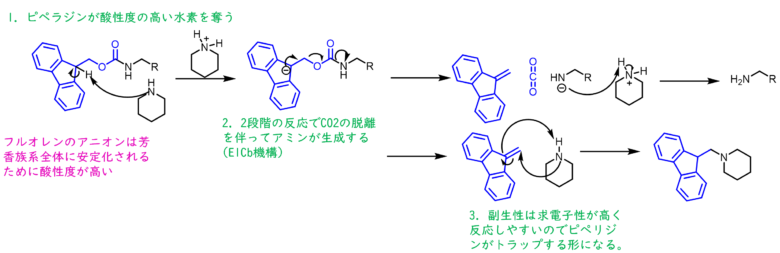
Fmocの脱保護は2段階で脱保護が進行します。フルオレニル基の水素は芳香族系による安定化を受けるため脱離しやすいです。フルオレンのアニオンが押し出すE1Cb機構によってβ脱離が進行して、アミンが生成します。副生成物は反応性が高く再度アミンと反応する可能性があるので、ピペラジンによってトラップする必要があります。したがって脱保護に使用するピペラジンは過剰に加えた方が良いです。
Fmoc保護の反応条件-保護
Fmoc保護は基本的には、ショッテンバウマン条件で行う事が多いですが、水を加えずにジクロロメタン中でトリエチルアミンなどの塩基を加えて反応を行ってもよいです。水溶性の高いアミノ酸などのアミンの場合などは溶媒に水を加えた条件のほうが溶解しやすいかもしれません。
Fmoc保護の条件例1
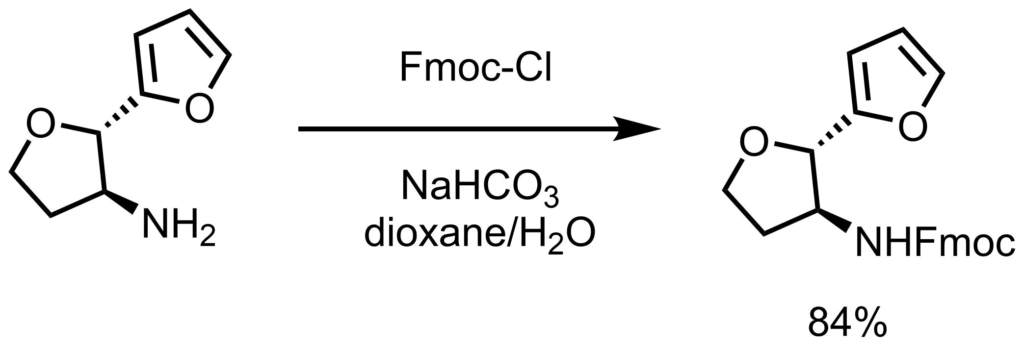 炭酸水素ナトリウム(1.2eq、3.92 mmol)を、ジオキサン−水(9:1mL)に溶解したアミン(1.0eq、3.26 mmol)の溶液に添加した。 5分後、Fmoc-Cl(1eq、3.92 mmol)を加えて室温で2時間撹拌した。 水(10 mL)を反応混合物に加えて酢酸エチル(3×30mL)で抽出した。有機層をブラインで洗浄、乾燥し(硫酸ナトリウム)濃縮後、フラッシュカラム(ヘキサン – 酢酸エチル(9:1)で精製し保護アミン(84%)で得た。Bates, R. W., et al. synlett. 2016, 27, 95.より引用
炭酸水素ナトリウム(1.2eq、3.92 mmol)を、ジオキサン−水(9:1mL)に溶解したアミン(1.0eq、3.26 mmol)の溶液に添加した。 5分後、Fmoc-Cl(1eq、3.92 mmol)を加えて室温で2時間撹拌した。 水(10 mL)を反応混合物に加えて酢酸エチル(3×30mL)で抽出した。有機層をブラインで洗浄、乾燥し(硫酸ナトリウム)濃縮後、フラッシュカラム(ヘキサン – 酢酸エチル(9:1)で精製し保護アミン(84%)で得た。Bates, R. W., et al. synlett. 2016, 27, 95.より引用
Fmoc-Clを用いた保護
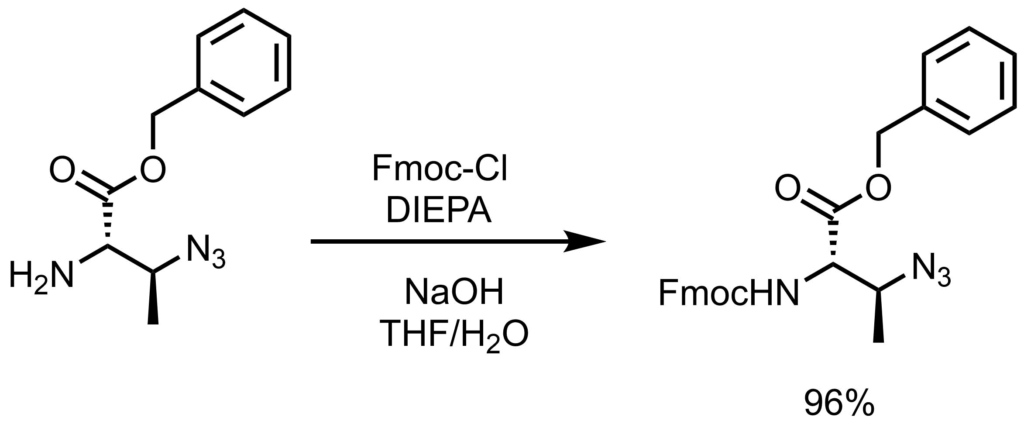
アミン(1 eq, 73 mmol) をTHF:水(255 mL:255 mL)に溶解し、0℃でNaOH(1 eq、73mmol)、DIEPA(1.1 eq、80.3 mmol)およびFmoc-Cl(1.1 eq、80.3 mmol)を加えた。 室温に戻しながら3時間撹拌した。 EtOAcで抽出し、0.5 M HClおよび食塩水で洗浄した後、有機相を乾燥(硫酸ナトリウム)し、フラッシュシリカゲルカラム(Hex:EtOAc 9:1から8:2)で精製し保護アミン(96%)で得た。Martin, M. J., et al. J. Am. Chem. Soc. 2014, 136, 6762. より引用
Fmoc-OSuもFmoc-Clと同等の反応性を有しており基本的にはどちらを使っても構わない。安いFmoc-Clの方を使用した方が良いかもしれないが、アミノ酸の保護はFmoc-OSuの使用をおすすめします。
脱保護反応例
Fmocの脱保護は20%ピペリジンinDMFを適当な量加えて脱保護する方法がペプチド合成では一般的のような気がします。溶媒はNMP, アセトニトリル等でも良いです。他に塩基としてはジエチルアミン、TBAFやDBUあるいはPd/Cによる接触還元により除去する方法もあります。
反応例1(ペプチド合成)
20% piperidine in DMF (5 mL/g beads)を加えて5分間反応後、溶液を除去して再度15分間反応させる。
1)Tanaka, K., et al. Acs. Chem.Biol. 2012, 7, 645. 2) Cho, Hong-Jun, et al. J. Org. Chem. 2012, 77, 9162
反応例2(TBAF)
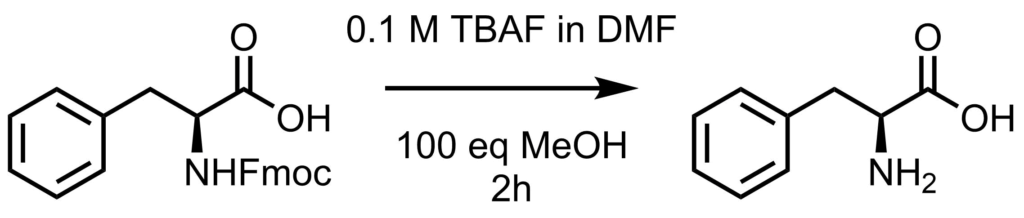
TBAFを用いて脱保護もできます。0.1 M TBAF in DMF溶液を溶媒量用いて100 eq MeOHを加えて反応させます。メタノールはフルオレン由来の活性中間体による副反応を防ぐためです。大体反応は1-2h程度で終了します。Masaaki, U., et al. Tetrahedron Lett. 1987, 28, 6620.
注意事項
- Fmoc-Clを用いてアミノ酸を保護するとカルボン酸を活性化させてアミド縮合を触媒する可能性があるので、FmocOSuを用いた方が良い。
- Fmoc基は塩基性条件(アミン)によって分解するので、反応終了後はアミンが残らないように気をつける。分液時にアミンを塩酸で塩にして除去するなどの工夫を行う。
参考まとめ
Wuts, Peter G. M.. Greene’s Protective Groups in Organic Synthesis Fifth edition(p.912). Wiley.
[blogcard url=”https://ja.wikipedia.org/wiki/9-%E3%83%95%E3%83%AB%E3%82%AA%E3%83%AC%E3%83%8B%E3%83%AB%E3%83%A1%E3%83%81%E3%83%AB%E3%82%AA%E3%82%AD%E3%82%B7%E3%82%AB%E3%83%AB%E3%83%9C%E3%83%8B%E3%83%AB%E5%9F%BA”]
[blogcard url=”https://en.wikipedia.org/wiki/Fluorenylmethyloxycarbonyl_protecting_group”]
[blogcard url=”https://www.chem-station.com/odos/2018/07/fmoc-protecting-g.html”]
[blogcard url=”https://www.organic-chemistry.org/protectivegroups/amino/fmoc-amino.htm”]