ノシル基とは?
ノシル基とはアミノ基を保護するのに用いられるスルホンアミド系の保護基で、強酸性条件や塩基性条件下でも安定ながら、温和な条件(K2CO3, チオフェノール)で脱保護可能である有用なアミンの保護基です。ノシル基は特に第二級、第三級アミンを合成するのに利用され、この手法は福山アミン合成法:Ns strategyと呼ばれています。直交性が高く、他の保護基と共存可能です。
ノシル基にはいくつかの種類があります。主なものは
- 2-ニトロベンゼンスルホニル: 2-nitrobenzenesulfonyl group = Ns
- 4-ニトロベンゼンスルホニル: 4-nitrobenzenesulfonyl group = pNs
アミン合成で有名な菅&福山先生らにより開発されたという話は有名です。 通常のスルフォンアミド系の保護基(TsやMs基)は脱保護条件が厳しいですがニトロ基の導入によってSNAr機構を介した温和な脱保護が可能となっています。
通常のスルフォンアミド系の保護基(TsやMs基)は脱保護条件が厳しいですがニトロ基の導入によってSNAr機構を介した温和な脱保護が可能となっています。
特徴・利点
ノシル基の特徴は、
- 酸や塩基性条件に安定
- 温和な条件で脱保護可能
- 他の保護機との組み合わせやすい
- キラルなアミンに対して保護・脱保護しても立体は保持される
- ジアミンのモノアルキル化が高収率で得られる
などがあります。保護に使われるNsClも安価で室温保存可能であり使いやすいです。
逆に欠点としては
- 脱保護に使用するチオフェノールが臭い
- 塩基性条件ではスルホンアミドのNHが脱プロトン化されて求核性をもつ
- 還元条件ではNs基のニトロ基が還元されてアミンに変換されてしまう
が挙げられます。チオフェノールの悪臭は有名で、きちんと次亜塩素酸ナトリウムで処理しないとニオイがとれません。チオフェノールの代わりに4-メルカプト安息香酸を使用すると無臭で脱保護できます。
私は平気ですが、チオフェノールのニオイが苦手な人がいるのでドラフト内で使用して、使用した器具などは次亜塩素酸ナトリウム水溶液に浸漬して脱臭しましょう。この方法は悪臭のあるチオール系の化合物全てに使えますよ
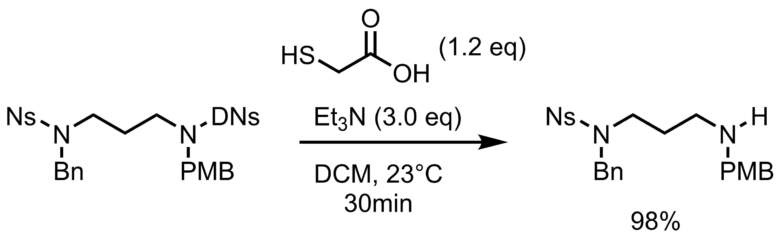
2,4-ジニトロベンゼンスルホニル基(DNs基)は、ニトロ基が2つあるため反応性が高く、アミンでも脱保護できるが、長時間の加熱などでも外れてしまうなど不安定なため使い所は難しいです。HSCH2CO2H + TEA によってNs基と区別して脱保護可能なのが利点です。
Fukuyama, T., et al. Tetrahedron letters, 1997, 38, 5831-5834.
4-nitrobenzensulfonyl(pNs基)はパラ置換ベンゼンであるため、反応性も同等でNMRもシンプルで見やすい点で有用です。オルト体のNsと同様に使用可能です。一方で、環状アミンの保護体等は脱保護時にニトロ基のイプソ位にチオールが攻撃することによって、ニトロ基が脱離する副反応が起こる可能性があります。2-nitrobenzensulfonyl : Ns基ではこのような副反応は起こらないので、安価なこちらを使用したほうが良いかも知れないです。
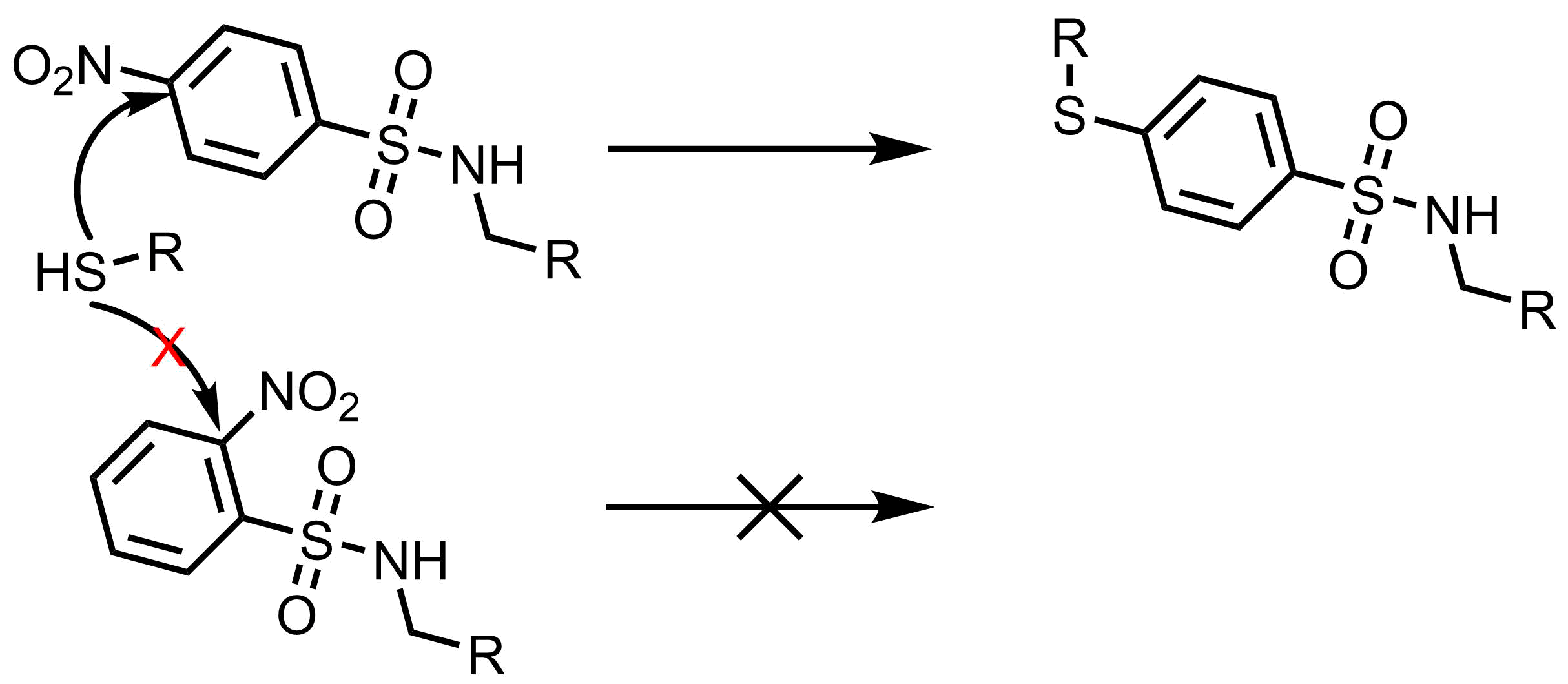 Wuts, Peter GM, and Jill M. Northuis. “A cautionary note on the use of p-nitrobenzenesulfonamides as protecting groups.” Tetrahedron letters 39.23 (1998): 3889-3890.
Wuts, Peter GM, and Jill M. Northuis. “A cautionary note on the use of p-nitrobenzenesulfonamides as protecting groups.” Tetrahedron letters 39.23 (1998): 3889-3890.
ノシル基は塩基性条件下でアルキルハライドもしくは光延条件下でアルコールを用いてアルキル化できるため、アミン合成に用いられます。
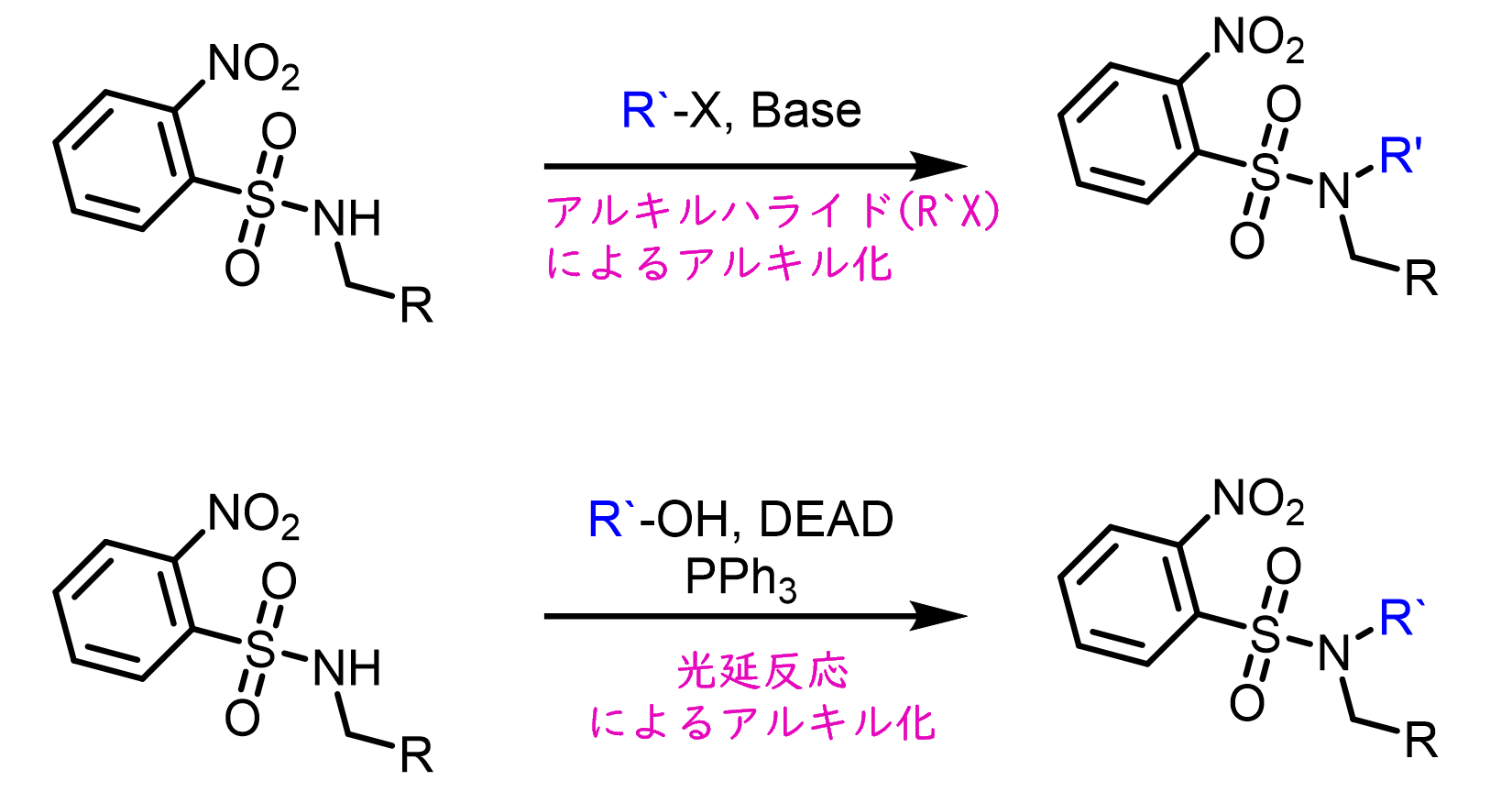
保護
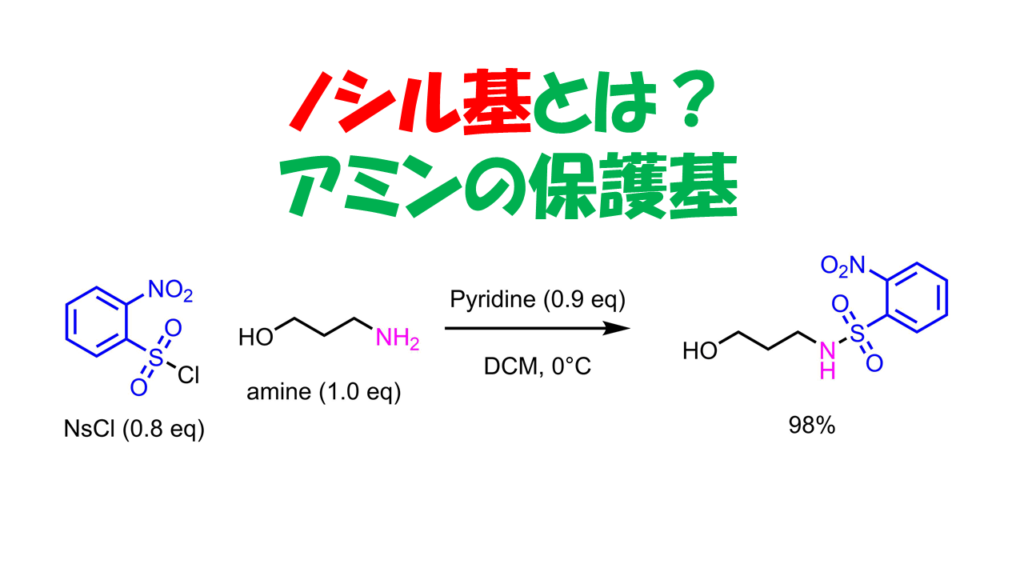
ノシル基の保護はNsClとアミンをトリエチルアミン、ピリジン等の塩基存在下で反応させることにより得ます。
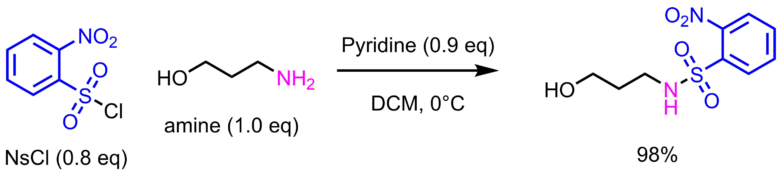
NsCl(0.8eq)を脱水ジクロロメタン(250 mM)で溶解させた後、アイスバスで0℃に冷却します。ピリジン(0.9eq)とアミン(1.0eq)を混ぜて滴下して加えます。その後、室温に戻しながら室温で1.5h撹拌します。反応後、水を加えてジクロロメタンで抽出、有機層をNa2SO4で脱水、濃縮後カラムクロマトグラフィーで精製し、目的物98%で得た。
塩基はトリエチルアミンやピリジン、DIEPA、Na2CO3, K2CO3, NaHCO3, 酢酸ナトリウムが使われます。NaHCO3水溶液を使ったショッテンバウマン条件も利用可能です。
溶媒はジクロロメタンを利用する例が多く、次いでTHFが多いです。メタノール(水)、DMF、アセトニトリルなども使われます。
脱保護
脱保護は塩基(K2CO3)存在下でチオフェノール(チオール)を作用させることによって得ます。
脱保護はチオールがノシル基のスルホンアミドのイプソ位を攻撃してSNAr機構を経て進行します。
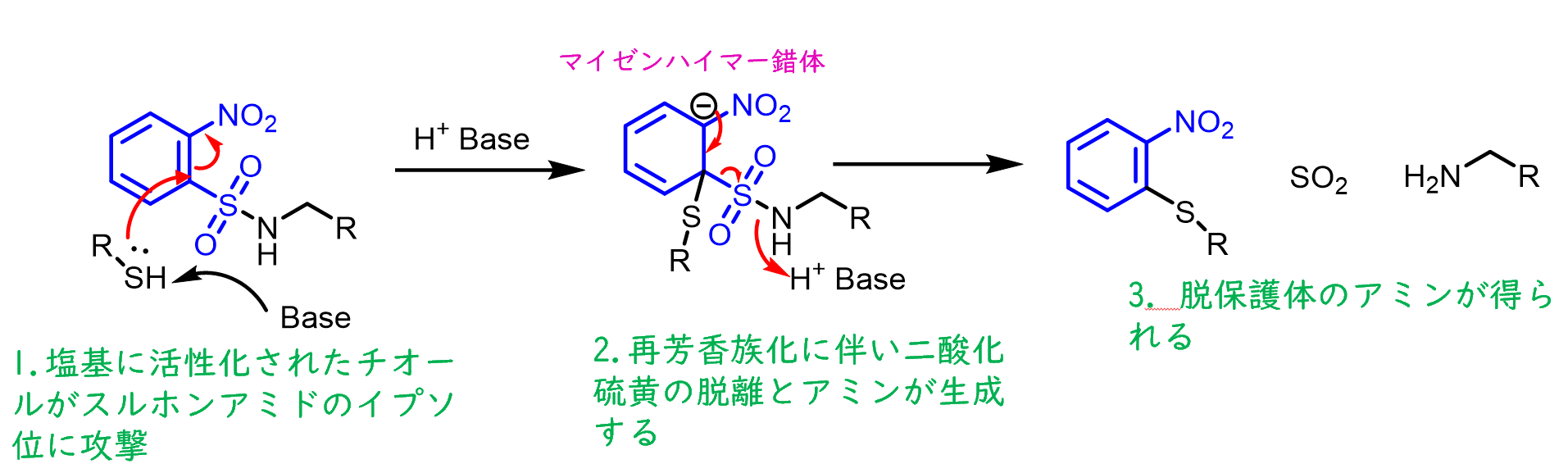
スルホンアミドのベンゼン還上に強力な電子吸引基(NO2)があるため、マイゼンハイマー錯体が安定化しています。
脱保護の反応例
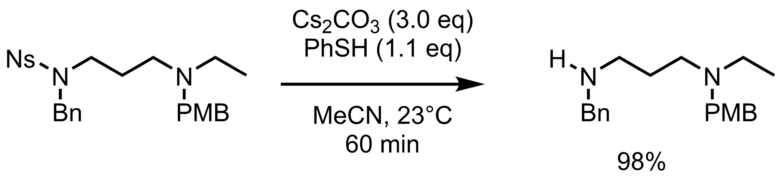
保護アミン(1eq)をアセトニトリル(250 mM)に溶解させ、炭酸セシウム(3.0 eq)に続いてチオフェノール(1.1 eq)を滴下して加えます。その後室温で60分間撹拌させて反応させたあと、(濃縮し、)水を加えて、ジクロロメタンで抽出します。乾燥、濃縮後、クロマトグラフィーで生成して目的物(98%)で得ます。使用した器具は次亜塩素酸ナトリウム水溶液にニオイがなくなるまで浸漬します。
*チオフェノールは古いと酸化されているかもしれないので注意します。ドラフトで扱いましょう。
マイゼンハイマー錯体(マイゼンハイマーさくたい、英: Meisenheimer complex)とは有機反応化学で扱われる反応中間体のひとつで、電子求引基を持つ芳香環に求核剤が 1:1 の比で付加して生じるアニオン。 芳香族求核置換反応の SNAr 反応で中間体とされる。 wikipedia:マイゼンハイマー錯体より引用
注意事項
ノシル基はアミン合成に使われるだけあって、特定の条件下においてアミン窒素は反応性を有する点に注意が必要です。塩基存在下では、ブロモアルキル等の求電子剤と反応してアルキル化してしまいます。また、還元条件ではノシル基のニトロ基がアミノ基に変換されてしまい、また、チオールで脱保護されるのでチオールを含む化合物は使用できません。ただし求電子剤が存在しない条件では塩基性条件においても安定であり、酸性条件に強く、酸化にも耐えます。