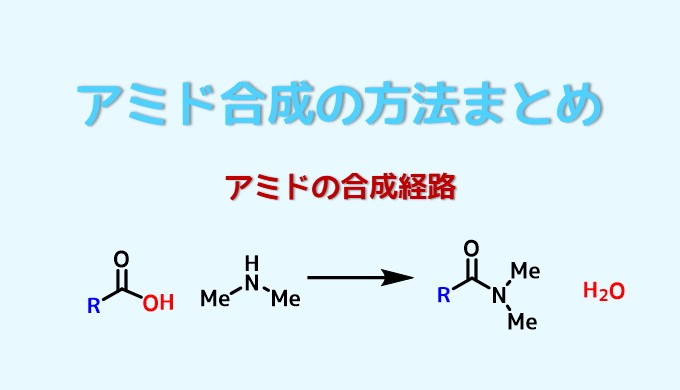
アミドはカルボン酸とアミンが結合した形を持っている工業や生命にとって重要な物質です。
丈夫なナイロン繊維はアミド結合で連結されたポリマーです!
アミド結合は別名ペプチド結合と呼ばれていて、タンパク質を構成するアミノ酸同士を繋いでいる結合であるんです。
アミドは有機合成でも非常に重要な構造・分子なので合成法を知っておくのは役立つと思いますよ!
この記事ではアミドとは何か?アミドの合成方法とは?をまとめて紹介します!
アミドとは?カルボン酸とアミンの脱水縮合反応の生成物!
普通「アミド」と言ったらカルボン酸とアミンが脱水縮合によって生成した「カルボン酸アミド」を指します。(スルホンアミド、ホスフィンアミドなどもある)
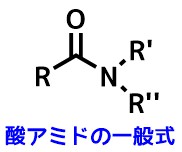
酸アミドの一般式 単にアミドやカルボン酸アミドと呼ばれる
生体を構成するタンパク質もアミドです。上の図のCONHの結合を「アミド結合(ペプチド結合)」と呼んでいます。
このアミド結合はつなぎやすく、それでいて丈夫なのが特徴です。
有機合成でもお世話になるアミドを作る反応はたくさん研究されています!
アミド結合はエステル結合などと比較して強固であることから、分子団同士をつなぐ結合(クロスリンカー)としてもよく使われています。
アミドには第一級~第三級までの分類があります。
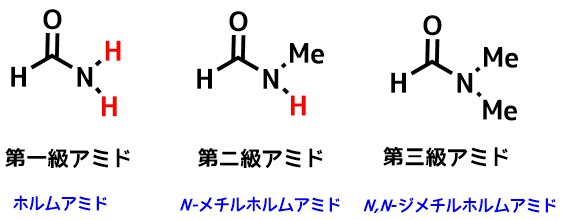
アミドの級数の分類
第一級アミドはN上の置換基が全てHのものです。一方で第二級アミドはHが一つ、第三級アミドは3つ全てがアルキル基に置換されてものです。
有名な第三級アミドはジメチルホルムアミド(DMF)です。
アミド化反応の基本と概要
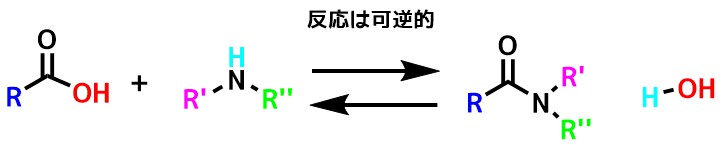
カルボン酸とアミンの反応式
基本的なアミドの合成はカルボン酸とアミン同士を繋ぐ方法です。
この方法ではカルボン酸とアミンが反応すると、水が副生成物としてでてくる反応になります(脱水縮合)。
この反応は逆に水とアミドが反応することも考えられ、これは実際に起こって、カルボン酸とアミンが生成します(加水分解)。
このような可逆的な反応の場合そのままでは目的のアミドを大量に得るのは難しいです。
どうにかアミド生成の方向に偏らせることができないでしょうか?
そこで、水を取り除くという操作をやってみます。
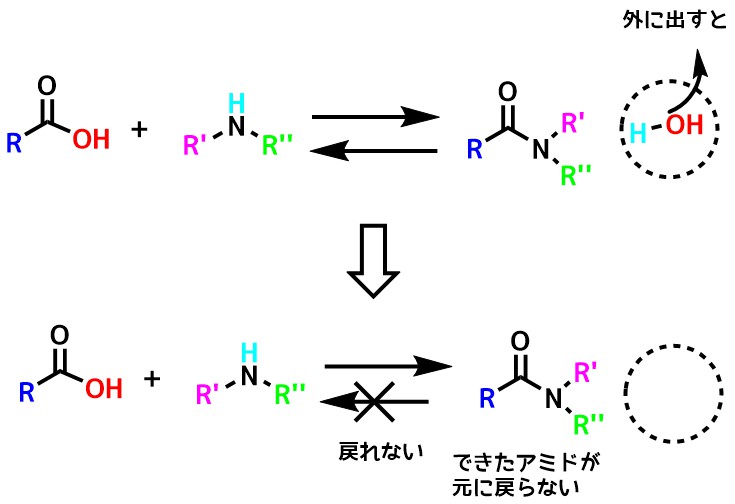
アミド生成に反応を偏らせる
この反応で水を取り出してやるとアミドができる反応しか進行しなくなります。つまり反応は→にしか行かなくなります。
これで高収率にアミドを得ることができるようになります。
このように反応を分析するときは「副生成物」に注目するのも重要です。
アミド合成の概要
アミド合成にはカルボン酸とアミンの脱水縮合以外にもたくさんの方法があります。
アミドを得る経路をまとめた図を下に載せます。
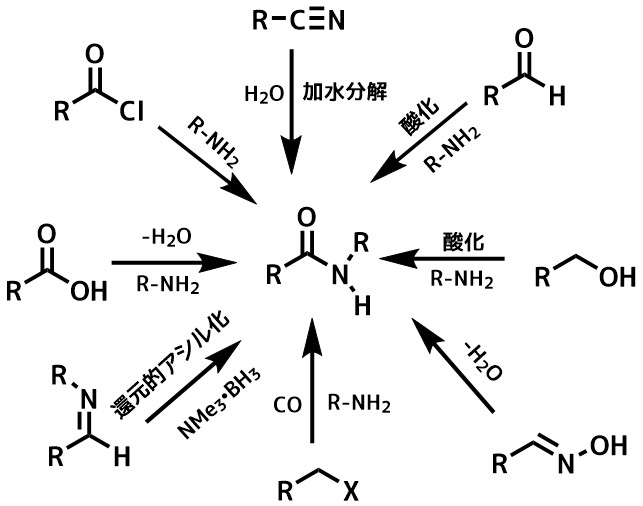
アミドの合成概要
この中で最もよく利用されるのはカルボン酸とアミンとの反応です。
図中の多くの物質はカルボン酸に変換可能で、直接アミドに誘導できる分子でもカルボン酸に変換してからアミドを作るという場合も結構あります。
各反応の概要
アミドを合成する反応は
- カルボン酸+アミン
- 酸塩化物+アミン
- ニトリルの加水分解
- アルデヒドからアミド
- イミンの還元的アシル化
などがあります。一つずつ代表的な方法などを交えて紹介します。
カルボン酸+アミンの脱水縮合
カルボン酸とアミンとの縮合でアミドを得る方法は最も一般的なアミド合成法の一つです。
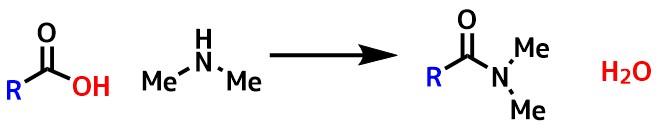
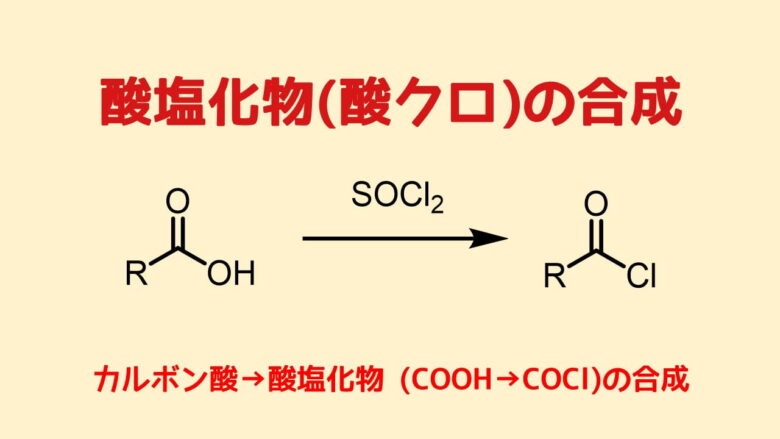
しかし通常はカルボン酸の反応性が低いので、反応性の高い酸塩化物に変換してからアミンと反応せさてアミドを作ります。酸塩化物は簡単に合成できます。
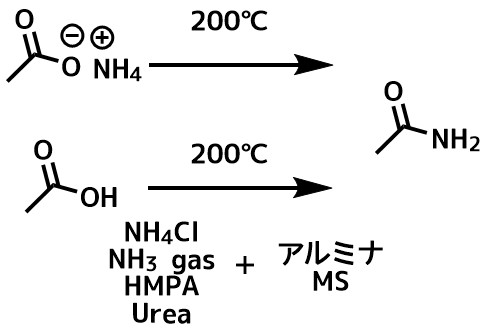
単純で安定な化合物の場合は、アミンとカルボン酸を混合して高熱・加圧(200℃くらいで密閉)して反応させる方法もあります。
また、ペプチド合成の分野で発展しているカルボン酸を活性エステルとしてから反応させる方法、いわゆる縮合剤を用いた方法も簡便で信頼性の高い方法として重用されています。
直接カルボン酸とアミンを反応
第一級カルボン酸アミドはカルボン酸のアンモニウム塩を加熱蒸留、または封管中加熱して得られます。
封管中カルボン酸ナトリウム塩と塩化アンモニウム200度くらいに熱しても良いです。
アンモニア源としてアンモニアガスや尿素、HMPAなどを使っても良いです。
より反応を進行させるために脱水剤としてアルミナやモレキュラーシーブスなどを加えることもあります。
カルボン酸を活性化してアミドを合成(縮合剤の使用)
カルボン酸の求電子性を向上させてアミド化反応を進行させるタイプの反応です。
大きく分けて
- 単離するタイプ
- 直接アミンと混合させるタイプ
の2種類があります。
活性エステル法
BOP試薬やHATUなどの縮合剤はカルボン酸活性化体を単離しませんが、活性エステルは安定に単離することができるものが多いです。
活性エステルはアミンと混合させるだけでアミドが得られ、アミンにカルボン酸があっても選択的に活性エステルがアミドになります。
欠点は二段階になること、ラセミ化を起こしやすいことなどがあります。
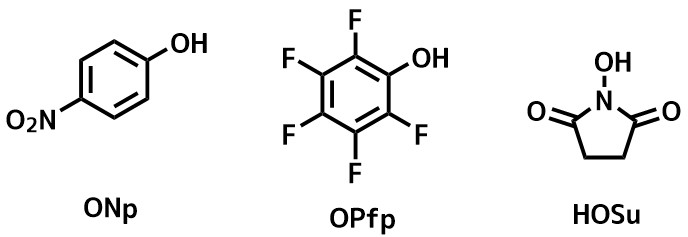
代表的な活性エステル
混合させて反応させるタイプ
アミンとカルボン酸存在下に縮合剤を加えて反応させるタイプです。
様々な縮合剤があります。
- カルボジイミド (DCC, EDC、DIPC)
- カルボニルジイミダゾール系(CDI、CDT)
- トリアジン系縮合剤 (DMT-MM)
- ホスホニウム系縮合剤 (BOP, pyBOP)
- ウロニウム系縮合剤 (HATU, HBTU, COMU)
- リン酸系縮合剤 (DPPA, DEPC)
カルボジイミド系縮合剤
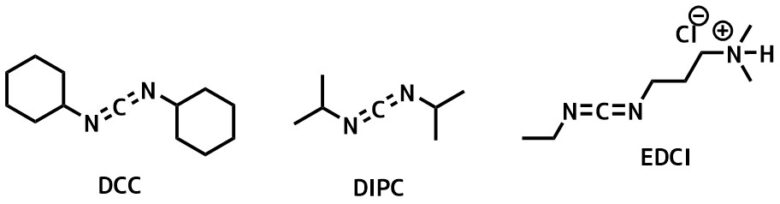
カルボジイミド縮合剤一覧
安価で中性条件で進行する縮合剤の代表格
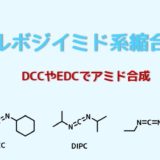
カルボニルジイミダゾール系縮合剤
カルボニルジイミダゾール
CDIは反応性の高い縮合剤で、アミドだけでなく、エステル合成にもよく利用されています。
ラセミ化しやすい点からペプチド合成ではあまり使用されていません。
カルボン酸と反応させてアシルイミダゾールとしてからアミンと反応させます。
トリアジン系縮合剤
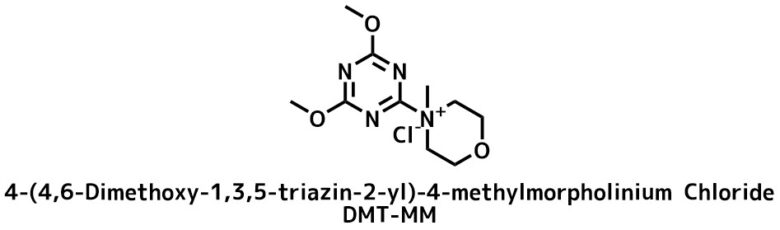
DMT-MMの構造
DMT-MMは最も新しい種類の縮合剤の一つです。水・アルコール存在下でもアミン選択的にアミド化できます。ジクロロメタンやクロロホルムは溶媒として使用できないのに注意!
糖や水溶性アミンなどに適しています。また、塩基を加えればアミドだけでなく、エステル合成も可能です。
DMT-MMを選ぶ利点は水やアルコール存在下でもアミド化が進行することです。ラセミ化も起こりにくくペプチド合成に適しています。副生物も水洗除去できます。
5g, 7700円(TCI)
ホスホニウム系縮合剤
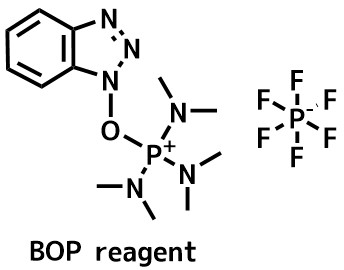
BOP試薬の構造 5g 3300円(TCI)
BOP試薬(別名カストロ試薬)は有名な縮合剤でベンゾトリアゾールとトリスジメチルアミノホスホニウムからなる塩です。
BOP試薬は反応が早く高効率なアミド化試薬として定評があります。
欠点は副生するHMPA由来の毒性です。これを改善したpyBOPもあります。BOP試薬系は立体障害に強いようです。
ウロニウム系縮合剤 (HATU、HBTU、COMU)
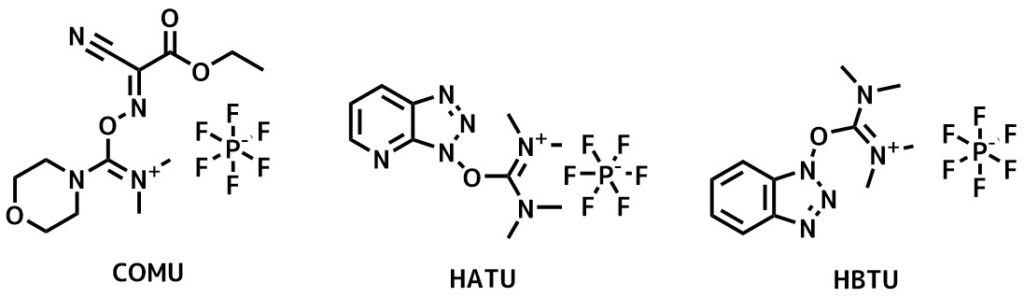
COMUは新世代の縮合剤の一つで、ベンゾトリアゾールを含む縮合剤で最強のHTATUと同等以上の成績を有しています。
HATUやHBTUはペプチド合成でもよく利用されている試薬で、ラセミ化が起こりにくいです。
HBTUはよく利用される縮合剤です。収率などはHATUやCOMUに劣りますが、DCC系よりも反応が早く収率も高く、通常時の使用に向きます。
リン酸系縮合剤
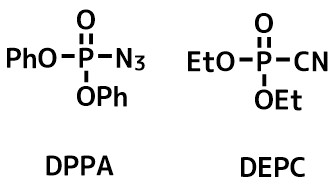
リン酸系縮合剤
酸アジドは優秀なアミド前駆体です。ジフェニルリン酸アジド(DPPA)はカルボン酸から容易に酸アジドを作ることができる試薬です。DEPCはDPPAの改良版です。環状アミドの合成に向いています。
酸塩化物からアミド合成
酸塩化物はカルボン酸とは比べ物にならないほど反応性が高く、容易にアミンと反応してアミドが生成します。
カルボニル基の炭素は電気陰性度の高い酸素だけでなく、塩素からも引っ張られるため、非常に求電子性が上がっています。
酸塩化物は最も簡単で反応性・信頼性が高いアミドの合成原料です。一部、酸塩化物を作るのに適していない原料の場合は別法を使います。
酸塩化物の合成は別記事を参考にしてください。

第一級アミド(RCONH2)の合成は、酸塩化物と炭酸アンモニウムまたはアンモニア、アンモニア水を反応させると簡単に得られます。
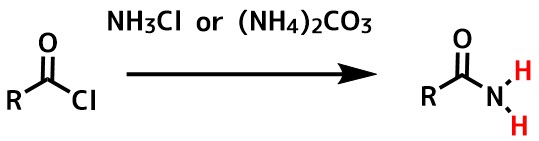
第一級アミドの合成 濃アンモニア水に酸塩化物を滴下して加える方法や炭酸アンモニウムや塩化アンモニウムを使う方法もある。
酸塩化物を使用するときの注意点としては、
- 低温で
- ゆっくりと滴下
- 副生する塩酸をトラップ
するのが重要です。
0℃~15℃付近まで冷却したアミン溶液にゆっくりと酸塩化物を滴下します。反応熱によって温度が上昇しすぎるとアミドが更に酸塩化物と反応してイミドが生成することがあります。
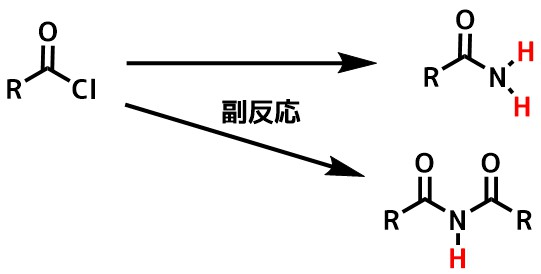
酸塩化物が再度アミドと反応してしまうこともある
酸塩化物はアミンと反応するとHClが副生します。HClはアミンと反応して塩酸塩になると反応性が落ちるので、トリエチルアミンなどの塩基を共存させて反応を行うのが普通です(アミンを過剰に加えても良い)。
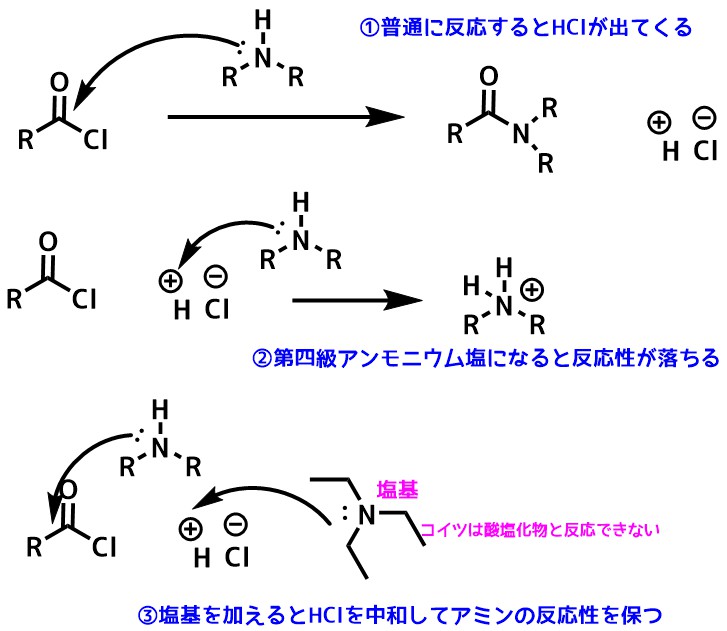
酸塩化物の副生成物のHClが反応を邪魔する
ショッテンバウマン条件 塩基性水溶液で反応!
酸塩化物を経由する反応で代表的な条件は「ショッテンバウマン条件」です。
ショッテンバウマン条件はNaHCO3などの無機塩基の水溶液とアミン中に酸塩化物を滴下させて反応させる方法です。
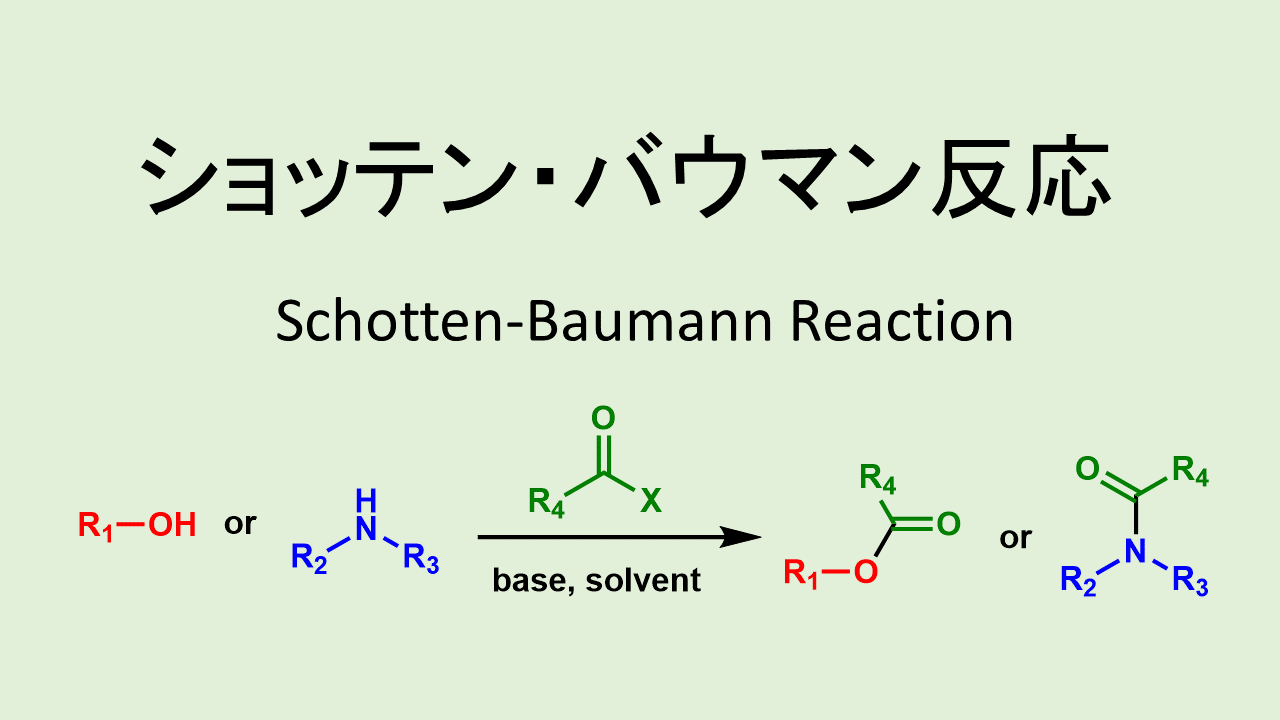 ショッテン バウマン反応: Schotten-Baumann Reaction
ショッテン バウマン反応: Schotten-Baumann Reaction
芳香族酸塩化物や長鎖カルボン酸塩化物などはすぐに加水分解されないので使えます。
工業的な利点(安価)の他、水溶性の高いアミン(アミノ酸とか)を水に溶かして反応できるというメリットがあります。望まない部位のアシル化を防いだり、二相系ならそのまま分液できるので精製が楽です。
酸無水物との反応
酸無水物は酸塩化物よりも反応性が低いですが、アミンと容易に反応してアミドを生成します。
カルボン酸を酸無水物に誘導してアミド合成を行うことはまれですが、無水酢酸や無水フタル酸などの合成原料としてはよく利用します。
代表例はアセチル化保護に利用する無水酢酸で、塩基触媒としては酢酸ナトリウムやピリジンがよく利用されています。
酸無水物は片側が反応に使われない点も合成中間体として利用しにくい理由の一つかもしれません。
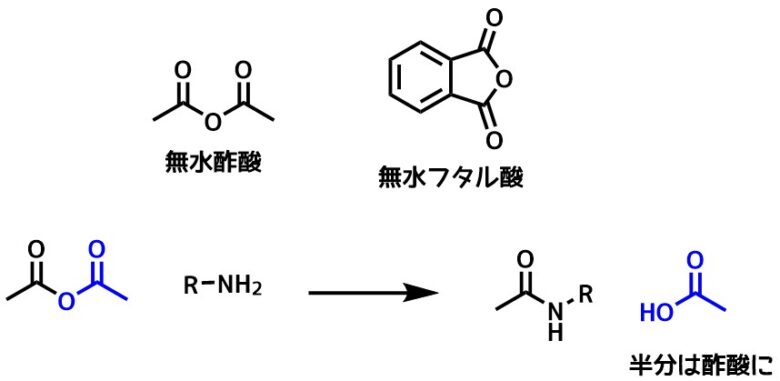
酸無水物の反応
アミド化が上手く進行しない時
アミンをイオン化して反応性を上げる
酸塩化物は最も反応性の高いといっても過言ではないため、他の縮合剤などを利用してもうまく進行しないことが多いです。
この場合はアミンの求核性が低くて反応が進行しない場合があります。
この場合は予めアミンと強塩基を作用させて金属アミドとして求核性を上げてから反応させるとうまくいくことがあります。立体障害の大きいアミンなどは有効です。
アミンのTMS化
アミンをよりカチオンになりやすいTMS化してTMS-アミンを酸塩化物と反応させると反応性が低いアミンでも良い収率で得られる事がある。芳香族アミンなどで有用であり、プロトンの代わりにTMSが放出されるので酸が副生しないのも利点の一つです。
ニトリルの加水分解
ニトリルを酸によって加水分解するとアミドが得られます。
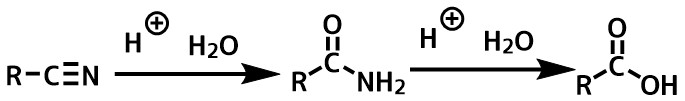
ニトリルの加水分解
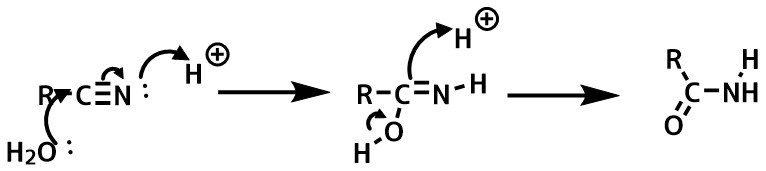
長時間反応させるとカルボン酸まで加水分解が進行してしまうので注意します。
立体障害の大きいニトリルは加水分解を受けにくく、還流が必要な場合があります。
おすすめは臭化水素-酢酸で、高収率でアミドを得ることが可能です。臭化水素-酢酸は臭化水素酸に無水酢酸を滴下して調製することが可能です。
酸ではなくアルカリ性加水分解ではアミドで止めるのは難しいです。
アルカリ性条件では過酸化水素とともに加水分解するとアミドが得られます。
ニトリルの還元
無水酢酸中ラネーニッケル、漆原ニッケルなどで還元してもアミドが得られます。
ニトリルの酸化
ニトリルを過剰量の二酸化マンガンで処理するとアミドが生成します。溶媒はジクロロメタンなどを用います。
アルデヒドから合成
芳香族アルデヒドを二酸化マンガンとアミン存在下で反応させると
アミドになります。
その他のアミドの合成法
有機合成上有用ではなかったり、使いにくい、マイナーな反応を紹介します。
エステルからアミドに変換 (Direct amidation of esters)
第一級アミドはアンモニア/アルコール溶液を加熱して得ます。200℃くらいまで熱をかける場合もあります。
原料(エステル及びアミン)の沸点が低い場合は密栓しましょう。
エステルからアミドへの直接変換は注目点の一つ!
しばしば合成上の理由でカルボン酸はエステルになっています。
エステルからアミドに変換するときは、
エステル→カルボン酸→酸塩化物(活性エステル)→アミド
という方法をとることが多いですが、ダイレクトに
エステル→アミド
とすることができればステップを大幅に短縮可能です。
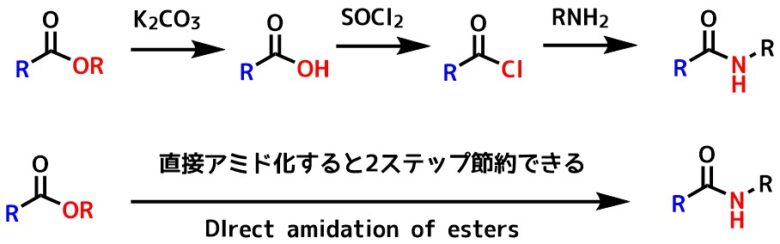
エステルの直接的アミド化
そのため、エステルからアミドへの変換は研究的に興味を持たれる分野でもあります。
塩基触媒を使った直接的アミド化
塩基触媒を使ったアミド化は金属ルイス塩基やNHC触媒、DBU、TBDなどを使ったものが報告されていますが、Takashi Ohshimaらは単純なアルコキシドであるNaOMeが有用な触媒であることを見出しました。
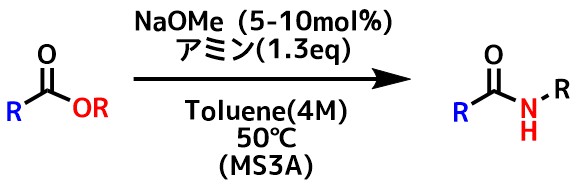
NaOMe直接アミド化
溶媒はヘキサンやトルエンといった非極性溶媒中およびTHF、 1,4-dioxane、NMPで進行しますがアルコールやMeCNでは進行しないようです。
水は反応の効率を低下させるので、MSの添加が有効です。
第一級アミン、Bnアミン、Cy-Hexアミンはスムーズに進行していますが、立体障害の大きいアミンは収率が低下します。
4-トリフルオロメチルフェノールを添加するとエピメリ化を効果的に抑制できるため、ペプチド合成にも利用できます。
欠点
反応時間は約24時間程度かかります。
この報告ではメチルエステルに限定されています。よく利用されているt-butylエステルは進行しません。イソプロピルエステルも収率は低いです。エチルエステルはメチルエステルと同等の収率を得るには3倍ほどの時間がかかります。
また、電子豊富なエステルの反応は長時間必要です。
Ohshima, Takashi, et al. “Sodium methoxide: a simple but highly efficient catalyst for the direct amidation of esters.” Chemical Communications 48.44 (2012): 5434-5436.
また、7.5mol%の水酸化リチウム、溶媒なし、200℃でアミド化する方法も報告されています。こちらはラクトンの開環→アミドも可能のようですが、反応温度の高さは欠点です。
Miller, Shelli A., and Nicholas E. Leadbeater. “Direct, rapid, solvent-free conversion of unactivated esters to amides using lithium hydroxide as a catalyst.” RSC Advances 5.113 (2015): 93248-93251.
エステルとニトロアレーンを使った直接的アミド化
求核性の低いアニリン類のアミド化は求核アシル置換反応によるアミド合成は上手く行かないことがあります。
CheungらはAr-NO2とエステルを使った直接的アミド化を報告しています。
触媒としてNi(glyme)Cl2, Zn, TMSClを加えて、NMP中90℃で16時間の条件です。
アリールカルボン酸では収率が中程度です。
機構としてはアゾベンゼンが活性中間体として機能していると考察されています。
実際に使用するには色々課題がありそうですが、
Cheung, Chi Wai, Marten Leendert Ploeger, and Xile Hu. “Direct amidation of esters with nitroarenes.” Nature communications 8 (2017): 14878.
ルイス酸触媒-直接的アミド化
ランタノイドトリフラートは安定なルイス酸触媒として様々なところで応用されていますが、これをアミド化に利用しています。
この方法は不飽和カルボン酸からアニリン類まで多くの基質で幅広く利用できる利点があります。
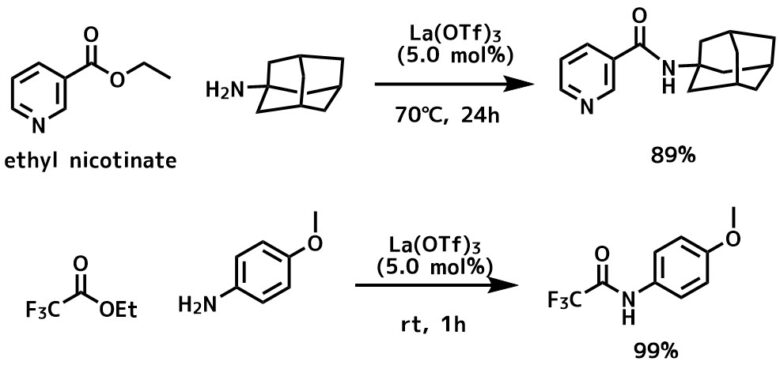
ランタノイドトリフラートによる直接的アミド化
エピメリ化もほとんど起こらなかったというのもポイントです。
αハロケトンエステルはエステルのアミド化が優先的に進行し、アルキニルエステルは、アミンのアルキンへの付加よりもアミド化が進行します。
反応条件
エステル(1eq), アミン(1.2eq), La(OTf)3 (5mol%), トルエン(2M)中でrt~70℃で反応させ、ほとんどが24時間以内に完結します。
Morimoto, Hiroyuki, et al. “Lanthanum (III) triflate catalyzed direct amidation of esters.” Organic letters 16.7 (2014): 2018-2021.
NHCリガンド+Niカップリング
ランタノイドトリフラートを使用した方法は温和かつ選択的、経済的ですが、酸や塩基触媒を利用することはエステルのα位およびその他の部位に対する潜在的な副反応の可能性をはらんでいます。
NHCリガンドとニッケル触媒を利用した方法は酸や塩基を用いない点で副反応が低減され、実際にエピ化やアセタール、マイケルアクセプター、SNAr求電子剤などと反応することなく利用できる利点があります。
一般的なNHCリガンドのIPr以外にもNHCリガンドを変えることでより高収率化できます。
欠点はNi(COD)2の空気安定性の低さと市販されていないNHCリガンドの利用です。
Zheng, Yan-Long, and Stephen G. Newman. “Methyl Esters as Cross-Coupling Electrophiles: Direct Synthesis of Amide Bonds.” ACS Catalysis 9 (2019): 4426-4433.
イソシアネート+Grignard試薬
イソシアネートに対してグリニャール試薬を作用させると対応するアミドが得られます。
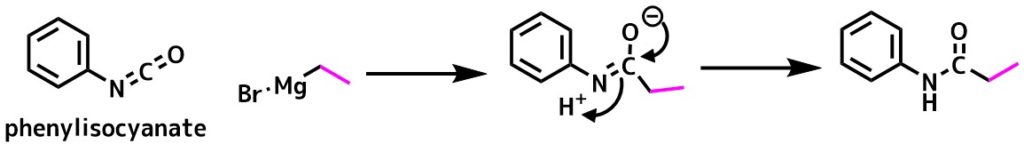
グリニャール試薬を使ったアミド化
イソシアネートは酢酸と反応させて酸無水物とした後、酸無水物を加熱により脱炭酸すれば第一級アミドが得られます。
アミド化の反応機構
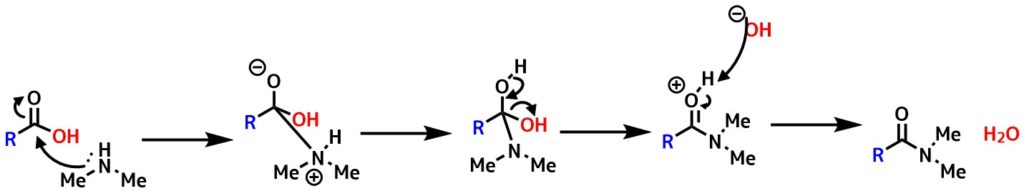
アミド化の反応機構
アミド化はアミンのカルボン酸への攻撃によって始まります。その後水酸化物イオンが脱離してアミドができます。
参考文献
1) Pattabiraman, Vijaya R., and Jeffrey W. Bode. “Rethinking amide bond synthesis.” Nature 480.7378 (2011): 471.
2) Montalbetti, Christian AGN, and Virginie Falque. “Amide bond formation and peptide coupling.” Tetrahedron 61.46 (2005): 10827-10852.
3)Pattabiraman, Vijaya R., and Jeffrey W. Bode. “Rethinking amide bond synthesis.” Nature 480.7378 (2011): 471.
4)Valeur, Eric, and Mark Bradley. “Amide bond formation: beyond the myth of coupling reagents.” Chemical Society Reviews 38.2 (2009): 606-631.
5) Lanigan, Rachel M., and Tom D. Sheppard. “Recent developments in amide synthesis: Direct amidation of carboxylic acids and transamidation reactions.” European Journal of Organic Chemistry 2013.33 (2013): 7453-7465.