反応性の高い酸塩化物はアミド等様々な分子の合成に利用できます。酸塩化物はカルボン酸から誘導するのが最も一般的で簡単な方法です。塩化チオニルがファーストチョイスで選ばれる試薬で、反応性も添加物によって調整できます。
ここでは酸塩化物の合成について解説します。
酸塩化物とは
酸塩化物はカルボン酸誘導体の中でも高い求電子性を持っているため、様々な求核剤と反応してアミド、チオエステル、エステル、第二級アルコール、ヒドラジド、ヒドロキサム酸など多くの縮合体が得られます。またアシルアジドの経由によりWolff転位などに利用できます(図1)。
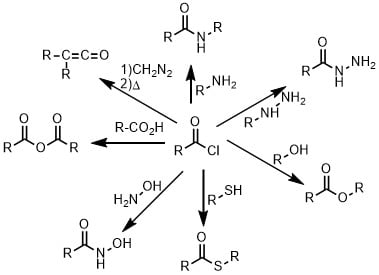
図1. 酸塩化物の変換
酸塩化物はカルボン酸を基質として変換します。
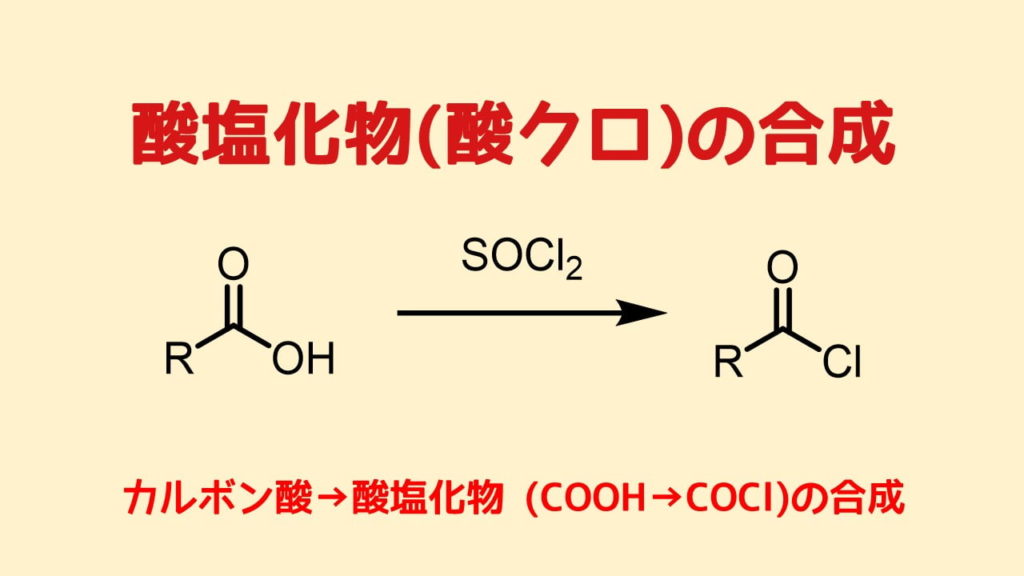
酸塩化物 (酸クロライド)の合成
酸塩化物はカルボン酸に対して、ハロゲン化剤を作用させて合成します。
ハロゲン化剤としては、
- 塩化チオニル
- 塩化スルフリル
- 三塩化リン
- 五塩化リン
- オキシ塩化リン
- 塩化オキサリル
- ホスゲン
などがあります。
反応は室温で進行する場合もありますが、加熱、還流を要することが多いです。
アルコールやカルボニルなどが存在すると副反応が起きる可能性があり、懸念があるときは反応性の低いハロゲン化剤を利用します。
電子求引性の置換基(塩素等)があるカルボン酸(強酸性)は酸塩化物を得るのが難しいです。五塩化リンやDMF+SOCl2 etcが有効です。
・酸塩化物の精製方法を考えておく
酸塩化物を合成するときは精製方法はどうするか?を考える必要があります。中間体として酸塩化物を利用するときは、副生物が次の反応に影響しないもの、あるいは副生物が除去しやすいものを選択する必要があります。
生成物を蒸留で精製する時は試薬と副生物の沸点がかぶらないように気をつけましょう。高沸点な試薬を用いたり、反応性が高めな試薬を1当量使用する方法があります。
酸塩化物合成試薬の特徴
酸塩化物合成に利用される代表的な試薬を表にまとめました。
試薬は塩化チオニルがファーストチョイスで、反応しにくい場合はDMFを添加するのが一般的です。問題無い場合は溶媒量使うというのが良いです。
それ以外には反応性の低いカルボン酸では沸点・反応性の高い五塩化リンが有効です。
塩化オキサリルは高価ですが副生物が除去容易で、塩化チオニルと同じように使えます。反応性も塩化オキサリルのほうが高いようです。
| 試薬 | 塩化チオニル | 塩化スルフリル | 三塩化リン | 五塩化リン | オキシ塩化リン | 塩化オキサリル |
|---|---|---|---|---|---|---|
| 構造式 | 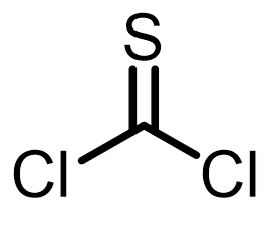 | 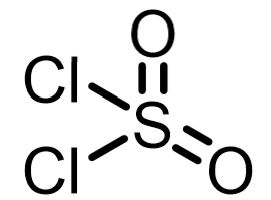 | 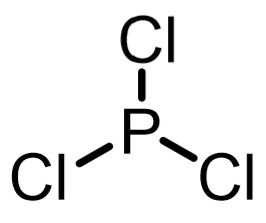 | 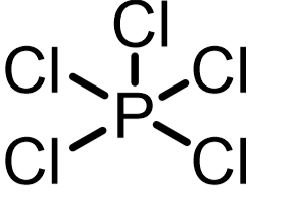 | 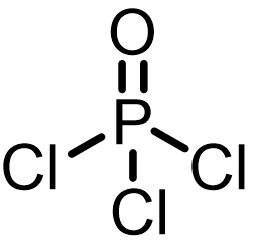 | 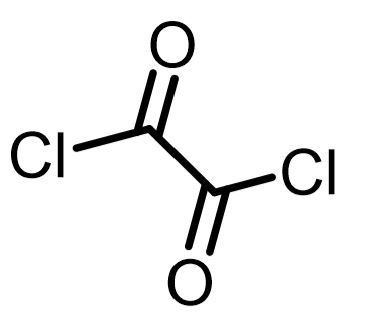 |
| 沸点 | 76℃ | 69.4℃ | 75℃ | 160℃ | 105.8℃ | 63℃ |
| 価格 | ¥6.2/mL | ¥9/g | ¥10/g | ¥8.4/g | ¥5.4/g | ¥54.6/g |
| 欠点 | ・OH→Cl ・低反応性 ・低沸点 | ・+DMFで爆発性? ・低熱安定性 ・過剰量必要 | ・毒物 ・高沸点の亜リン酸が副生 | ・難後処理 ・OH, C=O, NH2は× ・毒物 | ・リン酸が副生 ・沸点が高め | ・高価 ・易分解性でHCl含 ・COの発生 |
| 利点 | ・中性で低副反応 ・安価 ・溶解性が高い | 反応性が高め? | モノを蒸留精製可能? | 最高の反応性 | ・有毒ガスは出ない ・安価 ・カルボン酸塩と反応する | ・穏和 ・OH↛Cl? ・SOCl2より高反応性 |
| 特徴 | ・First choice ・DMFで反応性UP ・C=Oとは反応し難い | SOCl2が良い? | そのまま次に使用 | 反応性の低いCO2Hに! | SOCl2が良い? | ・+DMF ・価格以外は優秀 |
五塩化リンによる酸塩化物の合成
五塩化リンは最も強力な酸塩化物の合成試薬です。毒物指定されている点と高沸点の副生物のオキシ塩化リンの除去が困難なことから使いにくいです。
アルケン、アルコールを塩素化するのにも利用されています。また、スルホン酸をスルホニルクロリドに変換するのにも使えます。アミンも反応する場合があります。
五塩化リンはそのまま原料のカルボン酸と混合させて反応させることが多く、副生するオキシ塩化リンに溶解させる形で反応させます。溶媒としてクロロホルムやベンゼンなどを加えることもあります。
PCl5の反応性の高さは多くの塩素化物がPCl5から合成されることからも明らかです。PCl5はPCl3の塩素化により合成し、オキシ塩化リン、塩化チオニル、塩化スルフリルもPCl5から合成します。
塩化チオニルによる酸塩化物の合成
塩化チオニルは安価で化合物の溶解力も強いためそのまま溶媒として反応させることも可能です。副生成物は気体であり、後処理も楽なのがポイントです。
五塩化リンではアルデヒドやケトンは塩素化されますが、塩化チオニルでは影響を受けません。
芳香族不飽和カルボン酸の酸塩化物合成はうまくいかないことがあります。
オルト位の芳香族ジカルボン酸は塩化チオニル中では酸無水物を形成しやすいので塩化亜鉛を触媒として加えて酸塩化物合成を行います。
反応性が低い場合はDMFを加えてビルスマイヤー試薬を作ったり、ピリジン、ヨウ素、トリエチルアミンなどを添加して反応を加速させることもできる。
三塩化リンによる酸塩化物の合成
三塩化リンは安価な塩素源として利用できます。酸塩化物合成試薬としての利点はあまりなく、PCl5と比べてオキシ塩化リン(bp106℃)が生成せず、三酸化リン(bp173℃)が生成するので酸塩化物の沸点が低めなら、蒸留精製が可能です(蒸留精製の場合、塩化チオニルの沸点などと比較してどれが良いか?を選ぶことになる)。
オキシ塩化リンによる酸塩化物の合成
オキシ塩化リンはカルボン酸塩とだけ反応して酸塩化物を生成します。ナトリウム塩やアミン塩などが使われます。オキシ塩化リンの他にカルボン酸塩を酸塩化物に変換できるのはPCl5です。DMFを加えれば塩化チオニルでも可能です。
カルボン酸塩+オキシ塩化リン法は、ナトリウム塩であれば、副生成物が塩化ナトリウムであり、酸が発生せず、濾過で簡単に分離できるのがメリットです。この方法は酸に不安定なカルボン酸の基質に向いています。
塩化スルフリルによる酸塩化物の合成
塩化スルフリルも同様に酸塩化物合成に利用されるが、過剰に用いないと酸無水物が生じることがある。
塩化オキサリルを使った酸塩化物の合成
塩化オキサリルは酸塩化物を使った合成法であり、反応性も高いが、高価であるのが欠点です。
酸クロリド合成時に使われる溶媒ランキング
カルボン酸から酸塩化物を合成するのに塩化チオニルを溶媒量使用することができます。塩化チオニルは溶解性が良好ですが、副反応などで大過剰に塩化チオニルを使いたくないときは溶媒を加えて反応させることも多いです。
そこでアルキルorアリールカルボン酸の酸クロライド化反応で最もよく利用される試薬top3の塩化チオニル、塩化オキサリル、五塩化リンを使用した時に使われる溶媒を調査しました(収率60%以上)。
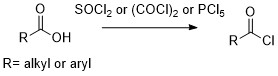
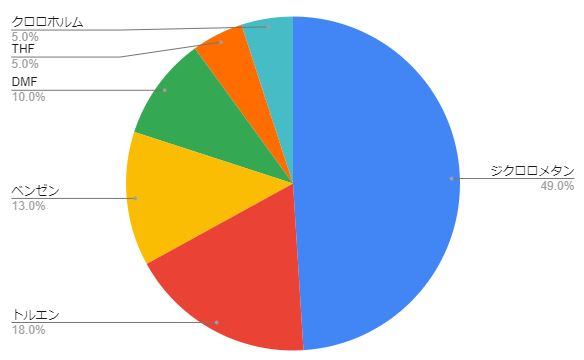
酸クロ溶媒ランキング(個人的な論文調査法でランキングは目安です)
1位は圧倒的にジクロロメタン、2位トルエン、3位ベンゼンで3/4を占めます。
ビルスマイヤー試薬用途も含めてDMFも結構たくさんありました(DMFを溶媒としても使います)。
その次はTHFやクロロホルムが多いですね。極性が高めなカルボン酸は溶解性が悪いことが多いのでTHFなどを利用します。
THFは塩酸によって開環してクロロアルコールが生じるので、長時間還流や過剰量のハロゲン化試薬を使用するときは注意しましょう。
実験操作: 塩化チオニルを使った酸塩化物の合成
塩化チオニルは安価で、反応は穏和で副反応が少なく、副生物も気体で原料も留去可能であるという簡便性から酸塩化物合成のファーストチョイスです。
・一般的な基本操作
カルボン酸を塩化チオニル(過剰量 or 溶媒有りでは2-5当量)に溶解させて、数時間加熱還流させて、反応終了後は溶媒留去して精製せずに次の反応に使います。
・塩化チオニルに基質が溶けない場合
溶解する溶媒に溶かす。トルエンやクロロホルム、THF、DMFなどで溶解させた状態で塩化チオニルを2-5当量加えて反応させる。ジクロロメタンなどの沸点が低い溶媒は加熱還流できないので注意する。
・塩化チオニルを溶媒量使うと副反応などが起きる場合
トルエンやクロロホルムなどで希釈する。塩化チオニルの使用量は反応が進行しなければ追加する。アルコールを含むと塩素化されるので保護が必要。
塩化チオニルが古いと塩酸が発生していて副反応が起きやすくなるので蒸留すると良い。
・反応が進行しない場合
より反応性の高い試薬、塩化オキサリルか5塩化リンなどを利用する。
塩化チオニルでも添加物を加えることで反応を加速できます。
- DMFを数滴加えてビルスマイヤー試薬を系中で発生させる
- ピリジンを加える(酸の緩衝作用あり)
- 酸を加える(塩酸や硫酸等)
- 塩化亜鉛 (分子内で無水物が副生する時に有用)
塩化オキサリルを使った反応例
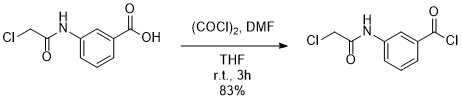
塩化オキサリル(256μL、3.0 mmol)をTHF(5 mL)とDMF(3.5 μL)のカルボン酸体(213 mg、1.0 mmol)溶液に加えて室温で3時間撹拌した。 反応後、混合物を蒸発させてTHFを除去し、AcOEt(1 mL)とn-ヘキサン(4 mL)を加え、減圧下で濃縮した。 残留物をn-ヘキサン(6mL)で沈殿させて濾別、真空乾燥を経て目的物(192 mg、83%)を得た。
ref) Ishizawa, Takahiro et al JACS, 135(14), 5433-5440; 2013
その他の酸塩化物合成方法
トリフェニルホスフィン+四塩化炭素
トリフェニルホスフィンと四塩化炭素の組み合わせはアッペル反応として知られるアルコールのハロゲン化で使用されています。
通常はアルコールの塩素化などに利用されますが、カルボン酸の酸塩化物合成にも利用できます。この反応のメリットは「塩酸」が発生しないことです。カルボン酸の水素はクロロホルムの水素としてトラップされるため、プロトンが発生しません。
酸に弱い化合物の酸塩化物合成ではこの方法が利用できると思います。もちろんアルコールがあるとそれが反応する可能性があるので注意です。
トリフェニルホスフィンと四塩化炭素はホスフィンのハロゲンの引き抜きによりホスホニウム塩及びカルベンが生成します。カルベンはカルボン酸の活性プロトンの引き抜きとカルボキシラートアニオンがホスホニウム塩に攻撃、塩素による攻撃を受けて酸塩化物が生成します。
ホスフィンオキシドが生成するのが難点です。
実験のアドバイス・ポイント
- 酸塩化物を合成する試薬は反応性が高いため、古くなっていると塩化水素が発生したり、活性が失われている場合があるので注意する。液体であれば蒸留して精製する。
- 剰余の試薬はそのままエバポで飛ばしたりすると、ポンプを痛めたり、実験室中に酸性ガスや試薬が充満することがあるので注意する。酸トラップや冷却トラップを挟んでおく
- 残った副生物や試薬は脱水トルエンを加えてエバポを何度か繰り返すと除去しやすくなる(トルエン共沸)
- 試薬によって異なるが、ハロゲン化剤を使用するときはアルコールやカルボニルが反応しないかを確認する。必要に応じて保護する。アミンが反応するときもあるので注意する。また、塩酸が発生するのでこれに弱い基質は注意する(TMSエーテル、cisオレフィン→トランス体、異性化しやすい多重結合等)
- ジカルボン酸で距離が近い場合(オルト位等)は酸無水物が生成することがあるので、塩化亜鉛触媒を加えたりして酸塩化物を合成する
- 基質にエステルがある場合、エステル交換が起こる可能性があるので注意する
- リン系の試薬で副生するオキシ塩化リンは減圧留去できるが、完全な除去は難しいです。副生物が気になる場合は塩化チオニルや塩化オキサリルを使用する
- 酸塩化物合成に反応性が高く副反応、分解が起きる場合は適当な溶媒(トルエン、クロロホルム)で希釈すると良い
- 塩化チオニル-ピリジンなど一般的な条件でも長時間反応をかけてしまうと、カルボニル基のα位に塩素やSClなどが置換してしまうことがあるので注意します。