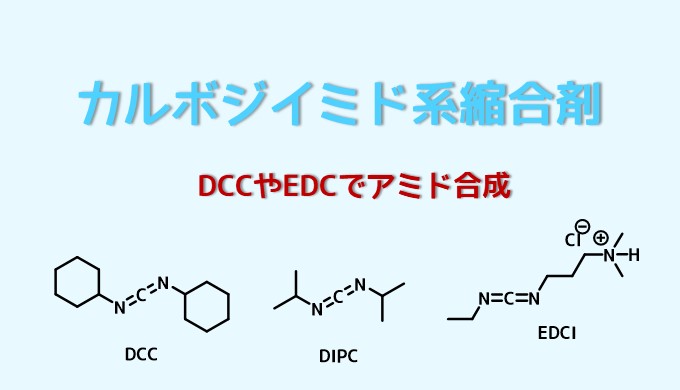
・DCC、EDC、DIPCはカルボジイミド系縮合剤
・EDCは代表的なアミド縮合剤
・信頼性が高く比較的高い収率
・コスパが良い
・EDCは水洗除去可能
DCCとEDCとDIPCがカルボジイミド系縮合剤の代表
ペプチド合成に限らず様々なアミド合成の場面で利用されるのがカルボジイミド系縮合剤です。
DCCはカルボジイミド系縮合剤の代表として一般的に利用されています。
カルボジイミドは全体的に安価で収率もなかなか良いので、コスパが良い縮合剤です。
特徴の1つが縮合反応には塩基や酸を必要としない点です。
中性条件で反応が進行します(アミン塩酸塩なら塩基を加えて求核性を上げる)。
酸・塩基は副反応(エピメリ化)を誘発するため中性条件下で反応させられるカルボジイミドは有用です。
代表的なカルボジイミド系縮合剤を3つ紹介
- DCC (ジシクロヘキシルカルボジイミド)
- EDC (N-エチル-N’-3-ジメチルアミノプロピルカルボジイミド)
- DIPC (ジイソプロピルカルボジイミド)
の3つが代表的なカルボジイミド系縮合剤です。
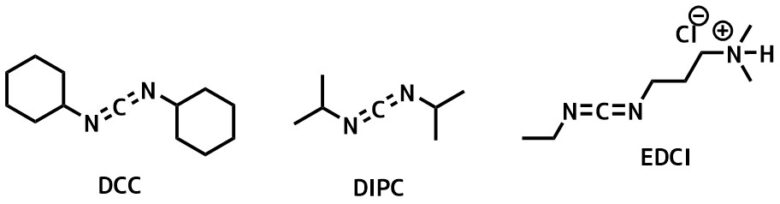
カルボジイミド縮合剤一覧
最も利用頻度が高いのはEDCだと思います。
カルボジイミド系縮合剤の特徴
DCC、DIPC、EDCにはそれぞれの特徴があるので個別に紹介します。
- 一般的な有機合成 ⇒ EDC ( First Choice)
- ペプチド合成 ⇒ DIPC
- 安価で生成物の溶解性が高い⇒ DCC
DCC (N,N’-ジシクロヘキシルカルボジイミド)
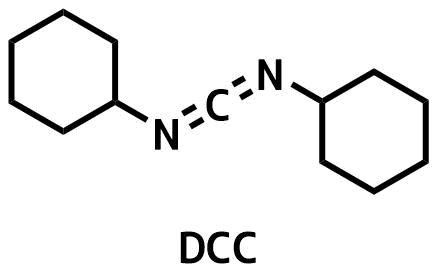
DCCの構造
DCCはカルボジイミド系縮合剤の代表です。
近年はアレルギー性や副生成物の除去が難しい場合がある点から利用は控えられています。
DCCの利点は
- 安価
- 副生成物を濾過除去可能
- 中性で反応が進行
です。
DCCの価格を競合するEDCとDIPCとで比較してみましょう(@東京化成工業)
- DCC 25g 1,800円
- DIPC 25g 6,700円
- EDC 25g 19,200円
DCCと比べて、DIPCは3.7倍、EDCは10倍以上も高いです。
大量のアミド合成をする時にコスパではDCCに軍配が上がります(他手法では酸塩化物(塩化チオニル)も安価)。
また副生成物のジシクロヘキシル尿素は溶媒への溶解性が低いため、大部分を濾過で除くことができます。
特にアセトニトリルには溶けにくいようなので、水溶性が高い極性が高めな化合物の場合は副生成物を水洗除去するEDCよりもDCC のほうが向いています。一度DCCのウレアを沈殿させたあとにさらに少量の溶媒で混合物を溶かして静置してウレアを析出させると除去量が増加します。
しかし、この副生成物を全て濾過除去することができるか?というとそういうわけでないので、カラム精製などが必要になります。
H-NMRでDCCのシクロヘキシル基由来のピークがなかなか消えなくて困った経験は何度かあります。
次反応に問題ない場合は濾過除去後の溶液をそのまま次の反応に利用するという方法も使えなくないです。
欠点
また、アレルギー性を持つというのも欠点です。実際に私はDCCに対してアレルギーを起こして皮膚がかぶれたり、くしゃみがでたりします。
精製容易さを考えて研究室では反応性が同等のEDCを利用することが多いです。
生成物が水溶性が高い化合物の場合はEDCよりもDCCのほうが適している可能性があります。
EDC
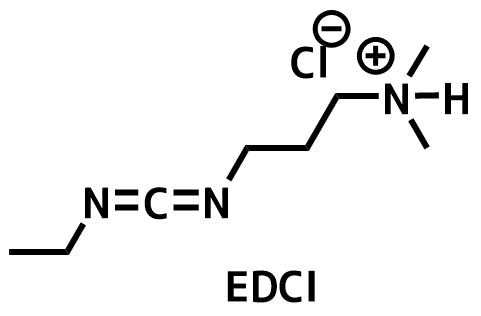
EDCIの構造
EDCは別名Water soluble carbodiimide(WSCI)と呼ばれるように、分液で副生成物を水層に落として除去することができます。カラム精製なしに分液操作でキレイにできるので、研究室ではよく利用されています。
個人的にもカルボジイミド系なら文献が多く、後処理しやすいEDCを最もよく使います。
EDCの利点は以下の4つあります。
- 安定した収率
- 副生物が水洗除去可能
- 安価?
- 中性で反応が進行
1. 文献も豊富でよく利用されており、収率も高く、水に溶解しやすい性質のせいで反応性が落ちているということもありません(DCCと同等の反応性)
2. EDCと副生成物のウレア体は水溶性のため、分液操作で除去可能です。
3. EDCはカルボジイミドの中では圧倒的高価で、DCCの10倍の値段もしますが、縮合剤全体で見たら安価なほうです。
EDCの欠点
DCCと比べた欠点としては、
- ラセミ化が進行しやすい
ペプチド合成などで利用するときはHOBtなどのベンゾトリアゾールを加えることでこれを防ぎます。
EDCには構造中に含まれる第三級アミンが塩になっているEDC・HClとアミン状態になっているEDCがあります。EDCではアミン塩酸塩を中和できるので塩基の追加は不要です。
EDC・HClはDMFへの溶解性が低く、DCMへの溶解性は高いです。
DIPC
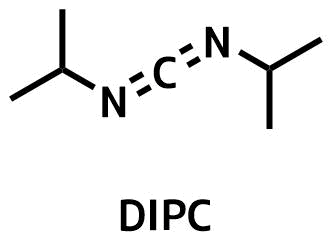
ジイソプロピルカルボジイミドも同等の反応性を持っています。
DIPCはペプチド合成でよく利用されていますが、これは、溶媒への溶解性が高く安価という点からです。
ペプチド固相合成法ではレジンに対して反応液を加えて振盪し、反応後に濾過してレジンを溶媒で洗浄します。このときに、DCCを使ってしまうと副生物のウレアが析出して分離が難しくなります。
DIPCは副生成物のウレアもDMF等の溶媒に溶けるのでこうした問題は起きません。
EDCでも代替できますがより高価で水洗はしないのでDIPCが向いています。
逆に、一般的な有機合成ではDIPCを使う理由はあまりないかもしれません。
反応機構
最初の段階はカルボジイミドのプロトン化から始まっていますが、カルボキシラートがカルボジイミドに対して攻撃するルートも考えられます。
カルボン酸とDCCを混合させるとDCCがプロトン化、カルボジイミドの求電子的な炭素にカルボキシラートが攻撃し、O-アシルウレアができます。カルボニル炭素に対してアミンが攻撃すると、尿素の脱離を伴ってアミドができます。
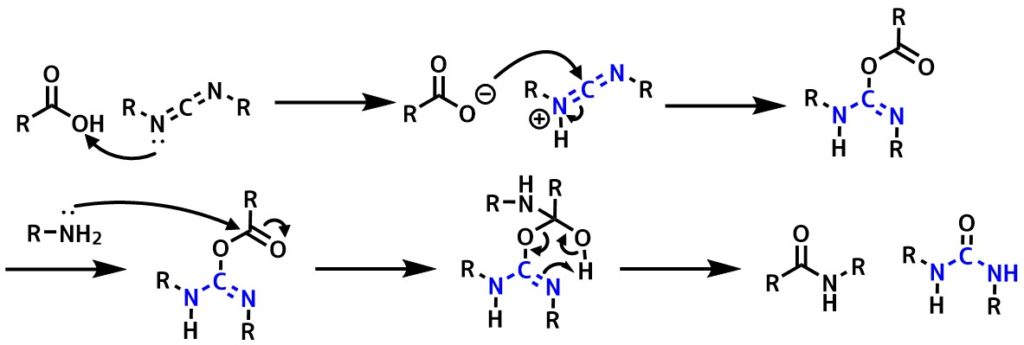
DCC反応機構
ウレア(尿素)はOHイオンと比べて中性で安定であるため、良い脱離基になります。これがアミド化の推進力になります。
副反応
カルボジイミドを利用した反応はいくつかの副反応を誘発する可能性があるので、反応温度は0℃など低温でスタートさせます。
DCCの副反応
一般的にこの副反応はDMFなどの極性溶媒中で起こりやすく、ジクロロメタンなどの低極性溶媒中では起こりにくくなります。
DCCはDMSOと反応してスルホニウム塩が生成します。これはフィッツナーモファット酸化の活性種でアルコールを酸化します。
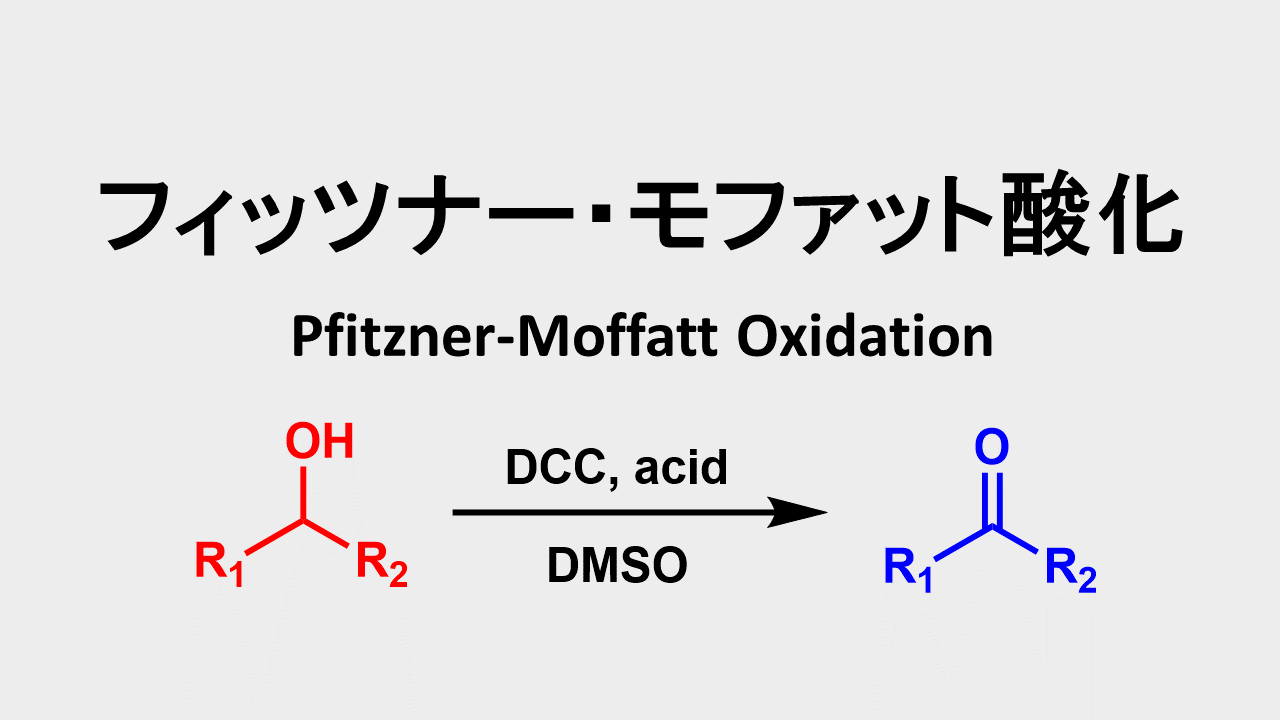 フィッツナー・モファット酸化: Pfitzner-Moffatt Oxidation
フィッツナー・モファット酸化: Pfitzner-Moffatt Oxidation
DCCはアミドを脱水してニトリル、アルコールを脱水してアルケンにするなど脱水剤として機能します。
カルボジイミドはエステルの合成にも利用されています。
反応条件
カルボジイミドはアミド化、エステル化によく利用されています。
アミド化
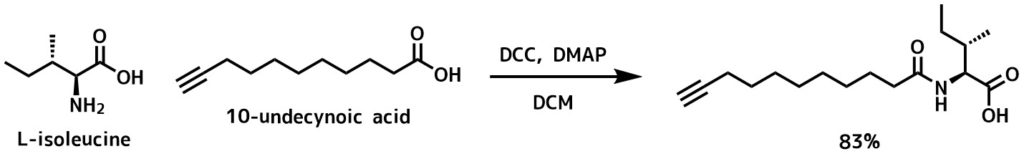
DCCによるアミド化例 – Bedard, Anne-Catherine and Collins, Shawn K. Organic Letters, 16(20), 5286-5289; 2014
脱水DCM(20mL)中にアミノ酸(800 mg、4.8 mmol)、カルボン酸(726 mg、3.98 mmol)を溶解し、DCC(1.64 g、8.0 mmol)およびDMAP(1.46 g、12.0 mmol)を反応物に加えて17時間撹拌した。反応後冷凍庫に5時間入れて尿素の沈殿をを行い、その後尿素をろ過により除去した。濃縮、カラム精製により目的物を得た(1.24 g、83%)
上の反応例では触媒としてDMAPを加えています。DCCは溶液に溶かして0℃下滴下することが多いです。
ラセミ化を防ぐために1-Benzotoriazolを加えたりします。塩基触媒としては、N-メチルモルホリン、トリエチルアミン、DIEPAが使われることが多いです。
溶媒はジクロロメタンが最も良く使用されますが、溶解性が悪い場合はTHFもよく使用します。DMFも使用されますが反応は遅くなり、副反応が起こりやすくなるようです。ペプチド合成においては、DMFやTHFが使用されます。
ペプチド合成ではNヒドロキシスクシンイミド(HOSu)やHOBtなどを加えて反応の加速を狙います。
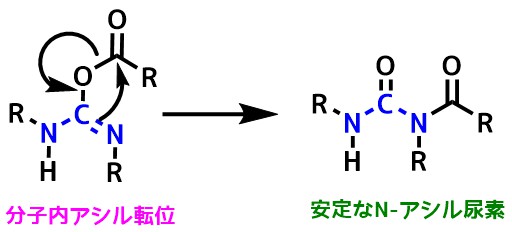
HOSu入れすぎによるLossen転位に注意!
HOSuを加えすぎるとHOSu-DCCにHOSuが攻撃してロッセン転位が起こる副反応が起こるので注意が必要です。
Bernd Gutte ”Peptides: Synthesis, Structures, and Applications”1995, p45参考
エステル化
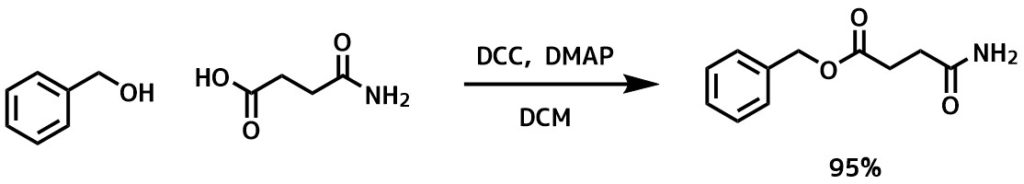
エステル化- Wang, Guoxin et al Synlett, 27(2), 309-312; 2016
カルボン酸(0.10mmol)およびアルコール(0.12mmol)、CH2Cl2(10 mL)、EDC・HCl(0.30ミリモル)、DMAP(0.02ミリモル)を0℃で加えて室温に戻しながら12時間撹拌した。次に、反応混合物に水(10 mL)注ぎ、ジクロロメタンで抽出した。カラム精製して目的物を95%で得た。
エステル化もアミド化と同様の条件で進行します。そのためアミンとアルコールは共存させないほうが良いでしょう。