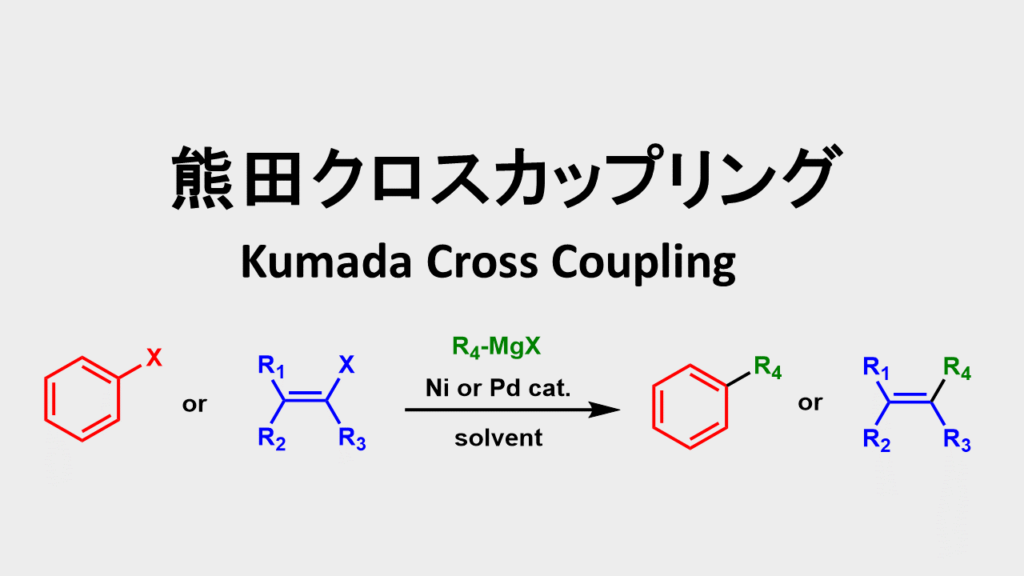
熊田クロスカップリングについて
熊田クロスカップリング: (Kumada Cross Coupling)はグリニャール試薬とハロゲン化合物とのクロスカップリング反応です。
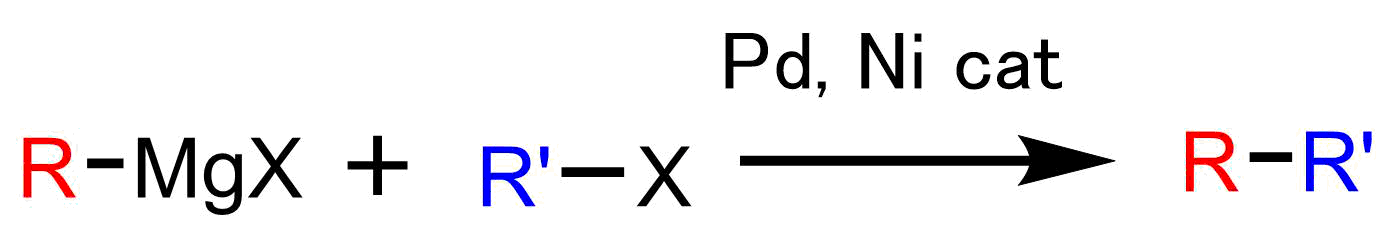
熊田クロスカップリング
触媒量のニッケルあるいはパラジウム存在下で進行します。
グリニャール試薬は脂肪族、芳香族ともに用いることができます。
有機ハロゲン化合物は芳香族、ビニル化合物を用いることができます。またトリフラートなども用いることができます。
熊田クロスカップリング反応では触媒としてニッケルとパラジウムが使えます。ニッケルの場合はNi(dppp)ClやNi(dppe)Cl2が良く用いられます。また、近年はNickamineを用いた方法が効率、官能基許容性が高く有用であることが報告されています。
Vechorkin, Oleg, Valérie Proust, and Xile Hu. “Functional group tolerant Kumada− Corriu− Tamao coupling of nonactivated alkyl halides with aryl and heteroaryl nucleophiles: Catalysis by a nickel pincer complex permits the coupling of functionalized Grignard reagents.” Journal of the American Chemical Society 131.28 (2009): 9756-9766.
熊田クロスカップリングの欠点はグリニャール試薬を用いなければならないという制限です。塩基性の高いグリニャール試薬は反応性が高く、グリニャール試薬の調整が難しい官能基(ニトリルやエステル)は通常は難しいです。
パラジウム触媒は一般的に有用で官能基・立体選択性が高いですが、ニッケル触媒はパラジウムでは難しい塩化アリルなどのカップリング反応に向いています。
副反応としてはホモカップリング体や有機ハロゲン化合物の還元体の生成が起こりえます。
パラジウムを用いた触媒反応としてはバックワルドらの低温でも反応が進行する方法の報告があります。
Martin, Ruben, and Stephen L. Buchwald. “Pd-catalyzed Kumada− Corriu cross-coupling reactions at low temperatures allow the use of Knochel-type Grignard reagents.” Journal of the American Chemical Society 129.13 (2007): 3844-3845.
1900年初期にグリニャールによって開発されたグリニャール試薬はカルボニル基などに対する求核付加反応をはじめ、様々な求電子剤との反応が報告されていました。このグリニャール試薬をハロゲン化合物と金属触媒下でカップリングさせる合成法が様々な研究者により探索されていました。触媒的カップリング反応を検討するためコバルトや鉄、銀、銅などが試されましたが、副反応としてホモカップリングが起こりやすく実用性は低かったです。熊田・玉尾らはニッケルに着目し、検討を行ったところ、リン配位子(dppe)を持つニッケル錯体NiCl2(dppe)がグリニャール試薬と有機ハロゲン化合物との触媒クロスカップリングに有効であることを1972年にJACSに報告しました1)。
熊田クロスカップリング反応は今日までに報告されてきた触媒的カップリング反応の先駆けとなった重要な反応であるといえます。その後に根岸カップリング反応、鈴木宮浦カップリング反応、スティルカップリング反応、檜山カップリング反応などが相次いで報告されました。
1) Tamao, Kohei, Koji Sumitani, and Makoto Kumada. “Selective carbon-carbon bond formation by cross-coupling of Grignard reagents with organic halides. Catalysis by nickel-phosphine complexes.” Journal of the American Chemical Society 94.12 (1972): 4374-4376.
2) https://en.wikipedia.org/wiki/Kumada_coupling
3) 中野幸司. “クロスカップリング反応.” 化学と教育 67.4 (2019): 180-183.
4) 宮浦憲夫. “触媒的合成化学を先導するクロスカップリング反応.” 有機合成化学協会誌 67.5 (2009): 435-435.
反応機構
反応機構は触媒としてパラジウムを用いた時とニッケルを用いた時では異なると考えられます。
パラジウムを用いた熊田クロスカップリング反応のメカニズムは0価パラジウムが関与する他のクロスカップリング反応と類似の機構で進行していると考えられています。すなわち、0価のパラジウムが有機ハロゲン化合物と酸化的付加反応を起こし、グリニャール試薬とトランスメタル化によりアルキル基が二価パラジウム上に導入されます。異性化により生じたシス体は還元的脱離を起こして0価パラジウムを再生すると同時にクロスカップリング体が生成します。

Jonathan.Raybin / CC BY-SA (https://creativecommons.org/licenses/by-sa/3.0)
一方でニッケルを用いた機構についてはまだ不明な点が多く推定の機構がいくつか説明されています。