目次
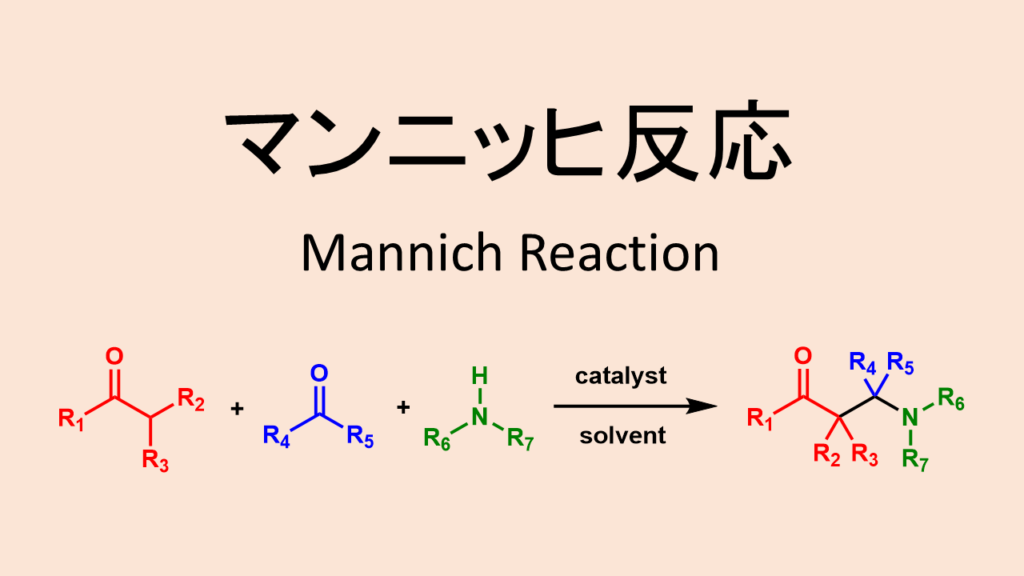
マンニッヒ反応について
マンニッヒ反応はエノール化しないカルボニル化合物と第二級アミンとの反応により生じたイミンとエノール化するカルボニル化合物との縮合により生じるβ-アミノカルボニル化合物を得る反応です。
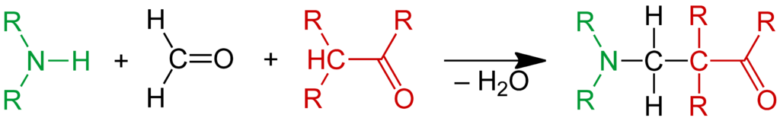
マンニッヒ反応の概要 from wiki public domain
基質としてはエノール側の化合物は芳香族・脂肪族カルボニル、エステル、ニトロアルカンなどが使われます。
アミンは第一級、第二級脂肪族アミンを使います。
ホルムアルデヒド、ベンズアルデヒドがエノール化しないカルボニル化合物として利用できます。
第一級アミンを用いた場合、最初に生成したβ-アミノカルボニル化合物はさらに反応し、最終的にはN、N-ジアルキル化された化合物(第三級アミン)が得られますが、第二級アミンを用いた場合には、過剰のアルキル化は起きません。
アミノアルキル化に必要な、求電子性のイミニウムイオンの濃度を十分に高めるために、反応溶媒としては、通常エタノール、メタノール、水酢酸などのプロトン性の溶媒が用いられます。非対称のケトンからは位置異性体のMannich塩基が得られますが、ケトンのより多置換のα位にアミノアルキル化反応が進行した生成物が優先的に得られます。Mannich塩基は、種々の変換ができるので有用な合成中間体です。β脱離によりα、β-不飽和カルボニル化合物(Michael受容体)を与える反応や有機リチウム反応剤やGrignard反応剤を用いたβ-アミノアルコールへの変換、ジアルキルアミノ基の置換により官能基化されたカルボニル化合物などへの変換などが報告されています。また、三成分Mannich反応の改良法についても報告されており、あらかじめ調製されたイミニウム塩を用いると、より速く、より位置選択的で、立体選択的な反応をきわめて温和な条件下で実行できます。
反応の歴史
1903年に、B. Tollensとvon Marleが、アセトフェノン、ホルムアルデヒド、塩化アンモニウムとの反応で第三級アミンが生成することを見いだしました。1917年に、C. Mannichがアンチピリンをマンニッヒ反応条件を用いることで第三級アミンを単離し、反応の一般性を明らかにしました。
反応機構
Mannich反応の反応機構に関してはいくつか実験的にも調べられています。酸性条件下、塩基性条件下ともに進行しますが、酸性条件での反応が一般的です。
酸性条件の場合、アミンとプロトン化したカルボニル化合物との反応によるヘミアミナールの生成が第一段階になります。ヘミアミナールはプロトン移動後、求電子性のイミニウム塩を与えます。こうしてできたイミニウム塩は、エノール化したカルボニル化合物(求核剤)とα-炭素上でアルドール型の反応を起こし、Mannich塩基が生成します。