化学シフト値とは?
H-NMRの化学シフト値は観測された水素の周辺情報がわかる情報です。
NMRからわかる情報には
- 化学シフト値(ケミカルシフト)
- カップリング
- J値
- 積分値
- ピーク幅
などがあります。この中でも化学シフト値を見れば、観測している分子の大体の分子構造を予測することが可能になります。
化学シフト値の単位はppmで大体0~12ppmの範囲に収まります。
0ppm側の方向のことを「高磁場」といいます。12ppm側の方向のことを「低磁場」といいます。
例えば1ppmにあった水素のピークが測定条件を変えて2ppmに出てきたら「低磁場シフトした」などといいます。直感とは逆方向なので慣れましょう。
化学シフト値に影響を与えるもの
化学シフト値は観測された水素が結合している元素周辺の環境に影響を受けます。大きく影響を与えるのは
- 芳香環
- 電子密度
です。
化学シフト値が高磁場側にある時、観測された水素が結合している元素周りには「電子供与基」などが多く結合していることが多いです。逆に言えば「電子求引基が少ない」ということも意味しています。
化学シフト値が低磁場側にある時、電子求引基が結合している可能性を示しています。
電子供与基の代表例としては「アルキル基」「シリル基」があります。
電子求引基としては電気陰性度が高い元素を含む分子「アルコール」「ハロゲン化物」「カルボニル基」「ニトロ基」などがあります。
また芳香環に結合している場合は大きく低磁場シフトします。これは芳香環の環電流効果と呼ばれるものによって起こります。大体芳香環に結合した水素は7ppm付近に出てきます。
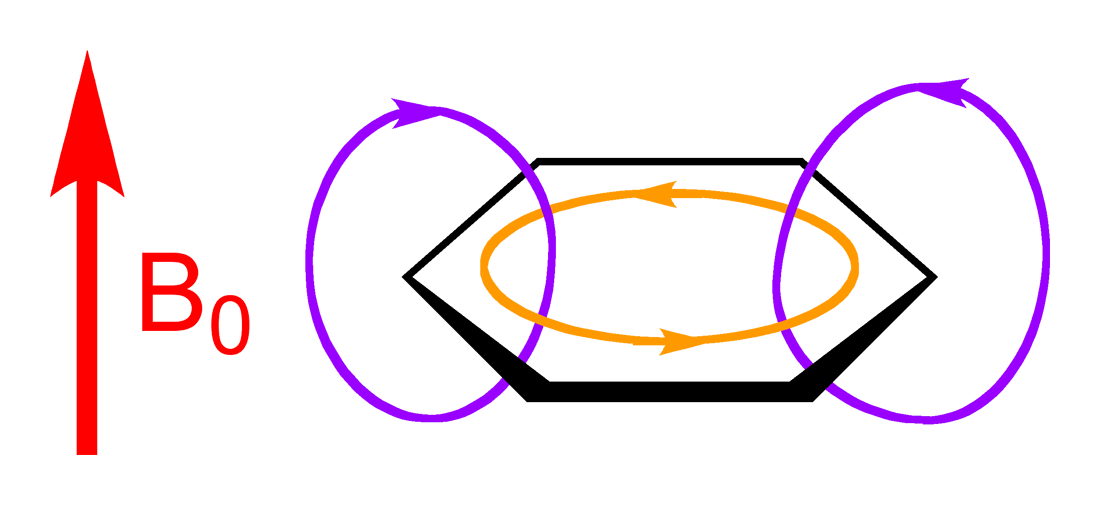
環電流 from wiki PD 外部磁場を与えるとオレンジ線の方向に環電流が流れ、紫線の磁場が誘起される
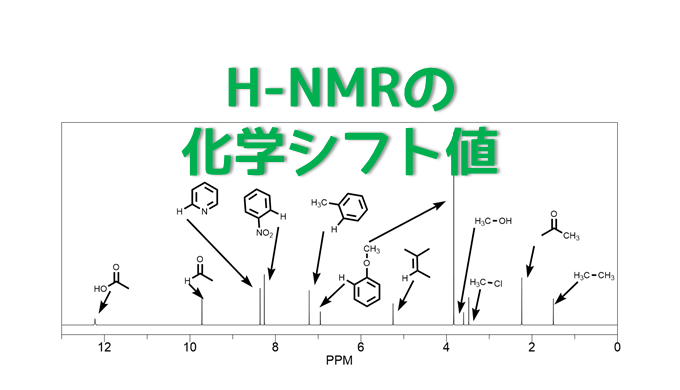
H-NMRの化学シフト値一覧
実は化学シフト値から予測される構造のパターンはそんなに多くありません。そのため、慣れればNMRを読み解くことは想像よりも難しくありません。
実際の構造解析
化学シフト値だけでなく積分値やカップリング情報をもとに化学構造を予測していきます。大体の分子構造はすでに知ってたり、別の分析手法(TLC,MS,元素分析, 二次元NMR, IR)と組み合わせて行います。
代表的なケミカルシフト値の位置関係は以下のようになっています。後は他の構造の電子供与・電子求引性に着目してケミカルシフト値が低磁場側か高磁場側のどちらにシフトするかを予測していきましょう。
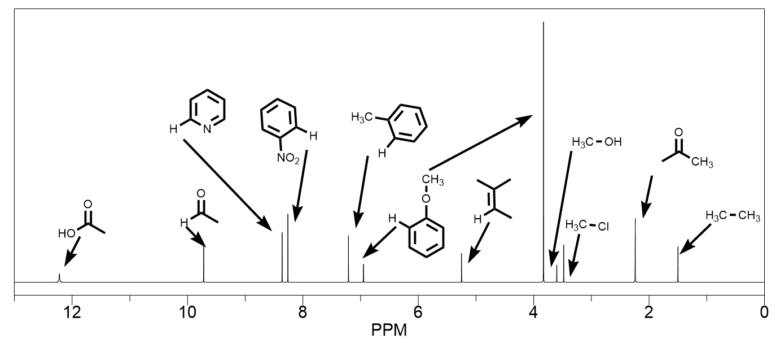
化学シフト値の値一覧。細かい順番は前後する可能性あり。カップリングは省略してシングルピークにしている。
0ppm付近にあるものはシリル基が多いです。ケイ素置換基は最も高磁場にピークが出てくるもののひとつです。例えばTBS基やTMS基などがあります。テトラメチルシラン(TMS)はちょうど0ppmに出てくるので校正標準物質として使われています。
- 1ppm付近はアルカン類です。ヘキサンなどはこのあたり
- 2~4ppmにはアルコールやアミン類などのヘテロ原子に結合したアルキル基、アセチル基などがある
- アルケンは5ppm付近 広めのカップリングからもわかりやすい
- 6~7ppmは電子豊富な芳香環(メトキシ、アニリン、チオフェン)など
- 8ppmは電子不足な芳香環類(ニトロベンゼンやフェニルケトンなど)
- 10ppm付近はアルデヒド、12ppm付近はカルボン酸の化学シフト値であることが多い
化学シフト値から構造を予測しよう!
レベル1酢酸エチル
NMRは慣れな部分が大きいのでとりあえず上の化学シフト値一覧を見ながら(覚えながら)、どのシフト値がどこの水素なのかを予測してみましょう。下の化合物は酢酸エチルです。
- アセチル基のCH3
- エチル基のCH2
- エチル基のCH3
はどこにあたるか化学シフト値だけで考えてみましょう。
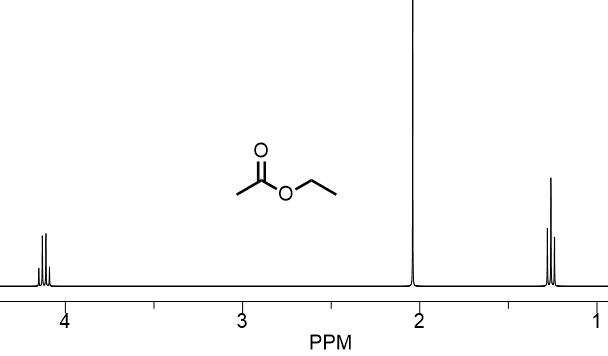
酢酸エチルの化学シフト値
最も高磁場と最も低磁場のピークから考えてみます。
一般的に高磁場側の1ppm付近に現れるピークは炭化水素類(H-CH2-CH2-)です。したがって、一番左側このピークの水素が結合している炭素には電気陰性度が高い元素(F O Cl N)など電子求引性の官能基は結合していなさそうです。このことからエチル基のCH3かアセチル基のCH3が候補になります。アセチル基のカルボニル基は代表的な電子求引基のひとつなので、一番右のピークは3のエチル基のCH3となります。
一番低磁場側のものは電気陰性度が高い元素が結合していると考えられます。アセチル基や酸素に結合したエチルの水素どちらでしょうか?これは酸素に直接結合しているほうがより大きく影響を受けると考えられるので4ppm付近のピークは2のエチル基のCH2です。
このように予測することもできますが、上の一覧を見ればすぐにどの水素かがわかります。ちなみに4ppmのピークなどは何本もあるように見えますが元は一本のピークですが分裂して見えた状態になっています。
割れているのか、別々のピークなのかは形を見ればわかります。基本的に割れたピークは左右対称な形をしています。左右非対称な形(片方が大きくて片方が小さい)などのものは別々のピークである可能性が高いです。正しい形をみればすぐに見分けることができるようになります。詳しくはカップリングのところで述べます。
レベル2芳香族化合物
もう少し複雑な化合物のシフト値を見てみます。下の化合物は芳香環を持つ化合物です。
下のNMRチャートを見ると全部で7本のピークがあります。つまり7つの異なる環境に置かれた水素があるということです(7つの別々のエリアにある。わかりにくいと思いますが実際は1ppmのピークは別のものが2本あります。めちゃくちゃ環境が近いので一本のように見えています。7ppm付近も1本ではありませんが分裂しているだけです。
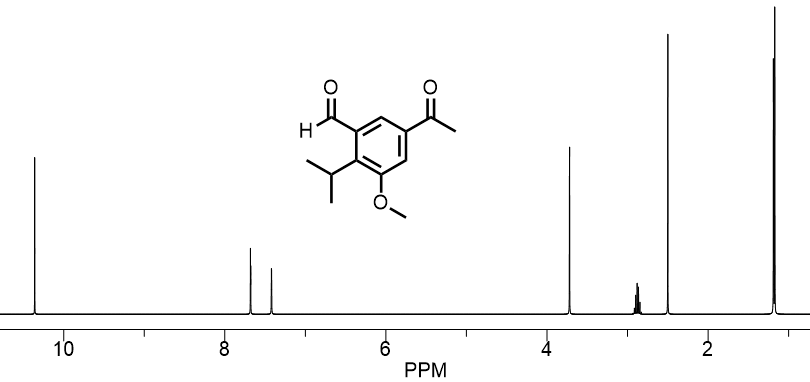
芳香族化合物のNMRを読もう
それではエリア別にリストしてみます。
- アルデヒド
- アセチル基
- 1と2に挟まれたベンゼン環の水素
- イソプロピル基のメチル×2
- イソプロピル基のメチン水素(CH)
- メトキシ基のメチル
- 6と2の間にあるベンゼン環の水素
この7つに分けられます。同様に特徴的なピークから先に読み解いていきましょう。一番低磁場10ppmは特徴的です。このあたりに来る一本のピークはアルデヒドの水素です。アセチル基とは違って直接カルボニル基に結合している水素なので大きく低磁場にでてきます。
次に一番右側のピークを見ます。一番右側はアルカンの領域です。したがって2,4.5.6が挙げられますが、最も高磁場ゆえに酸素などのヘテロ原子の近くにはいない水素のはずです(物理的な距離ではなく何結合分ははなれているか?ということ)。こうなると4のメチルしかありません。
さて、先ほどはなかった芳香環があります。芳香環は低磁場シフトさせる力があります。芳香環に直接ついた水素は7ppm付近にピークがでることが知られています。アルカンと比べれば大きく低磁場シフトしていますね。この2本が3,7になります。後は先ほどの例にもあったものと同じように酸素に結合した6は4ppm付近の6、アセチル基は2ppm付近のピーク、メチン基の水素5も2ppm付近です。
複雑な化合物になってくるとだんだん化学シフト値だけで決定するのは難しくなっていると感じられるかもしれません。ここでカップリングや積分を使います。例えば2と5は非常に近いですが、ピークの見た目は大きく違います。そのはず一つはCH3でもう一つはCHだからです。分裂しているピークは観測されているピークの水素が結合している炭素(H-C)の隣の元素上に水素が沢山ついているほど分裂します。一本の場合は水素が結合していないことを意味しています。アセチル基はCH3の隣の炭素はC=Oで水素が結合していないので、割れません。こうやってどんどんどのピークがどこの水素か?というのを割り出していきます。