アルコールは有機化学のなかでも特に重要な化合物です。なぜなら、自然界にたくさん存在している化合物であり、生物においても重要な物質です。有機合成においても様々な官能基に変換する足場になるからです。ここでは有機化学の基礎となるアルコールについて高校~大学レベルで解説していきます。
アルコールとは?
アルコールの代表例である「エタノール」はお酒に入っている成分です。単にアルコールと呼ばれることもありますが、化学的にはエタノールはアルコールの一種です。

アルコールとは?
アルコールとは炭化水素に対して「OH基:ヒドロキシ基」が結合した物質の総称です。
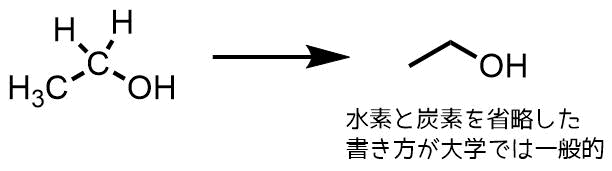
炭素と水素を省略した書き方
身の回りにはアルコールが沢山あります。下の構造式に含まれているOH基を探してみてください。男性ホルモンのテストステロンにもアルコールの一種とも言えます。甘いブドウ糖(グルコース)、ビタミンC、アドレナリンもアルコールやフェノールが含まれています。キニーネはマラリアの特効薬です。
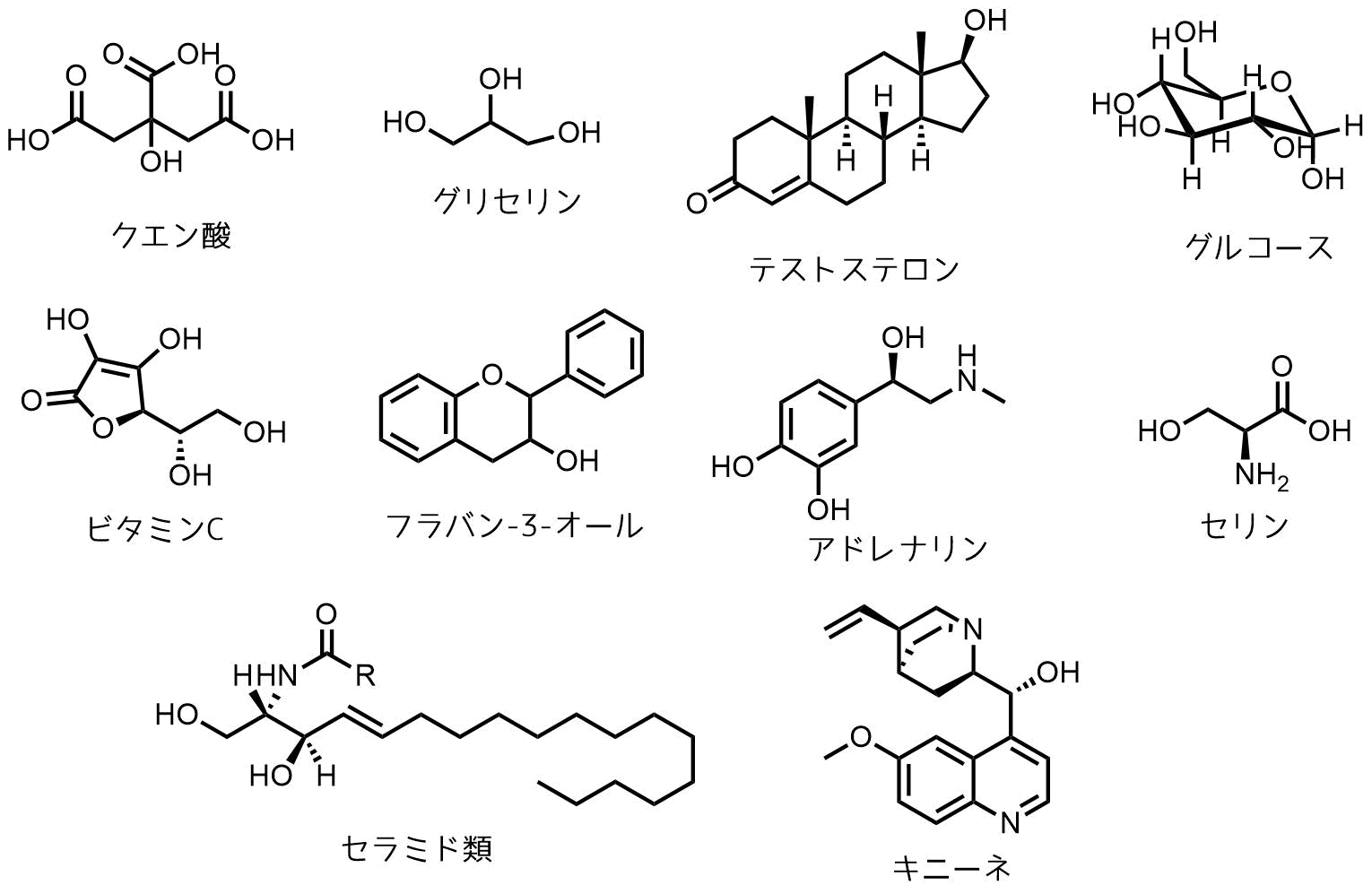
アルコール一覧 身の回りにはたくさんアルコールがあります。
アルコールの命名法
アルコールの名前には多くの慣用名があります。グリセリンも慣用名です。IUPAC命名法に従えば、1,2,3-プロパントリオールとなります。
官能基の優先順位
カルボン酸>エステル>アミド>ニトリル>アルデヒド>ケトン>アルコール>アミン>アルケン>エーテル>ハロゲン
以下のような手順で命名します。
- 主鎖の決定(官能基を含む最も長い炭素鎖(主鎖)を調べる)
- ヒドロキシ基しかない場合はそれを含む炭素鎖を選ぶ。ただし他の官能基がある場合は上記の優先度に従う
- ヒドロキシ基に近い側の炭素から番号付けする
- 語尾に-ol(オール)を付ける(methane→ methanol)
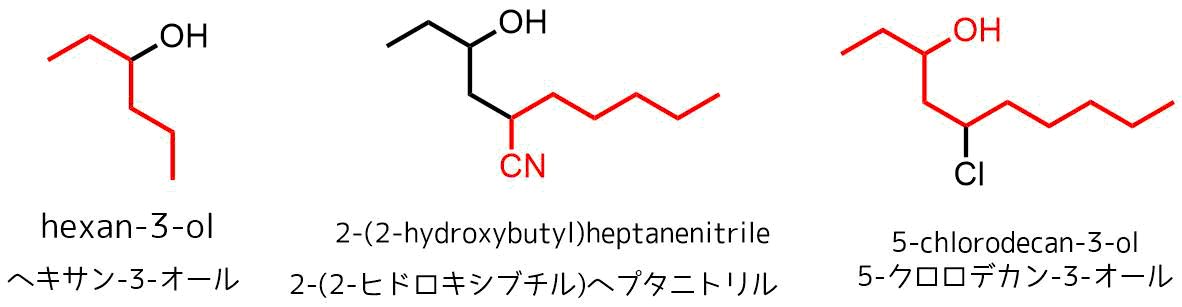
アルコールの命名法一覧 (ニトリルのほうが優先度が高いので主鎖が違う)
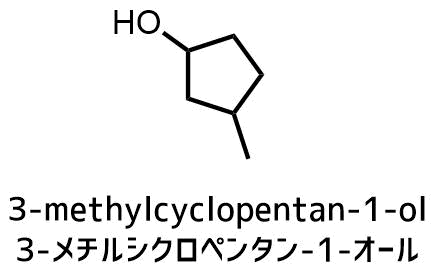
環がある場合は優先される
アルコールの級数
アルコールはヒドロキシ基が結合している炭素にある炭素置換基の数によって一級や二級などに分類されます。
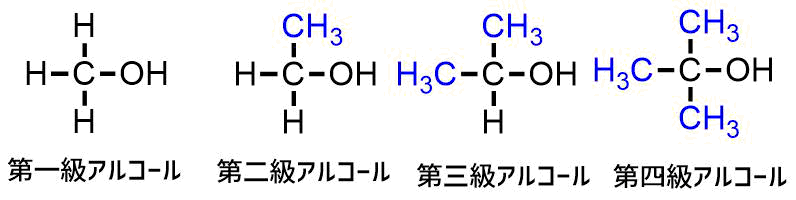
アルコールの級数
アルコールの性質
アルコールの特徴的な性質はヒドロキシ基に由来します。アルコールの特徴をキーワードで挙げると
- 極性が高い
- 水に溶ける
- ヒドロキシ基の水素が外れやすい
- 高沸点
- 水素結合
などがあります。
ヒドロキシ基は水と構造が近いことから、性質も近いです。アルコールは炭化水素基とヒドロキシ基を持つため水と油の中間的性質を持ちます。
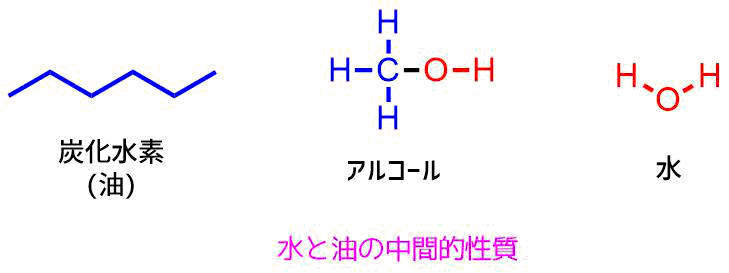
アルコールの性質は水と油の中間的な性質(炭化水素はガソリンなどの油)
油汚れは水で洗ってもなかなか落ちませんが、アルコールで拭くとよく落ちます。これは水は油と混じり合いません(溶けない)が、アルコールは油と混じり合えるからです。
ところで水の特徴はご存知ですか?水はかなり小さい分子で3つの原子しか持ちません。水の性質は似た分子と比較すると見えてきます。
アルコールの沸点の秘密
メタンやアンモニア、ジメチルエーテルは水と同じ小さい分子です。これらの分子の中で水だけが突出して沸点が高いです。基本的に分子が小さいものほど沸点が低い傾向があります。なんと水は沸点が100℃ですがこれはかなり異常な値で、メタンやアンモニア、ジメチルエーテルの沸点は氷点下以下で、常温では気体です。
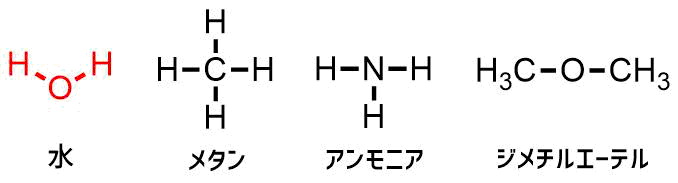
水の性質 沸点は水は100℃でもそれ以外は氷点下以下
水の沸点の高さは水の特徴をよく表しています。沸点とは液体から状態変化するときの温度です。沸点が高いほど分子同士のつながりが強いことを表しています。つまり、水は分子同士のつながりが強いということです。
なぜ水は分子同士が引き合っているのでしょうか?その理由は「水が分極しているから」です。水は電気陰性度が高い酸素と水素が結合していることにより水素は+に酸素は-に分極しています。そのため水分子の水素と酸素同士が引き合います。これを水素結合といいます。メタンでは炭素と水素は分極が小さいためこのような力は働きにくいです。
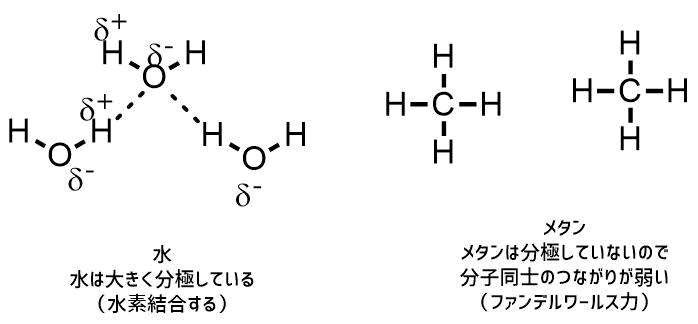
水は水素結合する
アルコールは水と同様に酸素と水素の結合をもちます。分極していないメタンと同じ炭化水素の構造と水の構造両方を持つことから中間的な性質を示します。沸点も水ほど高くありませんが、メタノールは64.7℃とかなり高い沸点です。
アルコールの酸性度
アルコールのもう一つの重要な特徴は「酸性度の高い水素をもっていること」です。
アルコールは中性でしょ?と思うかもしれません。その通り中性ですが、それはプロトンを出す物質の中での話です。
全くプロトンを出さない物質もあります。例えばメタンです。メタンの水素は圧倒的に取れにくいです。水やアルコールのヒドロキシ基は水素がプラスに分極しているだけあってメタンと比べて外れやすいのです。塩化水素などは大きく分極していて水素は外れやすい→強酸です。アルコールも中性ですがメタンなどと比べればずっと酸性度は高いです。
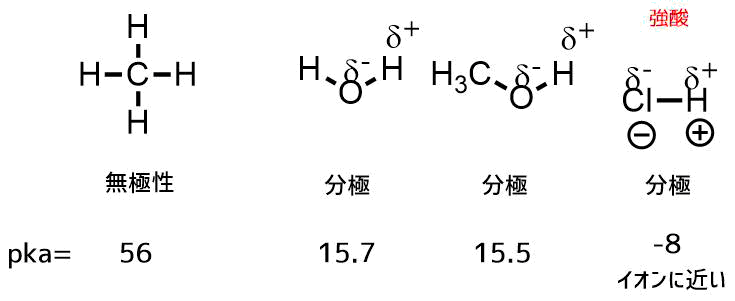
アルコールの酸性度を比較
アルコールの酸性度の高さが意味していることのひとつは、塩基を加えると引き抜かれるということです。アルコールの水素が塩基によって引き抜かれると「アルコキシド」が生成します。
アルコキシドはアルコールが水素を一つ失っただけにすぎませんが、性質は大きく変化します。例えばハロゲン化アルキルとアルコールは一緒に加えても反応することはありませんが、アルコキシドとハロゲン化アルキルは互いに反応してエーテルを生成します。この反応はウィリアムソンエーテル合成と名付けられている人名反応です。
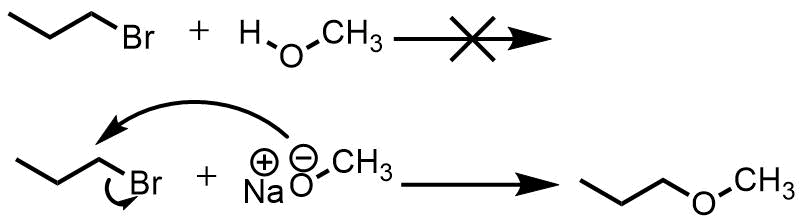
アルコキシドの反応性、エーテルの合成。アルコキシドは大きく負に帯電して不安定でアルコールよりも高い求核性・塩基性を示す
フェノールの性質
フェノールの酸性度
フェノールは芳香族アルコール、芳香環にヒドロキシ基がついた化合物のことを指します。多くの化合物グループでは芳香族化合物と脂肪族化合物(アルキル鎖の化合物)とでは性質が異なります。アルコールも例外ではないです。
フェノール(芳香族アルコール)が脂肪族アルコールと大きく違う点は「酸性度の高さ」です。脂肪族アルコールは中性を示すのに対してフェノールは弱酸性を示します。
フェノールと脂肪族アルコールとの違いはどこにあるかというと、当たり前ですが芳香環にあります。
芳香環がヒドロキシ基と結合するこによって何が変わるのでしょうか?キーワードは「共鳴」です。
電子はその場にとどまるよりも、分子全体に非局在化(散らばった)したほうが安定です。ベンゼン環上では二重結合に由来するπ電子が存在していますが、これは通常のアルケンとは違って二炭素上にとどまらずに6炭素上に均等に散らばります。このような現象を共鳴といいます。共鳴しようとする力は強く影響力が大きいです
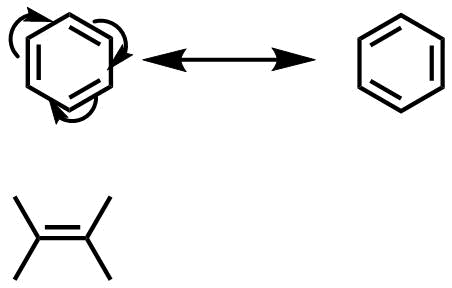
ベンゼンの共鳴
アルコールのヒドロキシ基は酸素の電気陰性度が高いため分極していると解説しました。これは言い方を変えると電子が酸素上に偏っている(局在化)しているといえます。しかしこれはあまり安定な状態ではないです。このヒドロキシ基が芳香環に結合するとどうなるかというと、共鳴安定化しようとして、酸素上の電子がベンゼン環上に移動して非局在化しようとします(フェノールは共鳴する)。
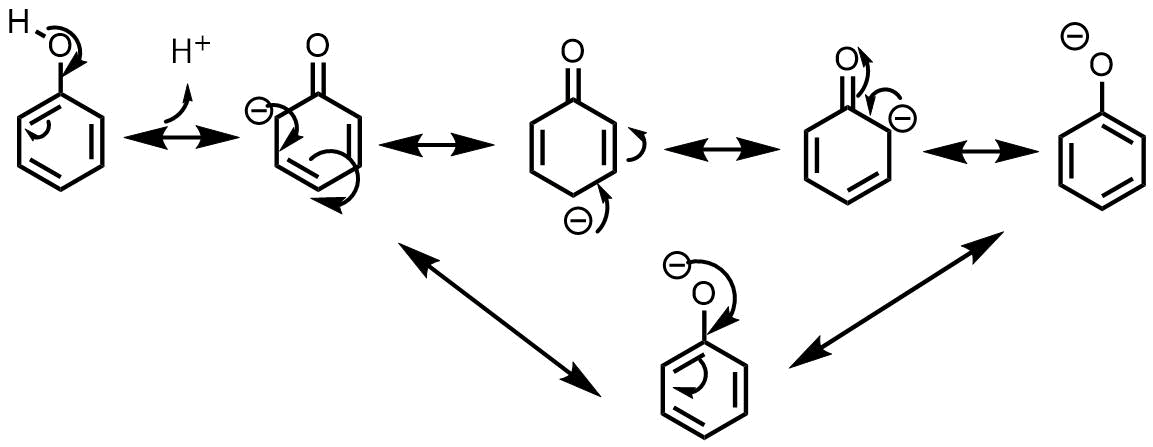
フェノールの共鳴
フェノールのヒドロキシ基の電子がベンゼン環上に流れて負電荷が移動しているのがわかります。これを共鳴構造といいます。ある共鳴構造を書くとき複数の共鳴構造か書けるほうが電子の偏りが小さくなり安定といわれています。フェノールは共鳴しようとする力が大きい→水素が外れる必要がある→酸性度が高くなるということです。ちなみに硫酸の酸性度が高いのも酢酸の酸性度が高いのもこの共鳴が鍵になっています。
ちなみにフェノールの共鳴構造の負電荷の位置を覚えておいてください。
フェノールの反応性
フェノールは反応性が高いですが、脂肪族アルコキシドとは違った反応性を示します。これも芳香環があるからです。
もう一度フェノールの共鳴構造を見てください。フェノールの負電荷は酸素上に常にあるわけではなく芳香環上にもあるということです。芳香環上の負電荷がアルコキシドと同じように反応することがあります。こういった反応は芳香族求電子置換反応といいます。フリーデルクラフツ反応などが代表例です。
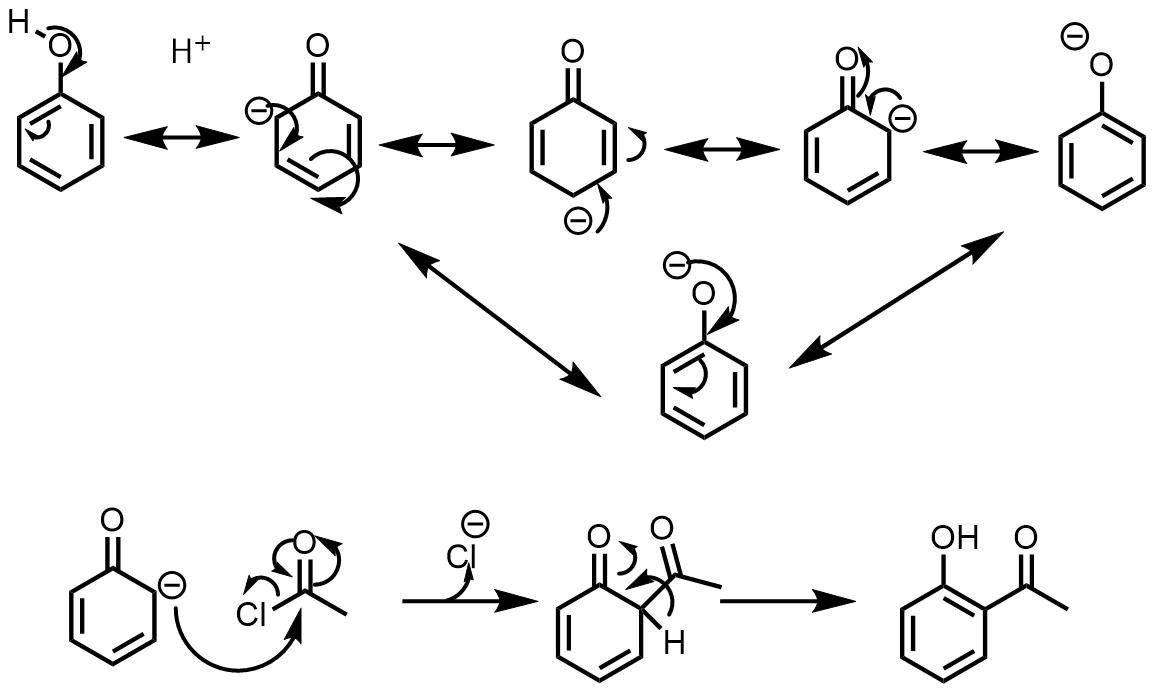
フェノールの反応 フェノールの共鳴式の負電荷がある位置で反応が起こる。アシルハライドとの反応はフリーデルクラフツ・アシル化反応と呼ばれる
このようにフェノールは芳香環上での反応を促進させることが知られています。そして置換が起こる位置もヒドロキシ基がついている炭素の隣と三個となりの位置(オルト位とパラ位)で起こります。こういう性質を配向性といいます。
フェノールはオルト・パラ配向性の活性基です。
アルコールの合成
アルコールの合成方法は多岐にわたります。
などがあります。またTBSやTHP基で保護されたアルコール体を脱保護して用いる方法もあります。
アルコールを原料とした合成
アルコールは安価かつ入手性が高いために様々な官能基変換の足掛かりになります。
- アルコールの酸化でアルデヒド・ケトン合成
- アルコールの脱水でアルケン合成
- エーテル合成
- 脱離基の導入(メシルやトシル基)