水素化アルミニウムリチウムはヒドリド還元剤のなかで最も強い還元力をもつ還元剤で、カルボン酸やアミド等も還元可能です。エステルの還元でよく利用されますが、反応性が高く発火しやすいのが欠点です。
水素化アルミニウムリチウムとは?
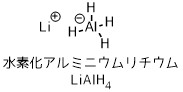
水素化アルミニウムリチウムは通称ラー(LAH)とも呼ばれ、多くのカルボニル誘導体(エステルやアミド、カルボン酸も)を還元する強力なヒドリド還元剤です。
同類のヒドリド還元剤の中では最も高い反応性を持つため、しばしば水との接触により爆発的に反応して事故をおこすことで有名です。
LAHは灰色の粉末でジエチルエーテルやTHFなどのエーテル系溶媒に可溶です。溶媒は乾燥したものを用いないと爆発の危険があります。脱水溶媒を用いましょう。
エーテル系溶媒に過酸化物が多く含まれているとそれが原因で爆発した事故例があります。古くなったエーテル系溶媒はアルミナカラムなどで過酸化物を除去してから使用しましょう。
水素化アルミニウムリチウムは溶液中の酸素とも反応して水素を発生します。水素化アルミニウムリチウムを乾燥剤として不活性ガス下で脱水溶媒を作れば脱酸素した溶媒を得ることができます。
ただし危険性があるため大スケールなら代替の脱酸素法を利用するほうが賢明です。
また、アルコールやアミンが原料試薬に含まれていれば活性プロトンを引き抜いて水素が発生し、アルコールやアミンと錯体を形成します。
LiAlH4の欠点
強力ゆえに官能基選択性は低く、爆発の危険もある。
溶媒に溶けにくい
水素化アルミニウムリチウムを用いた反応
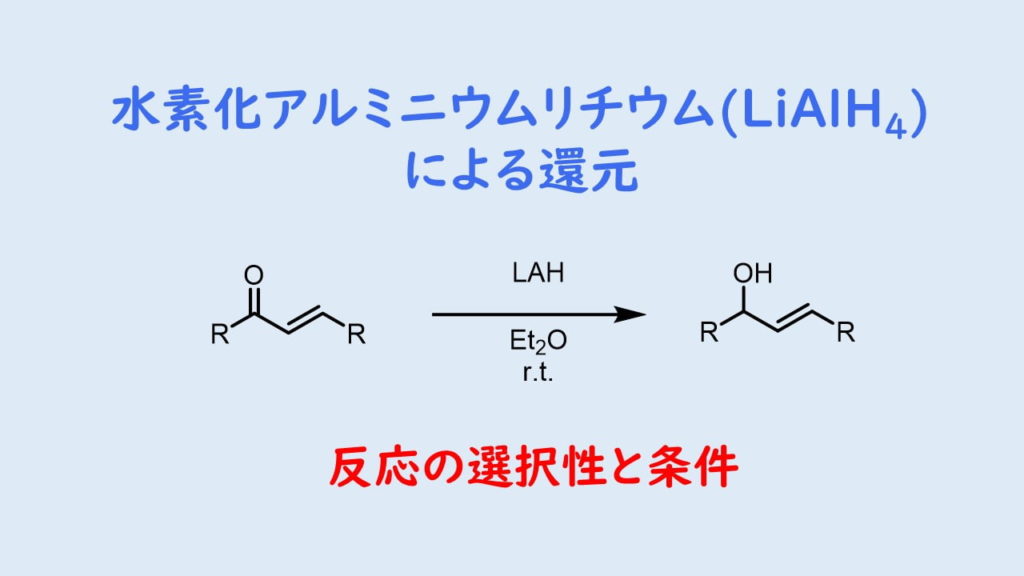
LAHは二重結合を還元せずにC=O結合を還元することが可能です。LAHは反応性が高い上に立体障害を受けにくい心強い還元剤です。特にエステルをアルコールに還元する用途に使われることが多い気がします。
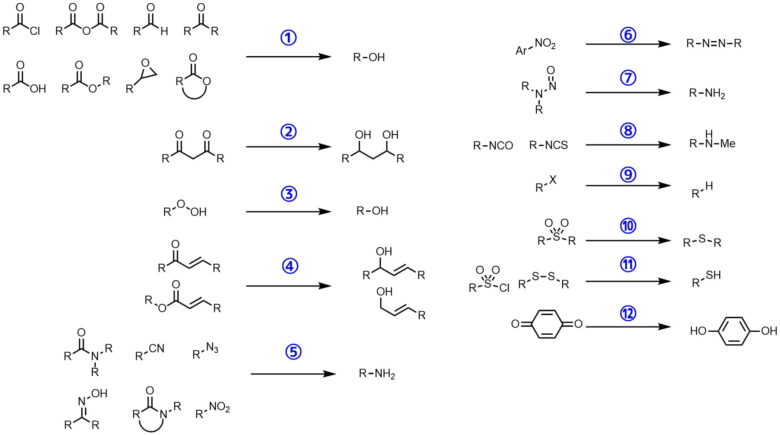
- 酸ハロゲン化物、酸無水物、アルデヒド、ケトン、カルボン酸及びその塩、エステル、エポキシド、ラクトン→アルコール
- ジケトン→ジオール(片側のみ還元もある)
- 過酸化物→アルコール
- αβ不飽和エステル→アリルアルコール(1,2還元)
- アミド(3級も)やニトリル、アジド、ニトロ基(脂肪族)、オキシム、ラクタム→アミン
- ニトロ基(芳香族)→アゾ化合物
- ニトロソアミン→ヒドラジン類
- イソシアナート、チオイソシアナート→N-メチルアミン類
- ハロアルカン→水素置換体
- スルホン→スルフィド
- ジスルフィド、塩化スルホニル→チオール
- キノン→ヒドロキノン
などを還元することが可能です。非常に多くの官能基が変換を受けるような印象を与えますが、基本的に還元するのは炭素ーヘテロ二重結合です。
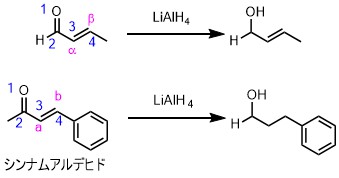
αβ不飽和カルボニル類はDIBALと同様にアルミニウムの酸素への強い配位能を示すために1,2還元が進行し、二重結合は還元されません。ただし、シンナムアルデヒドなどのようにオレフィンが共役した場合はオレフィンの還元も進行します。
ハロアルカン類の還元的脱水素化は進行してアルカン類を与えますが、Pd/Cなどの接触還元法とは異なって芳香族ハロゲン化物は安定でブロモなども還元されません(場合により還元されることもあるので注意する)。アリル位のハロゲンは還元されるので注意しましょう。
酸アミド類の還元は多置換アミドの場合C-N結合が切断してアルコールが生成することがあります。
還元反応の官能基選択性
LiAlH4は強力な還元剤ゆえに官能基選択的な還元を達成するには他のヒドリド還元剤を用いたほうが良いです。一応は試薬当量や温度などで選択性を出すことも可能です。
水素化アルミニウムリチウムによる還元はケトン、アルデヒドが最も容易に還元されます。試薬の当量を調節により官能基選択性を制御します。おおよその還元しやすさの順序は以下の通りです。
![]()
- ケトン、アルデヒド
- 酸塩化物
- 酸無水物
- エステル
- カルボン酸
- ハロアルカン
- ニトロ基
です。
エポキシドの還元は脱酸素しやすいPd/CよりもLiAlH4を用いたほうが良いです。
エポキシの位置選択性は電気陰性度の大きい炭素に水酸基が来るように選択的に開裂するのが一般的です。
多置換エポキシドの場合は第三級アルコールが生成するような開裂が有利です。選択性に関してはヒドリド還元剤のRed-Alも良いです。
脱ハロゲン化は進行しにくいことが多いため、酸ハロゲン化物を還元してハロゲン化アルキルを得ることも可能です。(アリル位のハロゲンは還元されやすい)
ニトリルの還元は当量を抑えることによりアミンまで還元せずにイミンとして加水分解してアルデヒドを得ることができます。
複素環はカルボン酸などの電子吸引基がなければピリジンやキノリンはジヒドロ体に還元されます。
窒素系官能基の還元
ニトロ基の還元
脂肪族ニトロ基はアミンに容易に還元されますが、芳香族ニトロはアミンではなく二量化してアゾ化合物を生じます。生じたアゾ化合物は通常過剰のLiAlH4が存在してもヒドラジンまで還元されません。
オキシム-ニトロソアミンの還元
オキシムは還元されてアミンを生じます。また、ニトロソアミンはヒドラジン化合物を生じます。
イソシアナートの還元によりN-メチルアミンの合成
イソシアナートやチオイソシアナートはLiAlH4による還元によってN-メチルアミンに還元できます。モノメチル化体を得る特殊な方法です。
アミドの還元
LiAlH4ではアミドの還元も可能です。
アミドの反応性は第三級アミドが最も反応性が高く、第二級、第一級の順に低下します。
ラクタムも還元も可能ですが還流などより過激な条件が必要です。
硫黄系官能基の還元
ジスルフィドは容易に還元を受けてチオールを生じます。
スルホンRSO2Rは還元を受けてスルフィドを生じますが、スルホキシドは還元できません。
また、スルフィン酸は還元を受けてチオールを生じます。
トシラートなどスルホン酸エステルの還元はアルカンを生じますが、スルフィン酸への還元が進行する場合もあるので文献調査が必要です。
酸素系官能基の還元
アルコールの還元
塩化アルミニウムとの混合によって生成するAlHCl2は脂肪族第二級、第三級アルコールを還元してアルカンおよびアルケンが生成します。カルボカチオンが中間体として生成するためヒドリド移動やプロトン脱離によって混合物が生成する。
カルボカチオンを中間体として生成するので、脂肪族第一級アルコールは一般的に還元されないです。その一方でベンジルアルコールは電子供与基がないと還元されにくいです。
エーテル、アセタール、ケタールの還元
エーテルは一般的には還元されませんが、塩化アルミニウムを加えることによって還元反応が進行する。THFは還元されてアルコール体になるので注意しましょう。意外とTHFは反応することがあるので注意しましょう。
ケタールも同様に塩化アルミニウムの添加が有効です。ケタールは還元によりエーテルを生成します。
カルボン酸の還元
カルボン酸の還元はアラン、LiAlH4により還元されてアルコールを生成します。しかし、一般的に、LiAlH4のカルボン酸の還元は、カルボン酸エーテルの溶解性が低いことから進行しにくいです。通常はエステルや酸塩化物とした後に還元した方が収率が良いです。
反応溶媒の選択
反応溶媒は活性プロトンを有するアルコールやアミン類は反応するため利用できません。
通常は溶解するエーテル系溶媒を利用します。最もよく利用するのはジエチルエーテルですが、沸点が低いため、より高い温度で反応させたい場合はTHF(b.p.65℃)を利用します。
より高沸点のジオキサンやモルホリン、ジブチルエーテルを利用することもできますが、LAHが分解するので反応温度は100℃以下に抑えます。THFの加熱還流くらいがちょうど良いでしょう。
ピリジンを反応溶媒としても利用できますが、反応によりピリジン錯体が生成します。これはケトン 選択的に還元し、カルボン酸やエステルとは反応しません。
アルコールも同様に反応して水素化アルコキシアルミニウムリチウムが生成します。
LAHのクエンチ方法
未反応のLiAlH4が残っていることがあるので、反応後はクエンチします。
クエンチは水素が発生しない酢酸エチル(エステル)を加える方法が安全です。
小スケールの場合は水を加えたり、飽和酒石酸カリウムナトリウム水溶液、飽和硫酸ナトリウム水溶液を加えてクエンチすることも多いです。
ゲル状の沈殿が出た際は、無水硫酸ナトリウムを加えると解消することがある?
LiAlH4を用いた反応条件
水素化アルミニウムリチウムを用いた反応で最もよく利用されるのはエステルの還元です。その次に、アミド、ケトン、カルボン酸、ニトリルの還元などが続きます。
エステルの還元条件
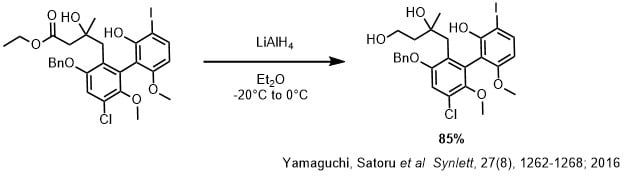
ジエチルエーテル(50mL)とエステル体(1.00g,1.56mmol)の溶液に、-20度でLiAlH4(414mg,10.9mmol)を少しずつ加えた後0度で50分間撹拌した後、飽和塩化アンモニウム水溶液を加えて後処理後にカラム精製して目的物を得た(85%)。
LAHを使ったエステルの還元ですが、ヨウ素等のハロゲンは還元されていません。またベンジル基もはずれずにエステルのみを還元しています。LAHは芳香族ハロゲンの還元はしにくいので、この合成が可能になっています。
アミド、ニトリルの還元
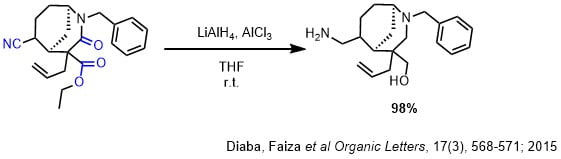
THF(10.6mL)とAlCl3(462mg,3.46mmol)の溶液に1M LiAlH4 in THF(10.38mL,10.38mmol)の溶液を加え、混合物を室温で15分間撹拌した。THF(9mL)と原料(845mg,2.31mmol)の溶液をカニュレで滴下して加えて室温で一晩撹拌した。混合物を0度に冷却し、30%KOH水溶液でクエンチ後抽出、乾燥して目的物を98%で得た。
この合成法では、ニトリルとアミドとエステルを一挙に還元しています。収率も良く、二重結合やNベンジルも影響を受けていません。立体も保持されています。この条件では塩化アルミニウムを加えてアラン(AlH3)を発生させています。還元特性はLiAlH4に非常によく似ていますが、官能基選択性や立体選択性が少し異なります。
LiAlH4を用いたアミドの還元は基本的には収率よく進行しますが、長時間または加熱が必要です。
カルボン酸の還元
カルボン酸は還元しにくいですがLiAlH4では還元可能です。
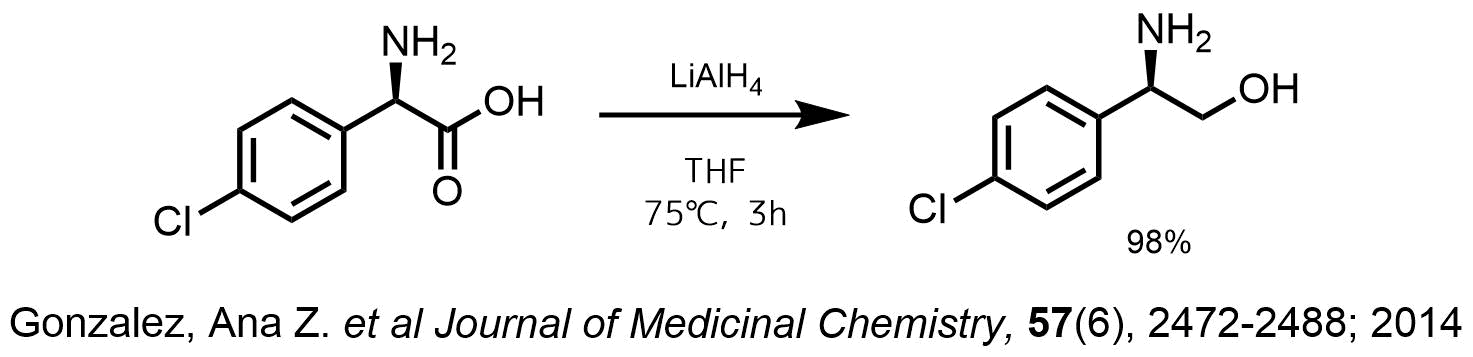
THF中の1MのLiAlH4の溶液を460 mLの無水THFで希釈し、窒素雰囲気下で75度に加熱し、アミン体(25.0 g, 135 mmol)を数回に分けて加えた。反応混合物を約3時間加熱還流し、室温に冷却後、水(8.0 mL),15%NaOH水溶液(8.0 mL)、水(25.6 mL)を順次加えてクエンチした。混合物を30分間激しく撹拌後、固体を濾別してTHFですすぎ、濃縮、目的物を98%で得た。
アミノ酸類のカルボン酸の還元にLiAlH4はよく利用されています。アミンの活性プロトンが含まれていても問題ないようですね。LAHは1.5-2eqほど加えて反応を行うようです。アランを使用することもあります。
エステルや酸塩化物にしてから還元した方が良いことが多いです。
水素化アルミニウムリチウム還元の反応機構
水素化アルミニウムリチウムを使ったエステルの還元の反応機構です。
水素化アルミニウムリチウムによる還元は一段階目はエステルがアルデヒドに還元された後、二段階目にアルデヒドが還元されてアルコールになります。
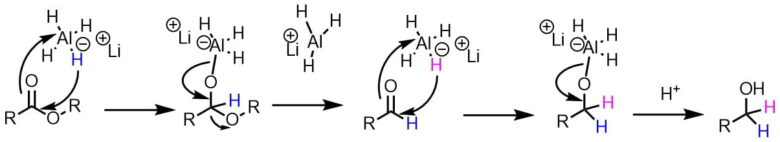 LiAlH4によるエステルの還元は一般にアルコールまで進行し、アルデヒドに部分還元するのは困難です。
LiAlH4によるエステルの還元は一般にアルコールまで進行し、アルデヒドに部分還元するのは困難です。
アラン(AlH3)、AlHCl2の発生
アラン(AlH3)は3当量の水素化アルミニウムリチウムと塩化アルミニウム(AlCl3)加えることによって調製できます。
AlHCl2は逆に塩化アルミニウム3当量とすることで生成します。
アランの還元力は水素化アルミニウムリチウムと似ていますが、炭素ハロゲン結合の還元的切断はLAHよりも起こりにくく、これらを含むカルボン酸やエステル、αハロケトンなどの還元に有用です。ニトロ基の還元も起こりません。
一方でLAHよりもアランのほうがエステルの還元は早い傾向があります。また光学活性なケトンの還元の選択性も高い傾向があります。
エーテルの還元も可能です。その場合はジオキサンを溶媒とすると良い。
水素化アルコキシアルミニウムリチウムの生成
アルコールと反応させると水素化アルコキシアルミニウムリチウムが生成します。
水素がアルコキシ基(RO)に置換したこの化合物は、立体選択性が向上します。
特にtBuOHとの反応により生じるLiAl(tBuO)3は単離可能でよく使用されています。



カルボン酸の還元部分のスキームがno reactionです
ご覧いただきありがとうございます。
ご指摘について修正しました。