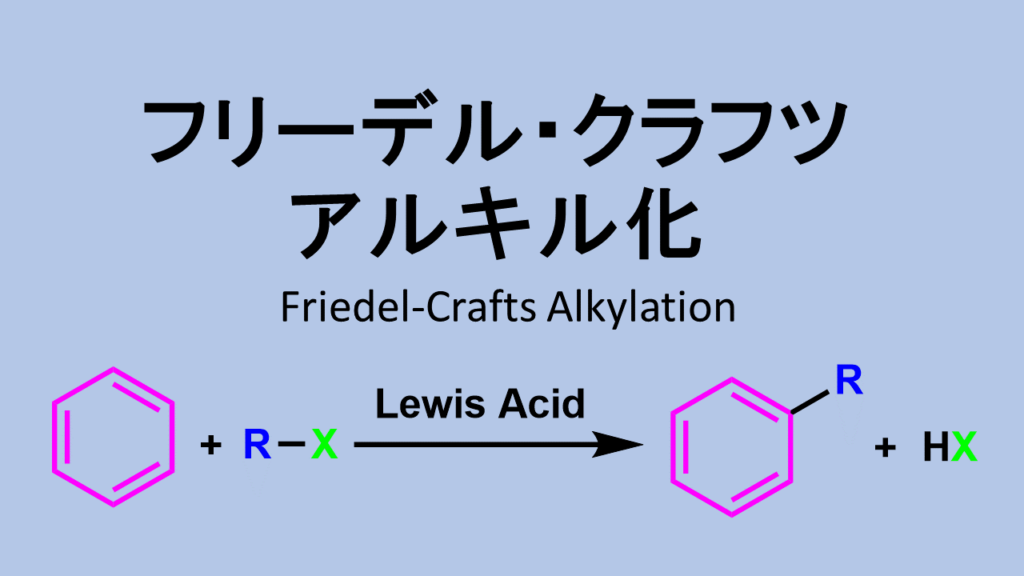
フリーデル-クラフツ アルキル化
フリーデルクラフツ反応は芳香族化合物とアルキルハライドをルイス酸(AlCl3 etc)存在下反応させることにより、芳香環に直接アルキル基を導入する反応です。
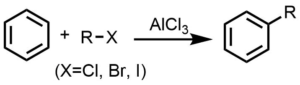
Friedel crafts alkylation
フリーデルクラフツ反応自体は芳香環に炭素-炭素結合を導入する方法として実用的かつ有用な方法です。
有機化学の教科書でも芳香族求電子置換反応の代表例として登場します。
フリーデルクラフツ反応では電子不足なアルキル化剤(+)に対して芳香環から電子が飛び出して反応が進行します。そのため、電子供与基のメトキシ基(OMe)が結合した芳香環は反応性が高いです。一方でアシル基などの電子求引基を持つ芳香環は反応性が低くなります。
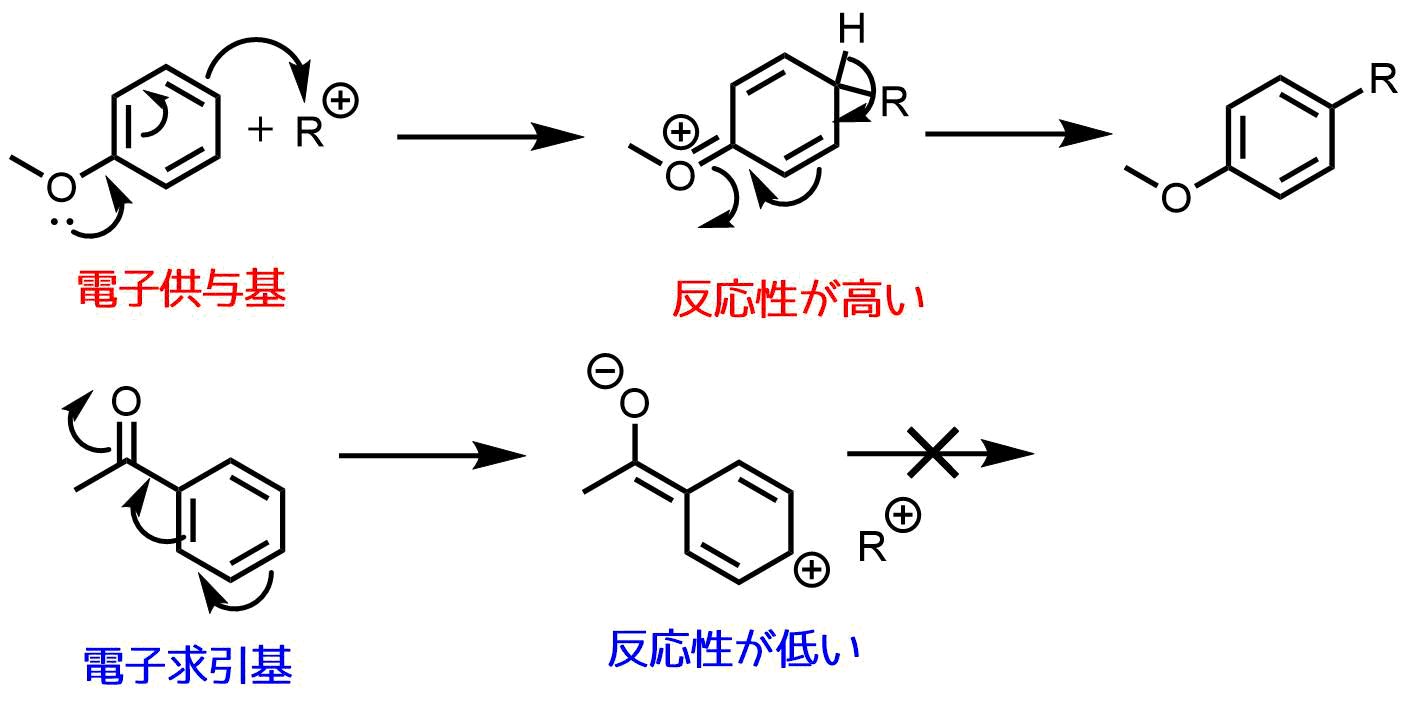
フリーデルクラフツ反応の反応性
フリーデルクラフツ反応はC.FriedelとJ.M.Craftsが1877年に開発された芳香族のアルキル化反応(炭素ー炭素結合形成反応)です。彼らはAlCl3がアルキル化を促進していることを発見しました。それ以降現代にかけてフリーデルクラフツ反応は有用な芳香族のアルキル化反応として利用されています。
フリーデルクラフツ反応の原型はアリールハライドと金属ナトリウムとの反応により起こるホモカップリング反応だといわれています。元々フリーデルはウルツ研究室出身であり、金属アルミニウムに注目してアルキルハライドとの反応を詳細に解析した結果、発見されました。
田代昌士. “Friedel‐Crafts 反応における合成総論 歴史的なことを含めて.” 有機合成化学協会誌 36.6 (1978): 426-439.
フリーデルクラフツ・アルキル化反応の特徴
フリーデルクラフツ反応の課題は、
- ポリアルキル化:アルキル化が複数進行する
- AlCl3の諸問題 (試薬の活性、すりつぶす必要、多量に要する場合、後処理が面倒)
- 電子不足な芳香環では反応が進行し難い
などがあります。
ポリアルキル化は反応生成物がさらにアルキル化剤と反応して複数のアルキル基が入る問題です。
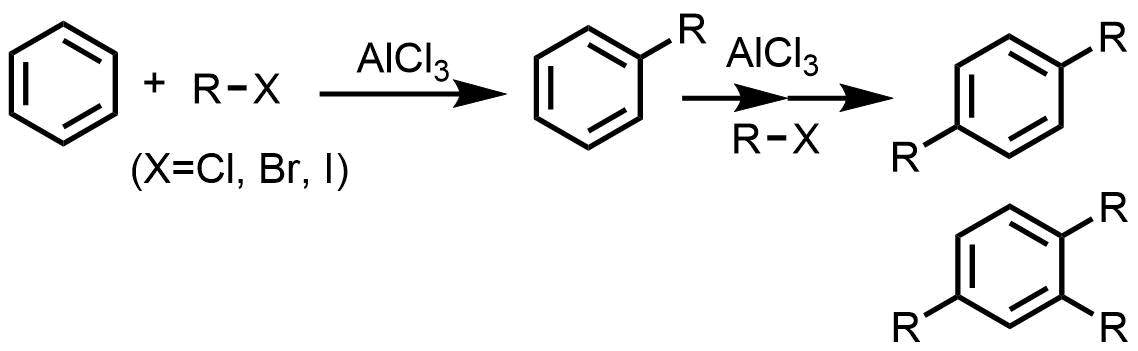
フリーデルクラフツ反応のポリアルキル化問題
アルキル基は弱い電子供与基であるため原料よりも反応性が増加することが理由です。
酸塩化物をアルキル化剤とするフリーデルクラフツ・アシル化反応は反応後に電子求引基が入るため、反応生成物の反応性が低下して反応がそれ以上進行しにくくなります。反対に最初から電子求引基を持つ場合は反応が進行しなくなります。
AlCl3は時に化学量論量必要です(アルキル化は触媒量で済むがアシル化やスルホニル化などはもっと多く必要)。また、無水物は湿気に弱く活性が低下するため、乾燥室内に保存します。
フリーデルクラフツ・アルキル化が有用な例としては分子内環化反応があります。
アルキル置換した芳香環のオルト配向性を利用して閉環体を得る方法は分子間よりも早い分子内反応のためポリアルキル化が起こりにくく、異性体も生じにくいです。
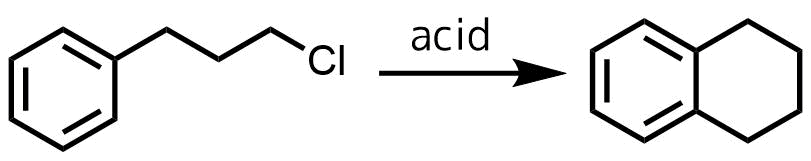
フリーデルクラフツ反応の分子内反応
フリーデルクラフツアルキル化反応の条件
芳香族化合物
フリーデルクラフツアルキル化反応は芳香環からアルキル化試薬への芳香族求電子置換反応であるため、電子不足な芳香環では反応が起こりにくいです。
例えば以下のような電子求引基がある場合は反応の進行は困難になります。
- ニトロ基、シアノ基、スルホ基、カルボニル基、エステル、カルボン酸
アリールハライドは反応性は低くなりますが、反応は進行します(オルト、パラ配向性の不活性基)。
電子供与基がある芳香環およびフランやチオフェンなどの電子豊富な複素環は前述のとおり、ポリアルキル化が問題になります。通常はアシル化が推奨されます。ポリアルキル化を抑える方法として
- ベンゼンを溶媒量用いる
- 触媒をよくすりつぶし、溶解しやすい極性溶媒(ニトロメタンやニトロベンゼン等)を用いてできるだけ均一系にする
- 激しく攪拌
などの方法があります。
配向性
アルキル化は活性基が入っている場合はオルト・パラ配向性を示します。
嵩高いターシャリーブチル基は立体障害により置換位置を制御することが可能です。
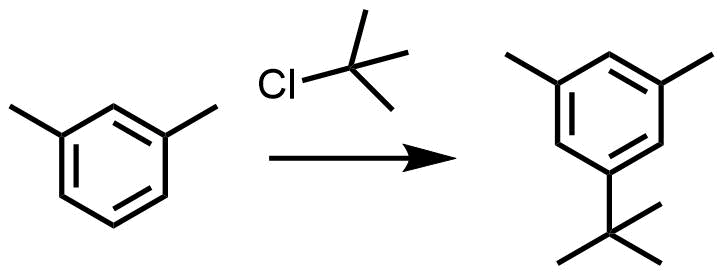
フリーデルクラフツ反応の立体障害の利用
Tashiro, M., H. Watanabe, and O. Tsuge. “Studies on positional protective groups on aromatic rings I. A new preparative method for halophenols with the t-butyl or benzyl group as a protective group.” Organic Preparations and Procedures International 6.3 (1974): 107-115.
アルキル化試薬
アルキル化試薬としてはアルキルハライドが最もよく利用されます
ハロゲン化アルキルの反応性は
F>Cl > Br > I
の順で反応性が高くなります。ヨウ化アルキルは反応性が低くあまり用いることはなく、塩化アルキルが反応性も高く、安価で入手しやすいのでよく使います。
アルキル基による反応性の違いについては、
3°>Benzyl>2°>1°
第三級アルキル基が最も反応性が高く、第一級アルキル基が最も反応性が低いです。
他にもスルホン酸エステル、アルケンやアルコールが用いられることもあります。
ベンジルアルコールを求電子剤として用いる場合はトリフルオロメタンスルホン酸(TfOH)とヘキサフルオロイソプロパノール溶媒中で効率的に進行することが報告されています。
Vuković, Vuk D., et al. “Catalytic Friedel–Crafts Reactions of Highly Electronically Deactivated Benzylic Alcohols.” Angewandte Chemie International Edition 56.11 (2017): 3085-3089.
酸触媒
AlCl3が初期に発見されて以来、現在においてもよく利用されています。
AlCl3以外にもAlI3、FeCl3、SnCl4、BF3、BCl3、TiCl4、ZrCl3などもあります。
さらに近年は金属元素として希土類元素のルイス酸、カウンターアニオンとしてトリフラート塩を用いた報告も多くあります(Sc(OTf)3, Hf(OTf)4…)
反応機構
フリーデル-クラフツ・アルキル化はルイス酸とアルキルハライドとの反応によって生じる求電子性が高いアルキルカチオンに対して求電子置換反応が起こるという機構が考えられます。
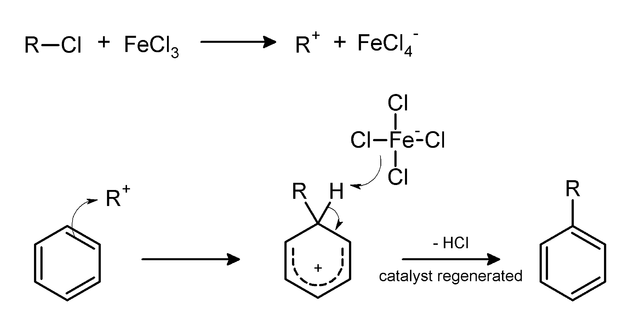
フリーデルクラフツ反応の反応機構 from wiki Public Domain
しかし、実際には求電子剤としてカルボカチオン種が生成する機構はアルキル鎖の級数や溶媒(ニトロベンゼン中では分極性錯体が形成)、ルイス酸や芳香族化合物の違いによって中間体は異なるようです。π錯体を形成するという報告もあります。
NAKANE, Ryohei. “Mechanism of Friedel-Crafts Reaction.” Journal of Synthetic Organic Chemistry, Japan 29.11 (1971): 1020-1031.
反応条件
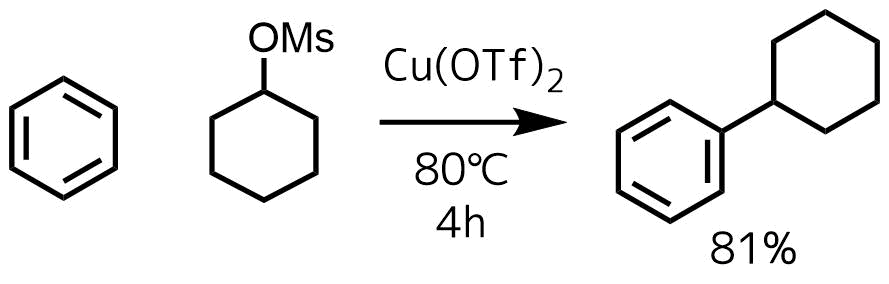
フリーデルクラフツ反応の例を紹介します。古典的な塩化アルミニウムもよく用いますが、近年はトリフラート塩が効率的な触媒としてよく用いられています。
乾燥ジクロロエタン(5 mL)Cu(OTf)2(0.1 mmol; 10 mol%)溶液に攪拌しながらメシラート(1 mmol)と芳香族化合物(1 mmol)を加えて、80℃で4時間加熱した。 反応混合物を真空で濃縮し、石油エーテルによるシリカゲルカラムクロマトグラフィーで精製して81%で得た。
Singh, Ravi P., et al. “An efficient method for aromatic Friedel–Crafts alkylation, acylation, benzoylation, and sulfonylation reactions.” Tetrahedron 57.1 (2001): 241-247.
参考文献
- Calloway, N. O. “The Friedel-Crafts Syntheses.” Chemical Reviews 17.3 (1935): 327-392.
- Prajapati, Sushma, Abhinav Prasoon Mishra, and Ashish Srivastava. “Friedel-Crafts Reaction: A Review.” (2012): 52-62.
- NAKANE, Ryohei. “Mechanism of Friedel-Crafts Reaction.” Journal of Synthetic Organic Chemistry, Japan 29.11 (1971): 1020-1031.
- ODA, Ryohei. “Friedel-Crafts Reaction.” Journal of Synthetic Organic Chemistry, Japan 36.6 (1978): 467-472.