芳香族化合物は、その安定性から天然物および人工物の様々なものに応用されており、研究分野でも芳香族化合物を取り扱ったものが多いです。
そこで、今回は芳香族の中でも頻出するベンゼン環についての1HNMRについてまとめてみました。
ベンゼン環のNMR: 化学シフト値 (ケミカルシフト値)
ベンゼン環などの芳香族化合物は、単純なC-H結合とは異なり比較的低磁場である6-9ppm付近に見られます。この6-9ppm付近の領域は芳香族に特徴的であることから芳香族領域と呼びます。実際にシンプルなベンゼン環は7.26ppmにピークを持ち、他の脂肪族炭化水素(ヘキサンなど)と比較するとかなり低磁場にピークが観測されています。
低磁場シフトの理由: 環電流効果
ベンゼン環などの芳香族化合物がNMRチャートにおいて低磁場に観測されるのは、環電流効果によります。これはベンゼン環の持っているπ電子が原子核からより影響を受けにくいく、このπ電子が広い共役系を持っていることで大きく非局在化しているためです。一方でこのような電子を中心とした化学結合には磁気異方性があって、芳香環外部に存在するHは低磁場に来るのに対し、芳香環内部に存在するHは高磁場に観測されます。ベンゼン環の場合は環の外部にのみHが存在するため低磁場シフトしたピークが観測されます。
ベンゼン環のNMR: 官能基による化学シフト値の変化
先ほども記載した通り、ベンゼンの化学シフト値は7.26ppmであり、種々の官能基を有するベンゼン環の化学シフト値は6-9ppm付近になります(芳香族領域)。また、ベンゼン環についているHの化学シフト値は、近傍についている官能基によって変化します。
電子求引基がついた場合
電子求引基がベンゼン環についている場合は、ベンゼン環上のプロトン近傍にある電子は電子求引基に引き寄せられた状態になります。すなわち、電子密度が下がっているため、化学シフト値は低磁場シフトします。例えば、代表的な電子求引基がオルト位についたベンゼン環の1HNMRの化学シフト値は以下のようになります。
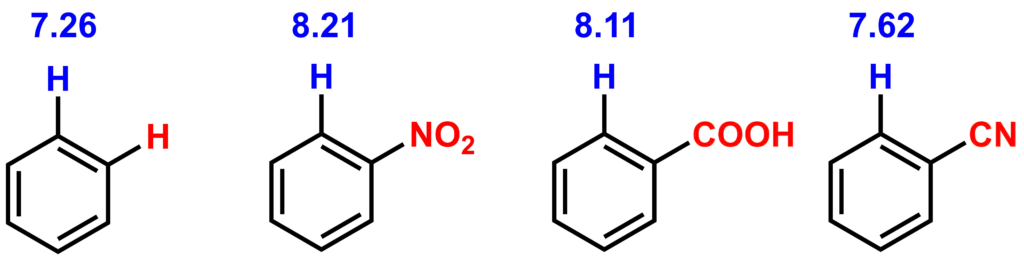
電子供与基がついた場合
逆に電子供与基がベンゼン環についている場合は、ベンゼン環上のプロトン近傍にある電子は電子供与基に押し出された形になって、電子密度が上がり化学シフト値は高磁場シフトします。例えば、代表的な電子供与基がオルト位についたベンゼン環の1HNMRの化学シフト値は以下のようになります。
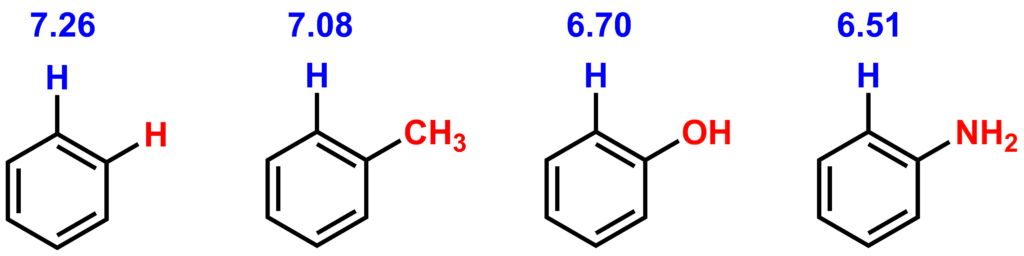
官能基による化学シフト値変化まとめ
ベンゼン環について置換基(官能基)の種類によって1HNMRはベンゼンのケミカルシフト値7.26ppmから変化します。近傍のオルト位、メタ位、パラ位のプロトンすべてが影響を受けます。ベンゼン環に置換基Rが一つついた時の増減値について以下の表に示します。この値を使うと官能基を付けた時や変換したときなど、ベンゼン環プロトンのケミカルシフト値の変化から構造を予測することができます。
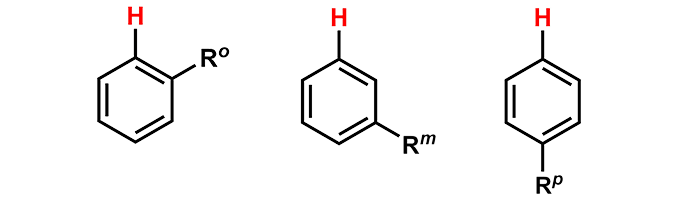
炭素についた置換基
| 置換基 | Ro | Rm | Rp |
|---|---|---|---|
| -H | 0 | 0 | 0 |
| -Me | -0.18 | -0.10 | -0.20 |
| -Et | -0.15 | -0.06 | -0.18 |
| –i-Pr | -0.13 | -0.08 | -0.18 |
| –t-Bu | 0.02 | -0.09 | -0.22 |
| -CH2Cl | 0.00 | 0.01 | 0.00 |
| -CH2OH | -0.07 | -0.07 | -0.07 |
| -CH2NH2 | 0.01 | 0.01 | 0.01 |
| -CH=CH2 | 0.06 | -0.03 | -0.10 |
| -C≡CH | 0.15 | -0.02 | -0.01 |
| -Ph | 0.30 | 0.12 | 0.10 |
| -CHO | 0.56 | 0.22 | 0.29 |
| -CO-CH3 | 0.62 | 0.14 | 0.21 |
| -CO-CH2-CH3 | 0.63 | 0.13 | 0.20 |
| -CO-Ph | 0.47 | 0.14 | 0.22 |
| -COOH | 0.85 | 0.18 | 0.25 |
| -COOCH3 | 0.71 | 0.11 | 0.21 |
| -COOPh | 0.90 | 0.17 | 0.27 |
| -CO-NH2 | 0.61 | 0.10 | 0.17 |
| -COCl | 0.84 | 0.20 | 0.36 |
| -CN | 0.36 | 0.18 | 0.28 |
| -CF3 | 0.19 | -0.07 | 0 |
ヘテロ原子についた置換基
| 置換基 | Ro | Rm | Rp |
|---|---|---|---|
| -NH2 | -0.75 | -0.25 | -0.65 |
| -NH-CH3 | -0.80 | -0.22 | -0.68 |
| -N-(CH3)2 | -0.66 | -0.18 | -0.67 |
| -N+(CH3)3I– | 0.69 | 0.36 | 0.31 |
| -NH-COCH3 | 0.12 | -0.07 | -0.28 |
| -NO | 0.58 | 0.31 | 0.37 |
| -NO2 | 0.95 | 0.26 | 0.38 |
| -SH | -0.08 | -0.16 | -0.22 |
| -SCH3 | -0.08 | -0.10 | -0.24 |
| -S-Ph | 0.06 | -0.09 | -0.15 |
| -SO2-OH | 0.64 | 0.26 | 0.36 |
| -SO2-NH2 | 0.66 | 0.26 | 0.36 |
| -OH | -0.56 | -0.12 | -0.45 |
| -OCH3 | -0.48 | -0.09 | -0.44 |
| -OCH2-CH3 | -0.46 | -0.10 | -0.43 |
| -O-Ph | -0.29 | -0.05 | -0.23 |
| -O-CO-CH3 | -0.25 | 0.03 | -0.13 |
| -O-CO-Ph | -0.09 | 0.09 | -0.08 |
| -F | -0.26 | 0.00 | -0.20 |
| -Cl | 0.03 | -0.02 | -0.09 |
| -Br | 0.18 | -0.08 | -0.04 |
| -I | 0.39 | -0.21 | -0.03 |
ベンゼン環のNMR: カップリング
ベンゼン環などの芳香族化合物も脂肪族化合物同様にカップリング(ピークが割れる)しますが、芳香族は少し特徴的で、特にベンゼン環はパターンを覚えてしまうとぱっと見で何置換か分かるので、カップリングパターンについてもまとめます。
ベンゼン環のNMRカップリングパターン
ベンゼン環の位置関係で行くと、隣接したH以外にもその二つ先までのHがカップリングを起こします(ベンゼン環で言うとパラ位)。それぞれオルト、メタ、パラの位置でカップリングの割れ幅(J値)が異なります。
オルトカップリング
プロトンの位置がお互いにオルト位の位置関係で起きるカップリングをオルトカップリングと言います。大体6~9Hzでカップリングすることが知られています。大きいカップリングのやつと覚えれば大丈夫です。
メタカップリング
プロトンの位置がお互いにメタ位の位置関係で起きるカップリングをオルトカップリングと言います。大体1-3Hzでカップリングすることが知られています。小さいカップリングのやつと覚えれば大丈夫です。
パラカップリング
プロトンの位置がお互いにパラ位の位置関係で起きるカップリングをオルトカップリングと言います。1Hz以下で観測されることもありますが、実際にはほとんど観測できません。ほとんどいないやつと覚えれば大丈夫です。
これら3つのカップリングの組み合わせからできるピークの形で、ある程度パターン化できます。パターンに慣れてくると、チャートを見て瞬時に何置換ベンゼンでどの位置か予測できます。
二置換ベンゼン
今回は分かりやすい例として二置換ベンゼン(ベンゼン環に置換基が二つついた化合物)を例にカップリングパターンを見ていきたいと思います。
① 対称な1,2-二置換ベンゼン
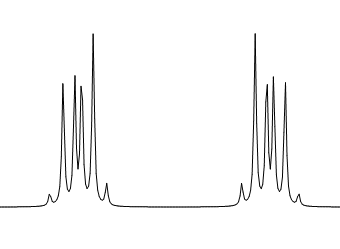
② 非対称な1,2-二置換ベンゼン
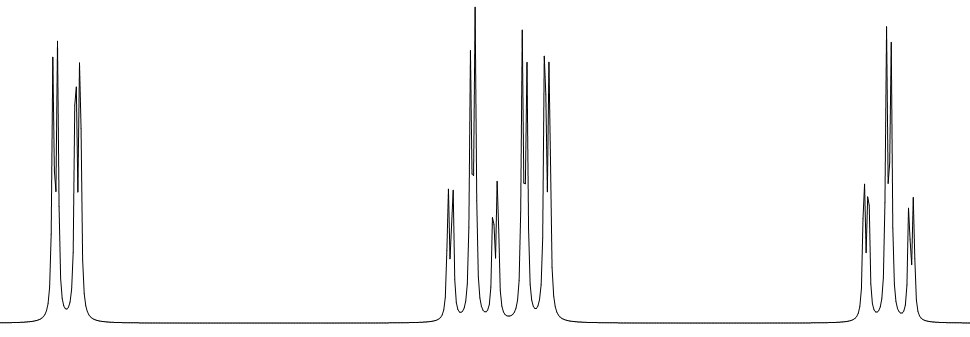
③ 対称な1,3-二置換ベンゼン
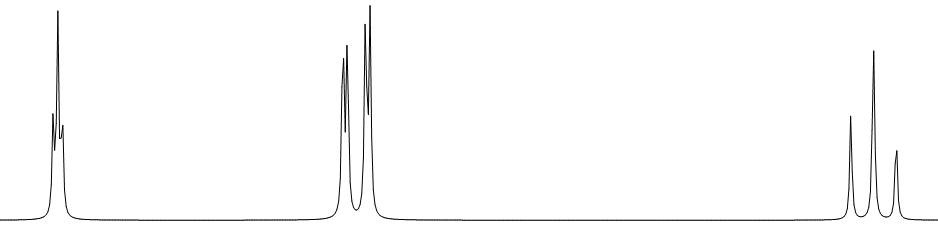
④ 非対称な1,3-二置換ベンゼン
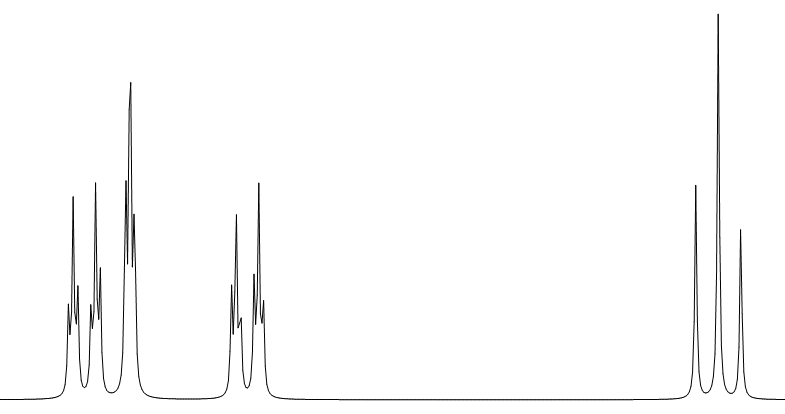
⑤ 対称な1,4-二置換ベンゼン
シングルピークで一つでます!したがって形では判断できません。芳香族にあって積分比が4なら対称な1,4-置換ベンゼンである可能性が高いです。
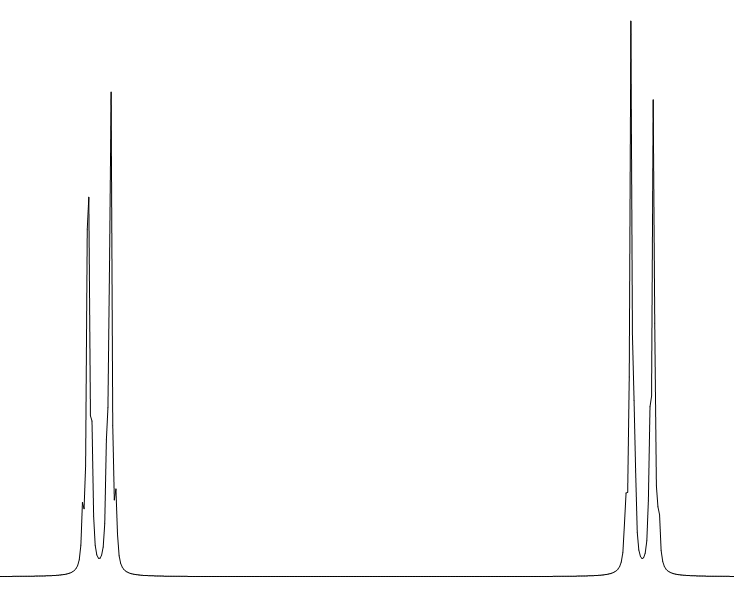
⑥ 非対称な1,4-二置換ベンゼン



とてもわかりやすい記事を書いていただきありがとうございます。
「官能基による化学シフト値変化まとめ」のオルト、メタ、パラの図でメタ位がRp、パラ位がRmとありますが、表記が逆なのではないでしょうか。
ご連絡いただきありがとうございます。
ご指摘頂いた箇所を修正しました。
今後もネットdeカガクをよろしくお願いします。