本記事では、タンパク質を修飾する方法について説明しています。タンパク質の修飾には、遺伝子コードラベル化法、選択的な有機化学反応、システイン残基に対する化学反応、リシン選択的な修飾、チロシン選択的な修飾などがあります。化学修飾には、活性低下、位置選択性、立体構造の保持などの課題があります。
タンパク質の化学修飾とは?
タンパク質の化学修飾とは「酵素や受容体などのタンパク質に化学反応により分子を導入したり部分構造を改変したりすること」です。
酵素などを用いる生物学的手法を用いた修飾もあります。
- 遺伝子の導入や酵素を用いるためこれらの制約を受ける(酵素の特異性、ミスフォールディング)
- 非天然の構造の導入は難しい
化学的手法で狙った位置に選択的に修飾するのは難しいので、位置選択的な手法が研究されています。
化学的修飾は反応試薬や時間、反応試薬を組み合わせることで修飾する量や種類など自由度の高い修飾ができます。コストや時間の面でも有利です。
タンパク質修飾の目的(化学的手法)
タンパク質修飾の目的は、タンパク質が本来持っていない機能を導入することです。
例えばタンパク質に蛍光物質を導入すれば、細胞内のどこ(核周辺?ミトコンドリア?)にそのタンパク質があるか?を視覚的に捉えられますし、蛍光強度によってタンパク質量を定量することも可能です。
| 機能 | 目的 |
|---|---|
| 蛍光 | 標識、分布、濃度 |
| 放射性 | 標識、分布、濃度 |
| ビオチン | 精製、 |
| PEG | 溶解性・安定性改善、抗原性の低下 |
| アジド・アルキン | 機能性分子の導入、精製 |
| 架橋 | タンパク質間相互作用解析 |
化学修飾はタンパク質の機能を解明するのに役立ちます。
タンパク質修飾の種類を紹介
- アフィニティータグ(生物学的)
- Hisタグ
- GSTタグ
- FLAGタグ
- ビオチン
- 標識
- Haloタグ(クロロアルカンとの結合)
- 蛍光基
- in vivoイメージング
- 放射性同位体標識
- 機能性付与
- PEG鎖
- デリバリー・ターゲッティング (リガンドなどを付与)
- ブロッキング(活性中心のチオール、アミン、ヒドロキシ基などをブロック)
アフィニティータグ
アフィニティータグの多くはペプチドやタンパク質で、生物学的手法を用いて導入されます。
Waugh, David S. “Making the most of affinity tags.” Trends in biotechnology 23.6 (2005): 316-320.
Kimple, Michelle E., Allison L. Brill, and Renee L. Pasker. “Overview of affinity tags for protein purification.” Current protocols in protein science 73.1 (2013): 9-9.
Hisタグ
Hisタグは10個以下程度からなるポリヒスチジン鎖で構成されています。
Hisタグは他と比較してサイズが小さいため、修飾による元のタンパク質への影響が小さいことが特徴です。
Hisタグ(ヒスチジンのイミダゾール)はニッケルなどの金属イオンに対して強い親和性があるため、金属アフィニティークロマトグラフィーを用いたタンパク質精製に用いられています。
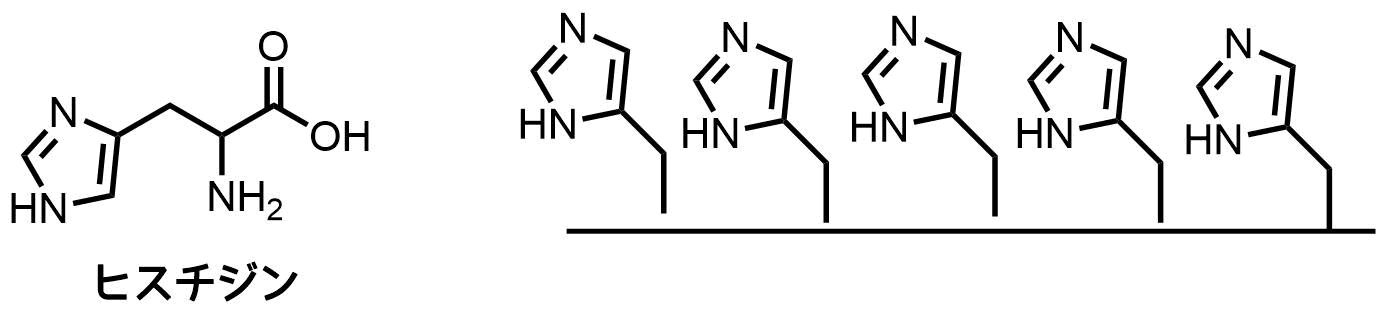
Hisタグを用いた精製は有名ですが、特異性が高くなく、経験上うまくいかないことも多いです。Hisタグがタンパク質内部に埋もれると吸着しにくいので、変性条件で精製を行います。
GSTタグ
GSTはグルタチオン-s-トランスフェラーゼの略でタンパク質精製によく用いられます。
精製にはGSTのリガンドであるグルタチオンを用います。GSTーグルタチオン相互作用の特異性が高いため、高純度なタンパク質が得られます。
欠点は酵素であるGSTはサイズが大きめで、元のタンパク質の性質を変化させやすいことです。そのため、不都合があればGSTタグの除去を行います。
FLAGタグ
FLAGタグはFLAGペプチド(DYKDDDDK)から構成されるもので、アフィニティ精製に用います。酵素であるGSTタグとは違って小さいペプチドであるため元のタンパク質への影響は小さいです。精製は抗FLAG抗体結合担体を用います。
標識(ラベル化)
生体内での動態、分布などを可視化する目的で導入される蛍光標識は代表例です。
化学的ラベル化剤の多くは反応性の高い(求核性の高い)アミノ基やチオール基が標的です。
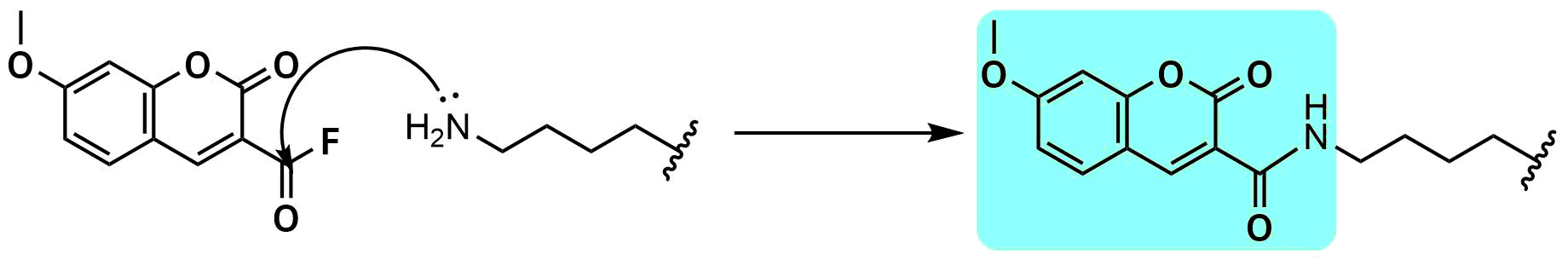
アミンやチオールを標的とする場合、タンパク質に豊富に存在しているため、選択性が低いことが欠点です。
そこで、生体内には存在しないハロアルカン類と特異的に反応するHaloタグを導入し、Haloタグを起点として様々な機能性分子を導入するという手法が有名です。しかし、Haloタグは生物学的手法を用いてタンパク質にあらかじめ導入する必要があります。
Haloタグのようにタンパク質に事前に導入しなくても標識できる化学的手法は有用です。
Haloタグ
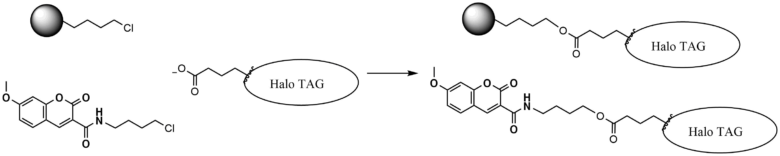
Haloタグはハロアルカンデハロゲナーゼという酵素です。ハロアルカンを有する機能性分子をエステル結合を介して導入することが可能です。Haloタグ自体は生物学的に導入する必要がありますが、クロロアルカンを持つ様々な分子が導入できることがメリットです。
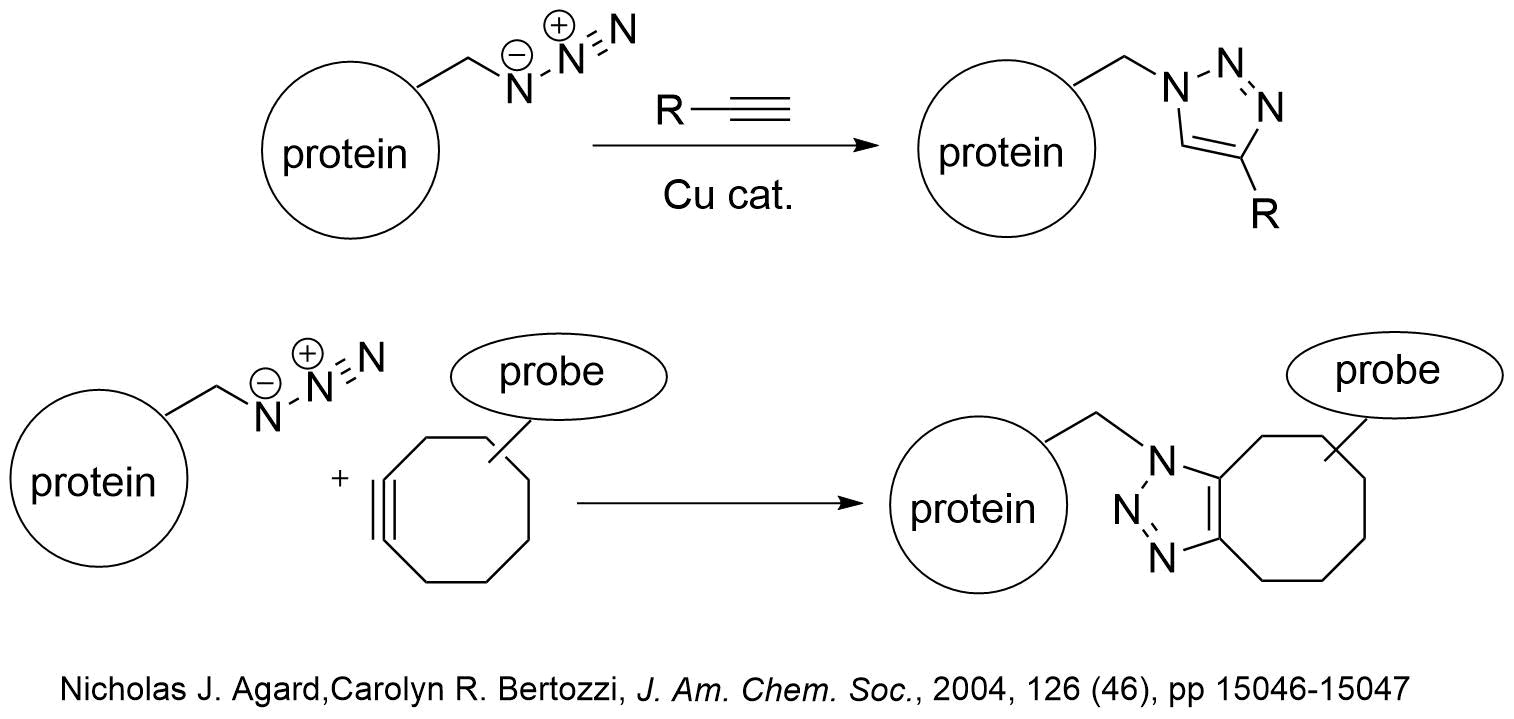
応用例とし、アジドを導入することによりクリック反応に用いたり、切断可能な結合部位を有するハロアルカンビーズを用いてアフィニティ精製を行うなどの応用が可能です。
特にクリック反応は温和な条件下、水中で進行する数少ない有機化学反応ですが、生体に有毒な銅塩の添加が必要です。Bertozziらはシクロオクチンの環歪みを利用した銅塩を用いない方法を開発し、アジド化した糖タンパク質を生きた細胞に発現させて反応を行い蛍光ラベル化に成功しています。
Haloタグは強力な方法ですが,酵素という大きな分子をタンパク質に導入するため、元のタンパク質の機能が損なわれる可能性があります。
Los, Georgyi V., et al. “HaloTag: a novel protein labeling technology for cell imaging and protein analysis.” ACS chemical biology 3.6 (2008): 373-382.
PEG化
PEG(Poly ethylene glycol)鎖は溶解性の悪いタンパク質の溶解性を向上などを目的に導入します。PEG化は毒性も低いことが知られています。
現在上市されている医薬品にもPEG化された医薬品が販売されています。
- レブコビ筋注(PEG化ウシアデノシンデアミナーゼ類縁体)
- レフィキシア静注用(PEG化血液凝固第IX因子)
- ペガシス皮下注(PEG化インターフェロンα)
http://www.nihs.go.jp/dbcb/approved_biologicals.html
PEG鎖導入による効果
- 溶媒中への溶解性向上(水/有機溶媒両方)
- 抗原性の低下
- 安定性の向上(凝集抑制、熱安定性、耐酵素)
- 血中滞留時間の増加
Kumar, Vineet, Vikas K. Sharma, and Devendra S. Kalonia. “Effect of polyols on polyethylene glycol (PEG)-induced precipitation of proteins: Impact on solubility, stability and conformation.” International Journal of Pharmaceutics 366.1-2 (2009): 38-43.
小寺洋, and 稲田祐二. “ポリエチレングリコール (PEG)-タンパク質ハイブリッド.” 高分子論文集 48.5 (1991): 261-276.
化学修飾の課題
修飾による活性低下
活性中心への分子導入は本来の機能を損なう原因となりうる
酵素の活性中心近傍や受容体の結合部位など、活性を示す部位を修飾してしまうとタンパク質が本来もっている機能が失われる可能性があります。活性中心以外でも化学修飾の影響でタンパク質の立体構造に変化が起これば機能は失われてしまいます。
従って化学修飾ではタンパク質の機能を失わない部位選択的に修飾する方法を開発する必要があります。
そのため位置選択的な化学修飾法の研究が盛んに行われています。
活性低下に関わる課題
一般的な化学反応をそのままタンパク質の化学修飾に利用するのは難しいです。
- 水系・室温・中性の温和な化学反応条件
- 位置選択性
- 立体構造の保持
一般的な化学反応では酸・塩基、重金属を用いるため、デリケートな生体やタンパク質にとっては厳しい環境です。また、タンパク質の特定の場所にある官能基のみと反応させることは困難です。位置選択的な化学的修飾法は後から修飾を行うことができるため、生物学的手法に対するアドバンテージにもなります。
水中で進行する化学反応の開発、重金属を含まない有機分子触媒の開発、リガンドやタンパク質立体構造を利用した位置選択的な化学反応の開発などが研究されています。
可逆的な修飾
通常、タンパク質への分子導入は不可逆的な共有結合を介して行われます。
強力な共有結合は、容易に切り離すことはできません。
導入した分子により、元のタンパク質の性質に少なからず影響を与えるため、目的の機能を発揮した後に機能性分子を取り外せる仕組みがあると便利です。
可逆的な結合を介して分子を導入する方法があれば任意のタイミングで修飾した分子を切り離すことができます。
特定の条件下で反応を制御できる可逆的な共有結合(イミン結合、ジスルフィド結合)の利用などが考えられます。
タンパク質を修飾する方法
遺伝子コードラベル化法 (生物学的方法)
遺伝子工学的な方法でタンパク質を導入する方法として最も有名なものは蛍光タンパク質の導入だと思います。
蛍光タンパク質は、遺伝子コードラベル化法といって目的のタンパク質をコードする遺伝子を細菌などに導入し,タンパク質を発現させて得る方法です。
GFPなどの蛍光タンパク質の導入は有用ですが、蛍光タンパク質というだけあってサイズが大きく元のタンパク質の性質を変化させてしまう可能性が高いです。
Haloタグのようにタンパク質を導入する方法以外にも非天然アミノ酸を取り込んで化学反応を行わせる方法も考案されています。この方法ではハロアリール、アジド、アルキン、テトラジンなどを導入することができます。
選択的な有機化学反応を用いる方法
事前に酵素やペプチドを導入することなく、天然のタンパク質が持つ標的アミノ酸に対して選択的な化学反応を起こすことによってタグを導入する方法が研究されています。
ラベル化の標的となるアミノ酸は反応性の高いアミノ基やチオール基を持つリシンやシステインが多いです。
反応剤となる分子は生体には存在しない試薬を利用することで選択性の向上が期待できます(生体直交性)
- ケトン
- アルキン・アルケン
- アジド
システイン残基に対する化学反応を用いた方法
システイン側鎖のチオールとチオエステルが反応し,アシル転移を経て進行するネイティブケミカルライゲーションはタンパク質合成にも使える信頼性の高い強力な方法です。N末端のシステインを標的としてアミドを形成します。
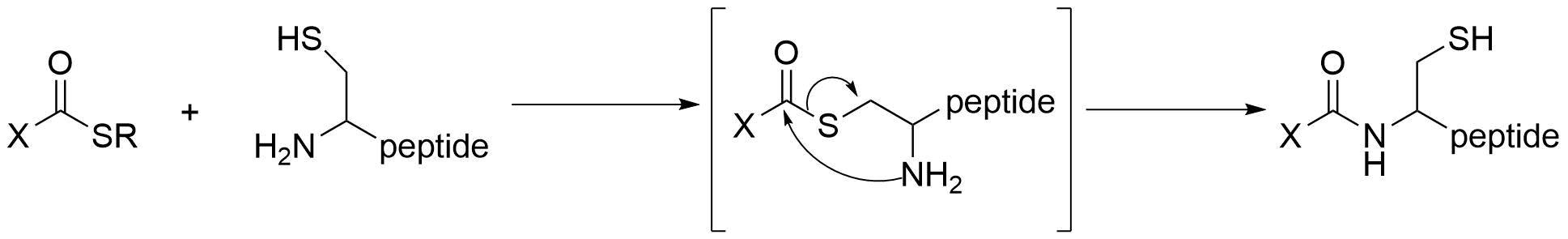
システイン残基に依存するため、システイン残基を持たないタンパク質には当然利用できず、システイン残基が多いタンパク質に対しても選択性が低下します。
一般的に後述するリシンと比べてシステインの存在比率は小さいため、高い選択性を得やすいです。チオール基のソフトな求核性はアミノ基やヒドロキシ基とは異なり、マレイミドなどの炭素求電子剤との反応性が高い点も選択性が向上するポイントの一つです。
チオール基のジスルフィド交換により導入する方法は他の求核性分子の影響を受けないため有用です。
リシン選択的な修飾
リシンは第一級アミノ基を持つアミノ酸で高い求核性があるため化学的修飾の標的となるアミノ酸です。リシンは生体にありふれたアミノ酸であるため、一般的に選択性を出すのは困難で、位置選択的に修飾するにはリガンドなどを用いて狙った反応点に反応試薬を近づけるなどの戦略が必要になります。
リジンは豊富に存在するため、選択性を考慮しない用途、あるいは複数の修飾が必要な場合に適しています。
よく利用されている反応剤はNHSエステル(スクシニジルエステル)等の活性エステル、アルデヒド体との還元的アミノ化反応、イソチオシアネートやイソシアネート使ったウレアの形成などの方法があります。
- 活性エステル法
- 還元的アミノ化
- イソシアネート/イソチオシアネート
リシンの一級アミノ基選択的な反応はこれまでに知られています。

チロシン選択的な修飾
チロシンのフェノールも標的になります。チロシンもシステインと同様にリシンよりも存在量が少ないので選択性の面で有利です。
参考
Naowarojna, Nathchar, et al. “Chemical modifications of proteins and their applications in metalloenzyme studies.” Synthetic and systems biotechnology 6.1 (2021): 32-49.
Sakamoto, Seiji, and Itaru Hamachi. “Recent progress in chemical modification of proteins.” Analytical Sciences (2018): 18R003.
Spicer, Christopher D., and Benjamin G. Davis. “Selective chemical protein modification.” Nature communications 5.1 (2014): 1-14.
Boutureira, Omar, and Gonçalo JL Bernardes. “Advances in chemical protein modification.” Chemical reviews 115.5 (2015): 2174-2195.
治京玉記. “タンパク質の化学修飾法―最近の進歩―.” 中村学園大学薬膳科学研究所研究紀要 3 (2010): 7-32.
QA表:
- Q: タンパク質の化学修飾は何ですか?
A: タンパク質の化学修飾は、酵素や受容体などのタンパク質に化学反応により分子を導入したり部分構造を改変したりすることを指します。 - Q: 遺伝子コードラベル化法とは何ですか?
A: 遺伝子コードラベル化法は、目的のタンパク質をコードする遺伝子を細菌などに導入し、タンパク質を発現させて得る方法です。 - Q: リシン選択的修飾とは何ですか?
A: リシン選択的修飾は、タンパク質のリシン残基(-NH2グループを含む)に対して特定の化学修飾を導入する反応を指します。 - Q: チロシン選択的修飾とは何ですか?
A: チロシン選択的修飾は、タンパク質のチロシン残基(-OHグループを含む)に対して特定の化学修飾を導入する反応を指します。 - Q: 化学修飾の課題は何ですか?
A: 化学修飾の課題は、活性の低下、位置選択性の欠如、立体構造の保持などがあります。
登場する専門用語:
- 遺伝子コードラベル化法
- 有機化学反応
- システイン残基
- リシン選択的修飾
- チロシン選択的修飾
- 立体構造
- 活性低下
- 位置選択性




タンパク質の化学修飾について、丁寧に解説してくださり、ありがとうございます。
記事に大変興味を持ちまして、2点お聞きしたいことができたので、もし回答いただけたら嬉しく思います。
①化学修飾の課題の活性低下の文の上から1-4行目についてなのですが、この文の解釈は、酵素の活性中心近傍や受容体の結合部位を避けたところを狙って修飾しないといけない、という解釈であっていますか。
それを、例えばシステイン残基に対する化学反応を用いた方法で実現する場合は、システインが酵素の活性中心近傍や受容体の結合部位に存在しないタンパク質に対してでないと実現できない、という解釈であっていますか。
また、システイン残基が多いタンパク質であれば、酵素の活性中心近傍や受容体の結合部位にシステインが存在していたとしても、化学修飾の際にそのシステインと反応する確率が減るため、ましなのでしょうか。その場合、酵素の活性中心近傍や受容体の結合部位以外のシステインに特異的に化学修飾させる方法はあるのでしょうか。
②特定のタンパク質の分布を調べる際、生体内に無数にタンパク質がある状態で、目的のタンパク質だけに蛍光分子を導入させ可視化することで分布を調べる、という解釈であっていますか。
その場合、蛍光分子に目的のタンパク質のリガンドをつけることで、目的のタンパク質に特異的に蛍光分子を導入できる、という解釈であっていますか。
例えば、タンパク質の分布を調べようとした際に「システイン残基に対する化学反応を用いた方法」の図の反応を行ってしまうと、N末端にシステインを持つタンパク質は全て標識されてしまう、といった解釈であっていますか。
この反応を、目的のタンパク質のみに特異的に行いたい場合は、そのタンパク質のリガンドに蛍光基と反応基をつけて反応させる、というように、やはりリガンドを用いる必要があるのでしょうか。
タンパク質の化学修飾について、分かりやすく解説してくださり、ありがとうございます。
こちらの記事に大変興味を持ちまして、いくつかお聞きしたいことができたので、回答いただけたら嬉しく思います。
化学修飾の課題の活性低下の文の上から1-4行目についてなのですが、この文の解釈は、酵素の活性中心近傍や受容体の結合部位を避けたところを狙って修飾しないといけない、という解釈であっていますか。
それを、例えばシステイン残基に対する化学反応を用いた方法で実現する場合は、システインが酵素の活性中心近傍や受容体の結合部位に存在しないタンパク質に対してでないと実現できない、という解釈であっていますか。
また、システイン残基が多いタンパク質であれば、酵素の活性中心近傍や受容体の結合部位にシステインが存在していたとしても、化学修飾の際にそのシステインと反応する確率が減るため、ましなのでしょうか。その場合、酵素の活性中心近傍や受容体の結合部位以外のシステインに特異的に化学修飾させる方法はあるのでしょうか。
特定のタンパク質の分布を調べる際、生体内に無数にタンパク質がある状態で、目的のタンパク質だけに蛍光分子を導入させ可視化することで分布を調べる、という解釈であっていますか。
その場合、蛍光分子に目的のタンパク質のリガンドをつけることで、目的のタンパク質に特異的に蛍光分子を導入できる、という解釈であっていますか。
例えば、タンパク質の分布を調べる際に「システイン残基に対する化学反応を用いた方法」の図の反応を用いた場合、N末端にシステインを持つタンパク質は全て標識されてしまう、といった解釈であっていますか。
この反応を、目的のタンパク質のみに特異的に行いたい場合は、そのタンパク質のリガンドに蛍光基と反応基をつけて反応させる、というように、やはりリガンドを用いる必要があるのでしょうか。
一度同じコメントを送信したのですが、ちゃんと送信できているかが分からなかったため、再び送信しました。もし重複して届いていましたら申し訳ありません。
タンパク質の元の機能を保つ必要がなければどこに結合させても問題はないです。また、結合領域周辺であってもリガンドや基質の結合に重要ではないアミノ酸で、修飾後に機能低下が起こらない、あるいは低下のレベルが低い場合は活性中心近傍に修飾を行なっても問題はないと思います。このあたりは化学修飾を行う目的によっても変化します。
> 例えばシステイン残基に対する化学反応を用いた方法で実現する場合は、システインが酵素の活性中心近傍や受容体の結合部位に存在しないタンパク質に対してでないと実現できない、という解釈であっていますか。
活性中心や受容体の結合サイトにシステインがなくても別の部位にシステイン残基があればそこに修飾可能です。ただし、複数のタンパク質(酵素・受容体)存在下で標的タンパク質選択的に修飾する場合、結合領域周辺にシステイン残基があると「リガンドや基質の特異性を利用して近傍のシステイン残基を修飾する」といった手法を利用できます。
>また、システイン残基が多いタンパク質であれば、酵素の活性中心近傍や受容体の結合部位にシステインが存在していたとしても、化学修飾の際にそのシステインと反応する確率が減るため、ましなのでしょうか。その場合、酵素の活性中心近傍や受容体の結合部位以外のシステインに特異的に化学修飾させる方法はあるのでしょうか
修飾の目的によっては完全な選択性が必要ない、求めない場合もあると思います。活性中心のシステインとそれ以外の表面上にあるシステインが存在している場合に表面上のシステインのみに修飾するには工夫が必要で、それは化学修飾の課題の一つです。例えば一般的に活性中心は窪んだ箇所にあるため反応分子がアクセスしにくい環境である場合がありますその場合は反応剤の濃度を調整したり、あるいは立体的に大きい反応剤を利用するなどの工夫で選択性を出すことは可能です。また、阻害剤やリガンドをあらかじめ結合させた状態で修飾反応をするといった方法も有効かもしれません。大抵はある手法が全てのタンパク質に対して応用可能というわけではなく、標的タンパク質によって戦略を考案する必要があり、それが研究になっています。
>特定のタンパク質の分布を調べる際、生体内に無数にタンパク質がある状態で、目的のタンパク質だけに蛍光分子を導入させ可視化することで分布を調べる、という解釈であっていますか。その場合、蛍光分子に目的のタンパク質のリガンドをつけることで、目的のタンパク質に特異的に蛍光分子を導入できる、という解釈であっていますか。
リガンドに蛍光基をつけても特異的(選択的)に蛍光分子を導入できるというわけではありません。受容体のサブタイプや共通のリガンドを持つ受容体の存在があるため、選択性はそのリガンドによって左右されます。また、標的タンパク質特異的なリガンドであっても、非特異的な相互作用によるオフターゲットへの結合が見られます。蛍光基を結合させるなどリガンドを改変すると選択性が低下したり、蛍光基の物性(脂溶性が高いなど)により他のターゲットへの非特異的な結合が増加するといったことが起こり得ます。つまり、リガンドー蛍光基いきなり生体内(細胞)の環境で試すのではなく、少ない範囲のタンパク質を用意した人工的な環境から徐々に広い範囲を試していくというように調べていく必要があります。
>例えば、タンパク質の分布を調べる際に「システイン残基に対する化学反応を用いた方法」の図の反応を用いた場合、N末端にシステインを持つタンパク質は全て標識されてしまう、といった解釈であっていますか。
この反応を、目的のタンパク質のみに特異的に行いたい場合は、そのタンパク質のリガンドに蛍光基と反応基をつけて反応させる、というように、やはりリガンドを用いる必要があるのでしょうか。
はい。そもそもNCLは標識に利用するというよりも長鎖のペプチドを合成する手法として開発されたものですので特定の標的タンパク質を狙うには別の仕掛けが必要です。
リガンドとNCLを組み合わせるのは標的のタンパク質よりけりなのでなんとも言い難いです。NCLに限らず、リガンドを必ずしも用いる必要はないですが、その標的タンパク質だけが持つような特徴を利用する必要はあります。その一つとして受容体であればリガンドを利用することが多いと思います。
タンパク質の化学修飾について、分かりやすく解説してくださり、ありがとうございます。
タンパク質の化学修飾の応用例の一つに不可逆的阻害剤があると思うのですが、それについて質問させてください。
不可逆的阻害剤は、薬に求電子ユニットをくっつけておくことで、薬がタンパク質の活性部位に可逆的に結合した後に、求電子ユニットが、タンパク質中の特定の求核性の残基(システインやリジンなど)と共有結合を形成することで不可逆的にタンパク質を阻害する、という仕組みだと思うのですが、この仕組みについて質問があります。
この薬についている求電子ユニットはなぜ、特定のタンパク質中の特定のアミノ酸残基のみと結合するのでしょうか。色んなタンパク質のアミノ酸残基と結合しないのはなぜでしょうか。
具体例を出すと、Afatinibという不可逆的阻害剤があります。
Afatinibはタンパク質の活性部位に結合したあと、Afatinibのα,β-不飽和アミド部分が、標的タンパク質の797番目のCys残基と特異的に共有結合を形成します。
ここで、なぜ797番目のCys残基のみと特異的に結合を形成できるのでしょうか。
体内で用いる場合、色んなタンパク質が存在し、その中に沢山のシステイン残基が存在すると思うのですが、Afatinibのα,β-不飽和アミド部分は色んなシステイン残基と共有結合を形成してしまうことはないのでしょうか。
長文となってしまい、申し訳ございません。
こちらに関して、もし可能であればご意見をいただけますと幸いです。
お忙しいところ恐縮ですが、どうぞよろしくお願いいたします。
> 薬の求電子部位が他の求核性物質と反応しないのか?
「反応する」というのが回答になります。
必須アミノ酸に限らずグルタチオンなど様々な求核性物質が存在しており、これらが反応しない保証はありません。
> Afatinibの特異性について
Afatinibについて詳しくは存じ上げませんが、こちらも完全に標的Cys残基のみとしか反応しないわけではないと思います。ただし、求電子部位の反応性を絶妙に調整することにより、選択性を向上させていると思います。
一般的に「活性部位への薬の結合がもたらす近接効果、濃縮効果」は選択性向上に利用する戦略の一つです。
化学反応はAとBという物質同士の衝突が不可欠です。薬物の構造により、標的タンパク質の活性部位に結合しやすければたとえ、薄い溶液でも標的物質に対して結合することで、仮想的に濃縮されます(濃縮効果)。また、活性部位に薬がハマった際に求電子部位が標的のシステインSH残基に限りなく近づくように配置することができれば、当然反応は進行しやすくなります(近接効果)。
うまく調整できた薬物は標的選択的に結合します。
選択的とか特異的という表現は定性的であいまいで、低分子か抗体か?あるいは実験条件(動物or人工的な条件)とかによって結構まちまちですので注意してください。度合いは論文を詳しく見るとよいです。
関連する資料
1.「アフィニティラベリングと化学修飾による 活性中心探索とその応用」
https://www.jstage.jst.go.jp/article/kagakutoseibutsu1962/30/8/30_8_514/_pdf
2.胞内の狙った天然タンパク質を迅速に化学修飾する分子技術を開発
https://www.kyoto-u.ac.jp/sites/default/files/embed/jaresearchresearch_results2018documents180514_101.pd
興味深い記事をありがとうございます。
もし可能であれば、次の4点についてお伺いしたいです。
①「システイン残基に対する化学反応を用いた方法」のところで、「一般的に後述するリシンと比べてシステインの存在比率は小さいため、高い選択性を得やすい」とありますが、
Cysを持つタンパク質はかなり多いと思っていたのですが、どうでしょうか。
それとも、リジンと比較すると存在比率が少ないだけ、ということでしょうか。
② ①と関連して、システインを持たない蛋白質、などはあったりしますか。キシラナーゼなどがそれにあたるのでしょうか。
③タンパク質中に存在するシステインは、他のタンパク質中のチオール基とジスルフィドを形成していることが多いか、それともチオール基が遊離している場合が多いのかを、もしご存知であればお伺いしたいです。
④同じく「システイン残基に対する化学反応を用いた方法」のところで、N末端にシステインを持つ「ペプチド」を標的とした反応を紹介されていますが、
N末端にCysを持ち、かつそのCysのアミノ基がフリー(保護されていない)の状態の「タンパク質」、などはあったりしますか?
開始コドンはメチオニンなので、基本は蛋白質のN末端はメチオニンになってしまうのでは?と思ったのですが、上記の内容について、ご存じであればお聞きしたいです。
(https://www.tmig.or.jp/J_TMIG/genome300/PRDX%20family.html
一例として、このサイトを見て、こちらのペルオキシドレンファミリーは、N末端にシステインを持っていそう?な感じがしたのですが、どう感じますか。またN末端のシステインはフリーの状態なのでしょうか。)
(また、このペルオキシレドキシン蛋白質は脳梗塞における炎症惹起因子だそうなのですが、ペルオキシレドキシン蛋白質に対する薬、などはあるのでしょうか。)
長文となり、申し訳ございません。
自分で調べてはいるのですが苦戦しており、もしわかるところがあれば教えていただけますと幸いです。
どうぞよろしくお願いいたします。
1. システインの存在比率はタンパク質によってことなります。システインは一般的には少ないと言われています。リシンよりもシステインが多いタンパク質もあるかもしれません。(ただし、チオールは不安定ですぐジスルフィドを形成して立体構造に影響を与えるのでたくさんあるタンパク質は少なそうな気がします。)
2. タンパク質は巨大な分子であるため大きい分子量のタンパク質であれば大体一つ以上はシステインがあると思います。
小さいタンパク質やサブユニット単位ではあるかもしれませんhttps://www.aist.go.jp/aist_j/new_research/2008/nr20081027/nr20081027.html
3.一般的にジスルフィドを形成しているイメージがありますが、それを直接調べたことは無くわかりません。
化学的、実験的にはフリーでは存在していなさそうな気がします。
4.開始コドンでみればメチオニンがN末端にきますが、絶対ではありません。原核生物やウイルスでは開始コドンが異なることがある点と、たんぱく質は翻訳後にプロセシングという過程で変換を受けます。例えばメチオニンアミノペプチダーゼ(MAP)によってN末端のメチオニンが除去されて別のアミノ酸がN末端になる例はあります。https://kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-04680162/
ペルオキシドレンをターゲットにした医薬品が上市されている例は私が知っている限りではないと思いますが、ターゲットとして研究されている例は脳梗塞に限らず多くあるようです。