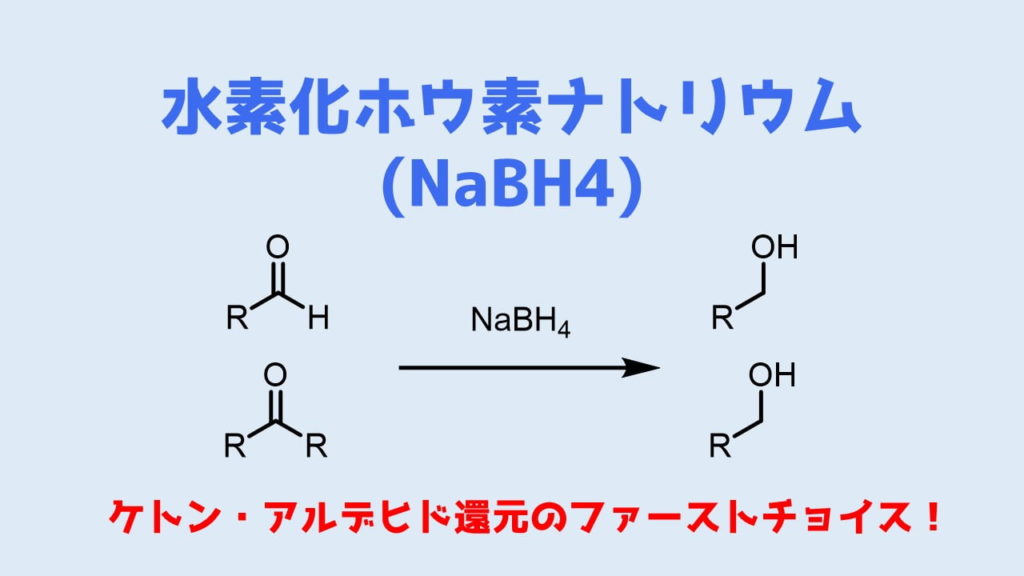
・水素化ホウ素ナトリウム (NaBH4)は代表的なヒドリド還元剤
・アルデヒドやケトンを還元
・ニトロ基や芳香族ハロゲン、ニトリルは還元しない
水素化ホウ素ナトリウム(NaBH4)とは?
NaBH4はホウ素の化学で有名で、ノーベル化学賞を受賞したブラウンによって発見されました。
水素化ホウ素ナトリウムはケトンおよびアルデヒドを選択的に還元する試薬としてよく利用されます。
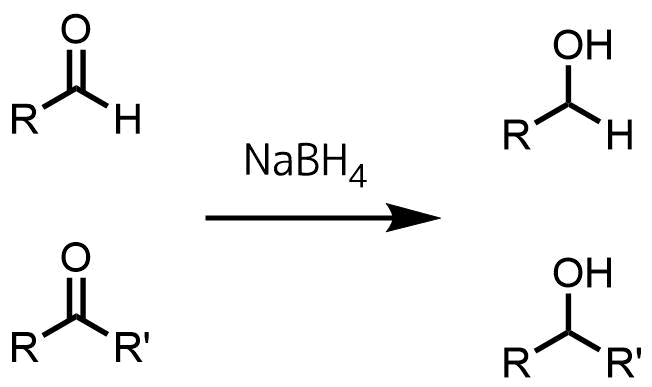
ケトンとアルデヒドをアルコールに還元
NaBH4はLiAlH4のようにアミドやニトロ基などを還元しないため、より選択性が高いです。
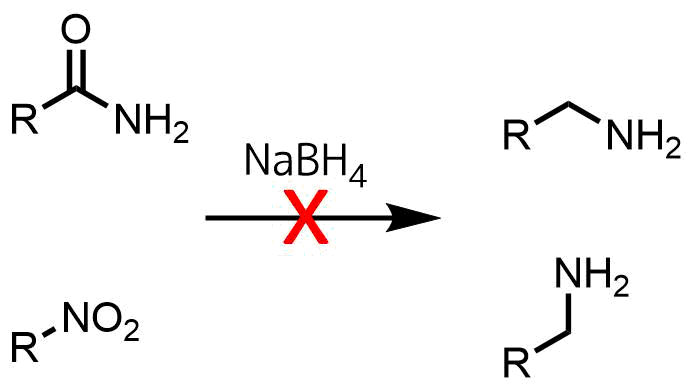
アミドとニトロは還元しない
そのため水素化ホウ素ナトリウムはアルデヒド、ケトンの還元のFirst choiceとして利用されています。
水素化ホウ素ナトリウムの利点
- 取り扱いやすい
LAHと比べて火が出ることがなく取り扱いやすいですが、水と接触すると分解します。
デシケーターなどに保管し、湿気は避けるようにします。
- 低コスト
価格も安いので大スケールの実験にも使いやすいです。
- アルコール中での反応が可能
エタノールなどのアルコールを溶媒として利用することも可能です。
水素化ホウ素ナトリウムを用いた反応
NaBH4による還元は二重結合、カルボキシ基、ニトリル基、エステルには影響せずにアルデヒドやケトンを選択的に還元できます。
水素化ホウ素ナトリウムによって還元されない官能基
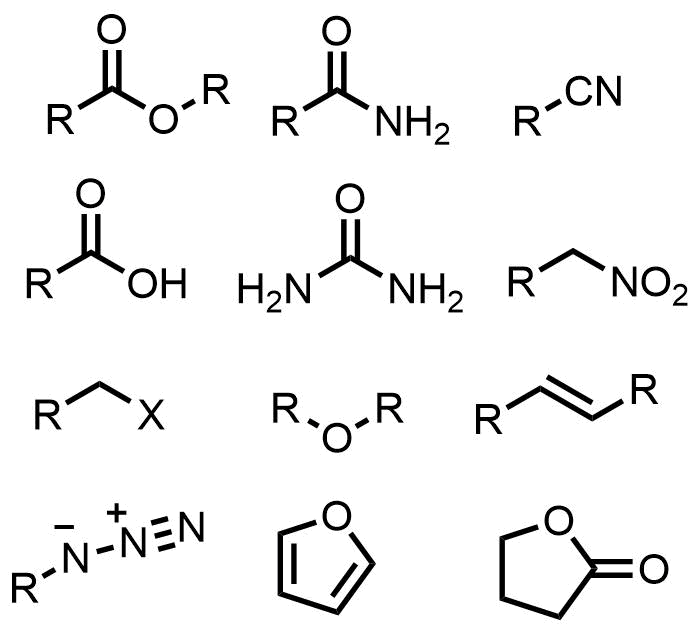
NaBH4で還元されない官能基たち
- エステル
- アミド
- ニトリル
- カルボン酸
- ウレア
- ニトロ基
- 炭素ーハロゲン
- エーテル
- アルケン
- アジド
- フラン
- ラクトン
他のヒドリド還元剤と比べた利点は、エステルやニトロ基、アリールハライドなどが還元されない点です。
水素化ホウ素ナトリウムで還元される官能基
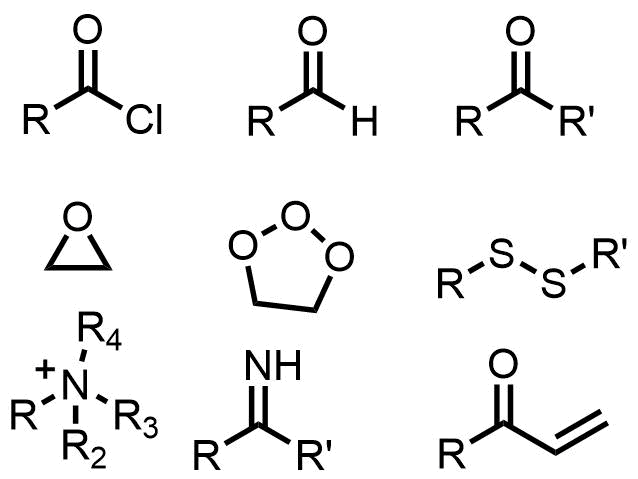
NaBH4で還元される官能基たち
- 酸塩化物
- アルデヒド
- ケトン
- エポキシ
- オゾニド
- ジスルフィド
- 第四級アンモニウム塩
- イミン (還元的アミノ化)
- 不飽和カルボニルのオレフィン
水素化ホウ素ナトリウムによってアルコール、アミン、チオールに還元されます。
酸塩化物を水素化ホウ素ナトリウムで還元して第一級アルコールを得る
反応性の高い酸塩化物は容易に還元を受けて第一級アルコールを生じます。
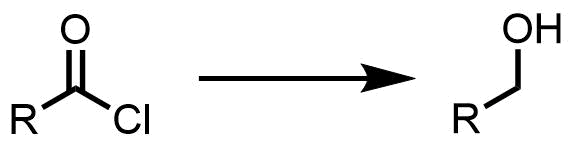
酸塩化物が第一級アルコールに還元
カルボン酸は還元しにくいため、カルボン酸のまま、あるいはエステルに変換した後に反応性の高いLiAlH4で還元する方法があります。
NaBH4を使用してアルコールに変換するには酸塩化物を経由します。カルボン酸は塩化チオニルで酸塩化物に変換可能です。これをNaBH4で還元すると第一級アルコールが得られます。
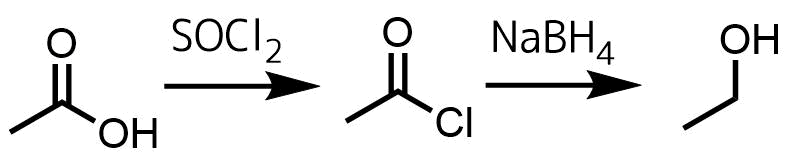
カルボン酸をアルコールに変換
水素化ホウ素ナトリウムの反応機構
水素化ホウ素ナトリウムの反応はNaBH4のヒドリドの攻撃で始まります。ホウ素に4分子のケトンが攻撃した形(下段)も考えられます。ワークアップしてプロトン化すればアルコールができます。
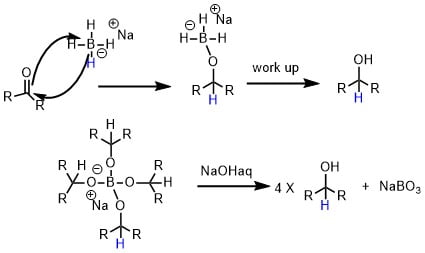
水素化ホウ素ナトリウムの反応
溶媒はメタノール、THF、シクロロメタン、トルエン、アセトニトリル中などで行います。
メタノールはNaBH4と反応するので注意が必要です。また、エーテル系溶媒への溶解性は悪いです。
反応温度は0℃~室温で反応させます。
カルボニルの還元
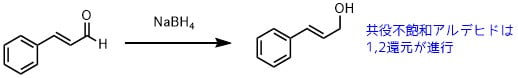
NaBH4はシンナムアルデヒドの二重結合を還元することなくカルボニルを選択的に還元します。
ベンゼン環と共役していないαβ不飽和ケトン・アルデヒドは二重結合も還元されるため、1,2還元を選択的に反応させたい場合はルーシェ還元を利用しましょう(塩化セリウム・CeCl3を加えて還元する方法)。

ベンゾフェノン類の還元はMPV還元(ケトンの還元法)よりもNaBH4の方が収率が良いです。逆にNaBH4で他の官能基が侵されるような状態ではMPV還元を利用すると改善することがあります。
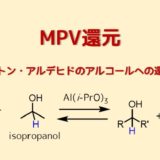
ハロゲン類の還元
芳香族ハロゲン、ベンジルハライドなどのハロゲン類はカルボニル類などと比べると反応が遅いため、通常カルボニル選択的に還元反応が進行します。
一方で非プロトン性極性溶媒(DMSO)等を用いるとハロゲンの還元が進行することが報告されています。
NaBH4を使った実験例1
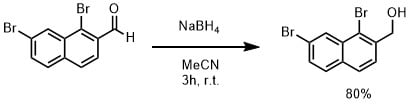
アルデヒド(1mmol)水素化ホウ素ナトリウム(2eq)、アセトニトリル(5mL)に加えて室温で3時間撹拌。水 / 酢酸エチルで抽出し、カラム精製により目的物を80%で得た( Josa-Cullere, Laia et al Synlett, 27(11), 1677-1681; 2016より引用)。
アセトニトリル中で芳香族アルデヒドを還元する場合は、芳香族ハロゲンは還元されずにアルデヒドのみを還元できます。反応も数時間で終了します。
小技やコツなど
過剰なNaBH4の処理
原料に対して多めの試薬を加えるので水素化ホウ素ナトリウムが余ることが多いです。これらはクエンチ時に加える水で分解できますが、より早く分解したい場合は酸性水溶液(酢酸等)を使います。水酸化ナトリウムなど塩基性溶液にすることもあります。
生成物と錯体形成する場合
アルコールやアミンを多く含む化合物はホウ素と錯体を形成してしまうことがあります。HCl-メタノールを加えて加熱するとホウ酸メチル(揮発性)が生成して簡単に分離できますが、酸性に基質では注意しましょう。
エステルの還元がTHF-MeOH or tBuOH-MeOHで可能
一般的にNaBH4ではエステルは還元できず、LiAlH4やLiBH4、DIBAL、Red-Alを利用することが多いですが、THFおよびt-BuOH還流下MeOH(20%vol)を1時間かけてゆっくり滴下する方法で還元するとエステル及びラクトンを高収率でアルコールに還元できます。温和で官能基選択性が高くエステル選択的な還元におすすめです。
1) Soai, Kenso, et al. “Practical procedure for the chemoselective reduction of esters by sodium borohydride. Effect of the slow addition of methanol.” Bulletin of the Chemical Society of Japan 57.7 (1984): 1948-1953.2) 三合憲三. “混合溶媒を用いる水素化ホウ素ナトリウムおよび水素化ホウ素リチウムによる官能基選択的還元.” 有機合成化学協会誌 45.12 (1987): 1148-1156.
特にトリエステルなどポリオールのエステルの還元はLiAlH4よりも収率よく得られます。アセチル基の除去も酸やNH3を用いるものよりも選択的かつ高収率です。
この条件で還元される官能基はエポキシ、ジアリールスルフィド、アジド、酸無水物などです。


大変わかりやすい記事でした。
錯体形成時のHCl-MeOHでの加熱処理に関する参考文献などがあればありがたいです。