炭素酸 (carbon acid)は炭素と水素の結合にもかかわらず、酸性度が高く、脱プロトン化可能な化合物の総称です。
通常は炭素と水素結合は強固で外れにくいですが、共鳴や誘起効果などの影響で酸性度が高くなっていて外れるようになります。
炭素酸とは?
炭素酸は炭素に結合した酸性度の高いプロトンを持っている炭素化合物のことです。
とはいえ、塩化水素(HCl)や酢酸のように自発的に脱プロトン化するほど酸性は高くないものが多いです。
一方で、ある程度の強さの塩基を使えば、炭素酸の水素を引き抜ける程度の酸性度は持っています。
炭素酸の例として代表的なものはアセチルアセトンなどの1,3-ジケトンで、メチレンの水素を引き抜きによって生成するカルボアニオンは求核性が有るため求電子剤と反応します。これらの反応は炭素ー炭素結合形成に重要です。
炭素酸の強さの順番(酸性度の高さの順番)やその理由などはよくテストなどでも出題される問題なので、おさえておきましょう。
炭素酸の酸性度が上がる原因
普通のアルカン(メタンやヘキサン)などが酸性ではないのは周知の通りだと思います。また、芳香族のベンゼンの水素も簡単には外れそうにも無いです。一体どんな条件が揃えば炭素に結合する水素の酸性度は上昇するのでしょうか?
炭素酸と呼ばれうるパターンはある程度決まっています。
- S性の高さ (多重結合ほど酸性度が高い:アセチレンなど)
- 誘起効果によるアニオン安定化(クロロホルムなど)
- 共鳴によるアニオンの非局在安定化 (プロピレンなど、アセトンなど電気陰性原子がついているとより酸性度があがる)
です。
炭素酸の一覧表 酸性度の高い順番 (pKa)
炭素酸のpKaは置換基や構造によって大きく変化します。電子吸引性の高い置換基が結合した炭素ー水素結合の酸性度は高くなります。
シアノホルムは電子吸引性の高いシアノ基が3つも結合した化合物でそのpKaは-5と硝酸(pka=-1.3)、塩酸(pKa=-7.0)と身近な強酸と同じくらいの酸性度の強さを誇っています。このシアノホルムは実は2010年に合成した論文が発表されています1)。非常に不安定な物質のようですが、炭素酸でもこんなに強い酸が存在します。
より電子吸引性の高いニトロ基で置換されたトリニトロメタンのほうがpKaが大きいのは、ニトロ基同士が同一平面上に並ばずにねじれることで共鳴が阻害されるためでしょうかね?
| 名前 | pKa | 構造式 |
| シアノホルム | -5 | 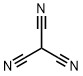 |
| トリニトロメタン | 0.2 | |
| ニトロエテン | 3.6 | 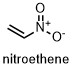 |
| ジメドン | 4.8 | 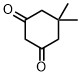 |
| メルドラム酸 | 5.1 | 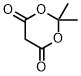 |
| オルトギ酸トリメチル | 5.86 | 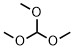 |
| アセチルアセトン | 9.0 | |
| シアン化水素 | 9.2 | |
| ニトロメタン | 10.2 | |
| アセト酢酸エステル | 10.2 | |
| マロノニトリル | 11.2 | |
| マロン酸ジエチル | 13.5 | |
| シクロペンタジエン | 15 | |
| クロロホルム | 15.5 | |
| アセトン | 20 | |
| アセトニトリル | 25 | |
| アセチレン | 25 | |
| トリフェニルメタン | 29 | 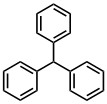 |
| プロピレン | 38 | |
| トルエン | 39 | |
| エチレン | 44 | |
| メタン | 48 | 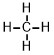 |
| ノルマルブタン | 50 | |
| tert-ブタン | 53 |
比較用に一般的な酸のpKaを載せます。
| 物質名 | pKa |
| 塩酸 | -7.0 |
| 硫酸 | -3.0 |
| 硝酸 | -1.3 |
| トリフルオロ酢酸(TFA) | -0.25 |
| 炭酸(1) | 3.6 |
| 酢酸 | 4.75 |
| 塩化アンモニウム | 9.24 |
| フェノール | 9.82 |
| 水 | 15.7 |
環状のジメドンやメルドラム酸は酢酸に匹敵する酸性度なので、結構酸性度が高いことが想像できます。
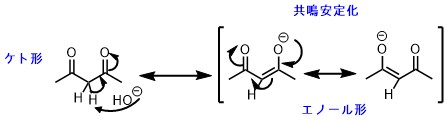
ジケトン類(アセチルアセトンやマロン酸ジメチルなど)も有名な炭素酸ですが、酸性度は普通のアルカン類などと比べて断然高くなっています。これらはカルボニルの電子吸引性によるものと、2つのケトン間の共鳴による安定化が働いていると考えられます。
1)ŠIŠAK, Dubravka, et al. Chem. Eur. J. 16, 2010, 7224-7230