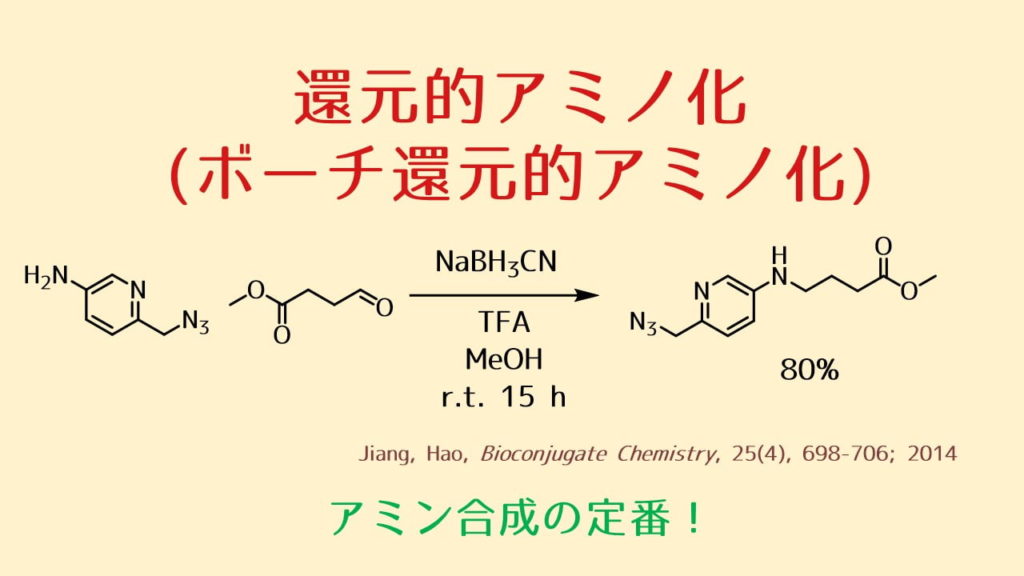
還元的アミノ化はアルデヒドとアミンにより生成するイミンを還元してアミンを得る反応です。特に水素化シアノホウ素ナトリウムによってアミンを得る方法をボーチ反応(ボーチ還元的アミノ化)と呼びます。
還元的アミノ化反応とは?
還元的アミノ化とは「アルデヒドやケトンとアミンとで生成するイミンを還元することによってアミンに変換する反応」であり、アミン合成法の中でも最も有名な反応の一つです。
脂肪族アミン合成をWilliamsonエーテル合成のようにアミンとハロゲン化アルキルとの求核置換反応(SN2反応)で得ようとすると、生成するアミンが更にアルキル化する連鎖反応が起きてしまいます。第四級アンモニウム塩が生成することもあります。
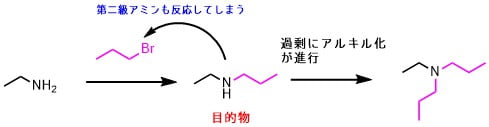
ここで登場するのが還元的アミノ化です。
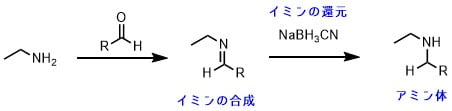
還元的アミノ化反応では、アルデヒド(ケトン)とアミンとの間でまずイミンを生成させます。次に生成したイミンを還元してアミンを得ます。
このようにイミンを作ってから還元させれば、過剰なアルキル化は起こりません。
一方で嵩高いケトンやアミンなど、立体障害が原因でイミンが生成しにくい場合は、還元的アミノ化でアミンを合成するのは難しいです。
還元的アミノ化の反応条件
還元的アミノ化に利用する還元剤は水素化シアノホウ素ナトリウムが一般的であり、この試薬を使った還元的アミノ化反応を「ボーチ還元」といいます。
しかし、水素化ホウ素ナトリウムは、シアン化水素を発生するため危険で、劇毒指定もされているので代替品の利用も進んでいます。
水素化トリアセトキホウ素ナトリウム(NaBH(OAc)3)は毒性が少ない還元剤として、還元的アミノ化反応によく利用されます。水素化シアノホウ素ナトリウムと同様の使い方ができます。
NaBH(OAc)3の欠点は、水や酸によって分解されやすいことです。水で分解・失活することから、長期保存には向かず下のピコリンボランの方が有用性が高いかもしれません。
ピコリンボランやピリジンボランも同様に還元的アミノ化反応における還元剤として利用されています。特に2-ピコリンボランは安定で長期間保存しても分解しにくいのが利点です。2-ピコリンボランは、ピリジンボランと比べて熱的に安定であり爆発の危険が無く、さらに酸性条件下で安定で、水中における安定性も高いのが特徴です。価格もそこまで高くないので使いやすいです。
水素化トリアセトキホウ素ナトリウムを使った条件
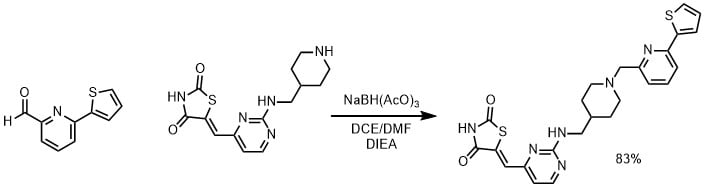
アミン体(0.115mmol)、DCE(2mL)、DIPEA(6当量0.690mmol)、DMF(1mL)、アルデヒド(1当量、0.115mmol)を加えて室温で1時間撹拌した。、続いてNaBH(AcO)3(2.5当量、0.230mmol)を加えて室温で16時間撹拌した。DCE(2mL)、NaHCO3 (2mL)で希釈し、抽出し、HPLCで生成して目的物を83%の収率で得た。(Baldino, Barmen M. et al US20110152235より引用)
酸を加えていないので、イミン形成のために1時間ほど撹拌しています。その後還元剤を加えてイミンを還元してアミンとしています。
水素化シアノホウ素ナトリウムによる還元的アミノ化
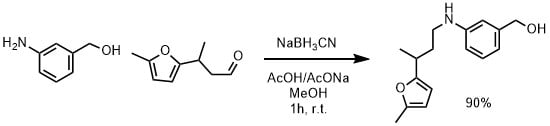
0℃でMeOH(10mL)、アニリン(1mmol)の溶液として、NaOAc(2当量)、酢酸(4当量)、アルデヒド(1.5当量)NaCNBH 3(1.1当量)を加えてゆっくりと室温に温めながら1時間撹拌した。シリカゲルパッドでろ過し、1%酢酸/酢酸エチルで洗浄した。ろ液を食塩水で洗浄し、濃縮、カラム精製して目的物を90%の収率で得た。(Mukhina, Olga A. et al Journal of Organic Chemistry, 79(22), 10956-10971; 2014 より引用)
酸性条件でも使用できる水素化シアノホウ素ナトリウムでは酢酸を加えてイミン形成を促進させます。
2-ピコリンボランを用いた還元的アミノ化
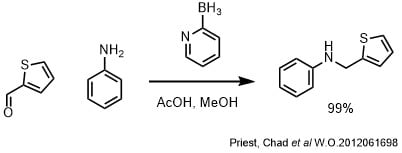
0℃でアニリン(3.0g、30mmol)、チオフェン−2−カルバルデヒド(3.4g、30mmol)をメタノール:酢酸(30.0ml、10:1)に加えて、ピコリンボラン錯体(3.2g、30mmol)を加えた。氷浴を外し、開放系で室温で一晩撹拌した。濃縮後、0℃に冷却して、10%HCl(150mL)を加えて室温で2時間撹拌した。水酸化ナトリウム水溶液を加えてアルカリ性にし、水層をDCMで抽出、後処理してカラムで精製して目的物を99%での収率で得た。
2-ピコリンボランは酸にも安定なので酢酸条件下で還元的アミノ化を行えます。収率も良好です。
還元的アミノ化反応の反応機構
還元的アミノ化はまずイミンの生成、そしてそれに続くイミンの還元からなっています。
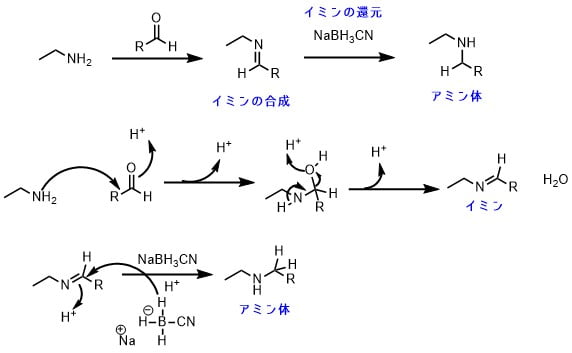
アミンがカルボニル基に求核付加反応して、脱水してイミンを生じます。そのイミンに対してヒドリド還元剤が還元反応を行って、アミンが生成します。
第一、第二級アミンの求核性はどっちが高い?
余談ですが、第一、第二級アミンの求核性については一般的に第二級アミンのほうが求核性が高いと言われていますが実際はどうなんでしょうか?調べてみました。
アミンの塩基性についてはアンモニア<エチルアミン<ジエチルアミンの順番に強くなります。一方の求核性についてですが、これは溶媒効果によって変わるようです。
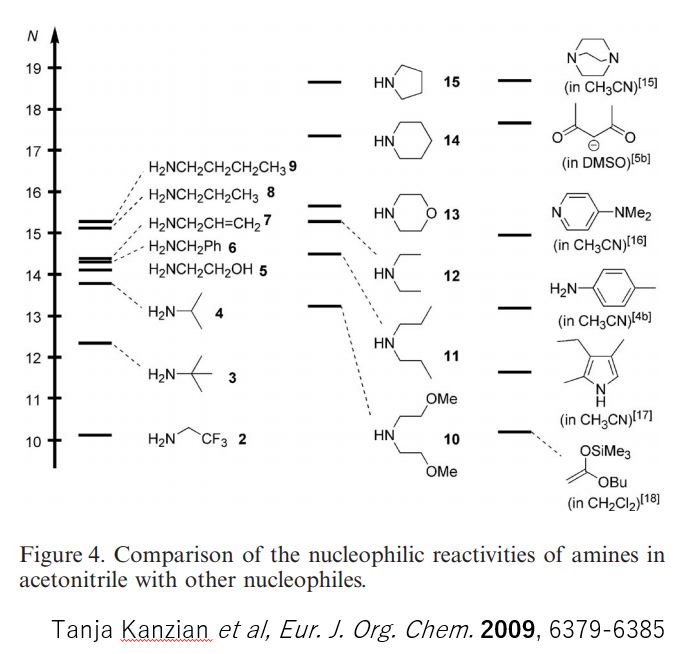
下の図は第一第二級アミンのアセトニトリル中における求核性の強さを測定して、求核性の強さの順番に並べた図です。
アセトニトリル中における第一、第二級アミンの求核性の違い 論文より引用
見にくいですが、ジプロピルアミンよりも第一級のプロピルアミンの方が求核性が高い結果が得られています。
この研究で、アミンのpKaHと求核性の相関関係が乏しいことがわかりました。さらにアミンの求核性は溶媒効果を強く受けるようです。例えば、アニリンはアセトニトリル中よりも水中でベンズヒドリリウムイオンと約2倍速く反応します。一方で第一級アルキルアミンは水中よりもアセトニトリル中で10倍以上速く反応します。これまで(Brotzel, Frank, et al,. “Nucleophilicities of primary and secondary amines in water.” J. Org. Chem., 72.10 (2007): 3679-3688.)で報告されていた水中におけるアミンの求核性(NH3<tBuNH2<<iPrNH2< EtNH2<PhNH2<MeNH2<Et2NH<<<Me2NH<pyroridine)の順となっており、二級アミンのほうが水中では求核性が高いという結果となっていて、先の論文で得られた結果とは異なっています。これはアミンの求核性が溶媒効果に左右されることが原因であると考えられています。
還元的アミノ化では二級アミンのほうが早いというよりも同じくらいだから第三級アミンも生成してしまうと考えたほうが正確なのかもしれません。