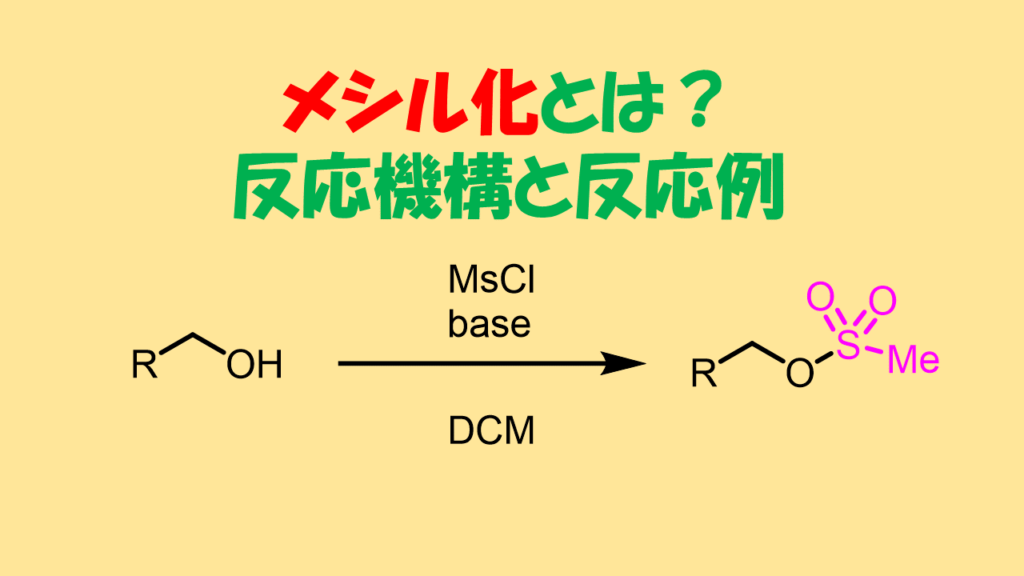
アルコールのメシル化(Ms基)により脱離能を上げる
メタンスルホニル基(Methansulfonyl group:Ms)の慣用名をメシル基と呼びます。
アルコールをメタンスルホニルクロライド(MsCl)と反応させると、スルホナートになります(メシル化)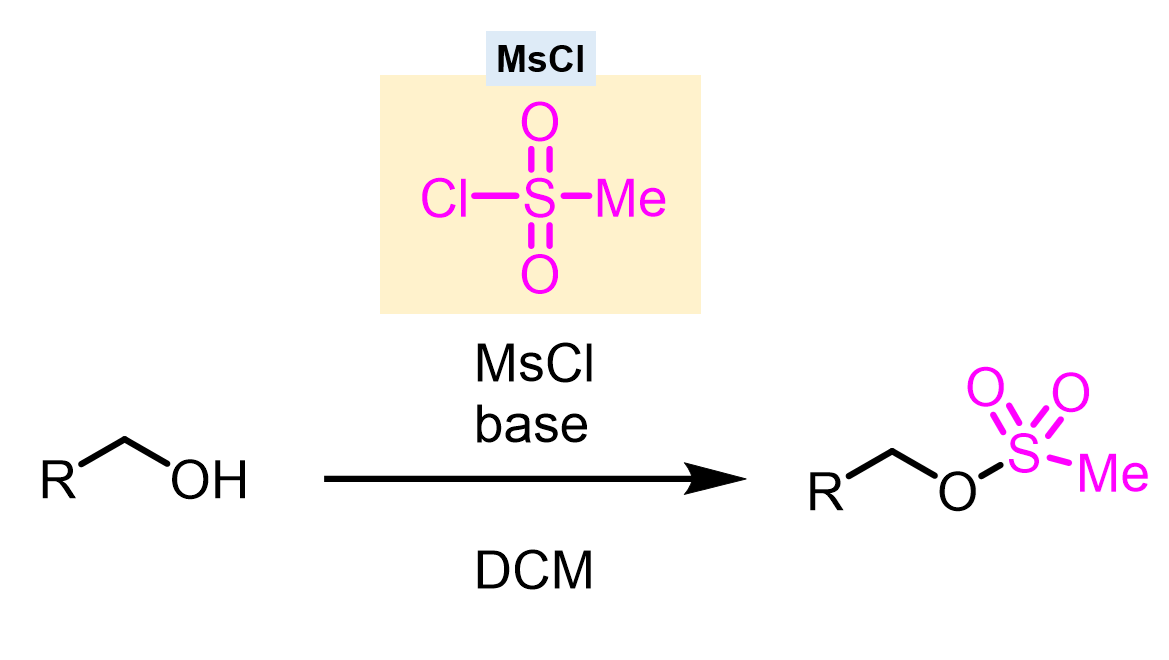 生成したメタンスルホン酸エステル(メシレート)はアルコキシ基(R-O)と比べて脱離しやすいため、容易に求核剤と反応して置換体が生成します。
生成したメタンスルホン酸エステル(メシレート)はアルコキシ基(R-O)と比べて脱離しやすいため、容易に求核剤と反応して置換体が生成します。
メシル基の脱離能が高いのはスルホナートアニオンが非常に安定だからです。
これは水のpKa15.7と比べてメタンスルホン酸のpKaが-2.6と非常に強い酸であることからも明らかです。
メタンスルホニル基の酸素原子上でアニオンが分散するため、アニオンが安定化されている⇨アニオンとして存在しようとします。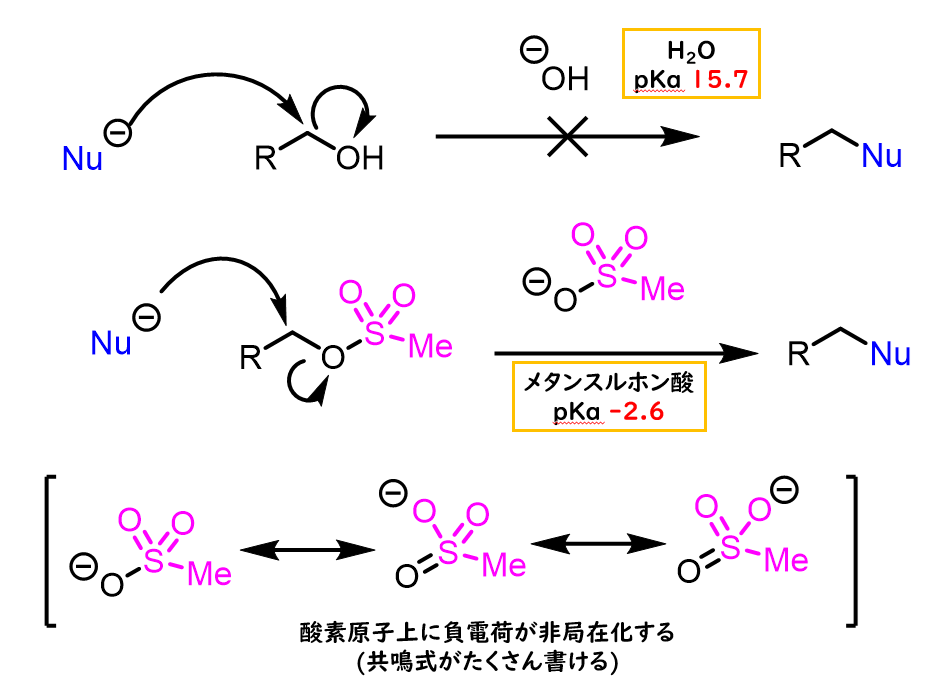 したがってメシル化は、脱離能の低いアルコールの脱離能を上げるために利用されます。
したがってメシル化は、脱離能の低いアルコールの脱離能を上げるために利用されます。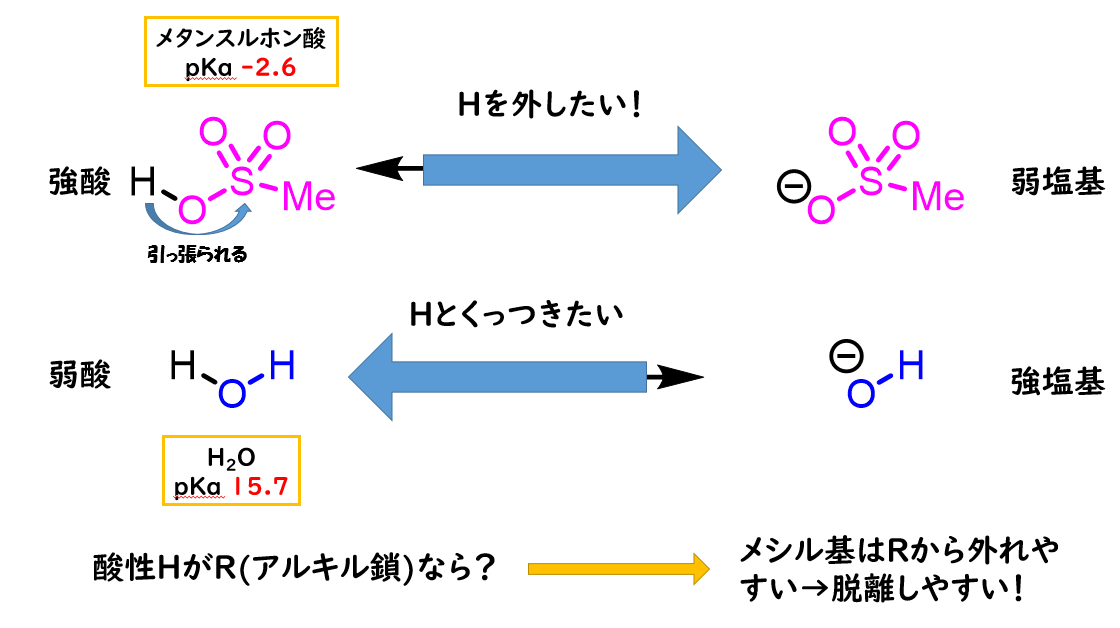 脱離能を上げる用途に使用するものはメシル基の他に
脱離能を上げる用途に使用するものはメシル基の他に
- スルホン酸系
- トシル基(Ts)
- トリフルオロメタンスルホン酸(トリフリル基:Tf)
- ハロゲン(臭素やヨウ素)
などがあります。
これらは共役アニオンの安定性が高く脱離しやすい点が共通しています。
フェノールの保護基として利用。
これまで紹介してきたように、脂肪族アルコールのスルホン酸エステルは脱離しやすいため、求核置換反応が進行します。
一方で芳香族アルコールのスルホン酸エステルは求核置換反応は進行しにくいため、フェノールに対してはスルホニル系の保護基として利用可能です。
メシル基の特徴・利点
メシル基の利点は
- 簡便に脱離基に変換できる
- 副生成物が分液で除去可能
- 立体障害の大きいアルコールに適用可
- 原料が安価
メシル化反応で生じる副生成物は分液で除去可能です。特別な精製をせずに次の反応に利用可能です。また、手早くやればカラム精製も可能です。
同じ脱離基であるトシル基と比べて立体障害が小さいので、嵩高いアルコールでも導入しやすい点もポイントです。
メシルクロライドも比較的安定で扱いやすいです。強酸あるいは分離精製が煩雑なAppel反応を用いたハロゲン化と比べると使いやすいと思います。
メシル化反応に伴う注意事項
メタンスルホニルクロライドは毒物指定されてしまいました。毒物は毒性と管理が煩雑なので積極的には利用しにくいですね。
メシル化の過程でアルコールが塩素化してしまうことがあります。
メシル化の反応機構
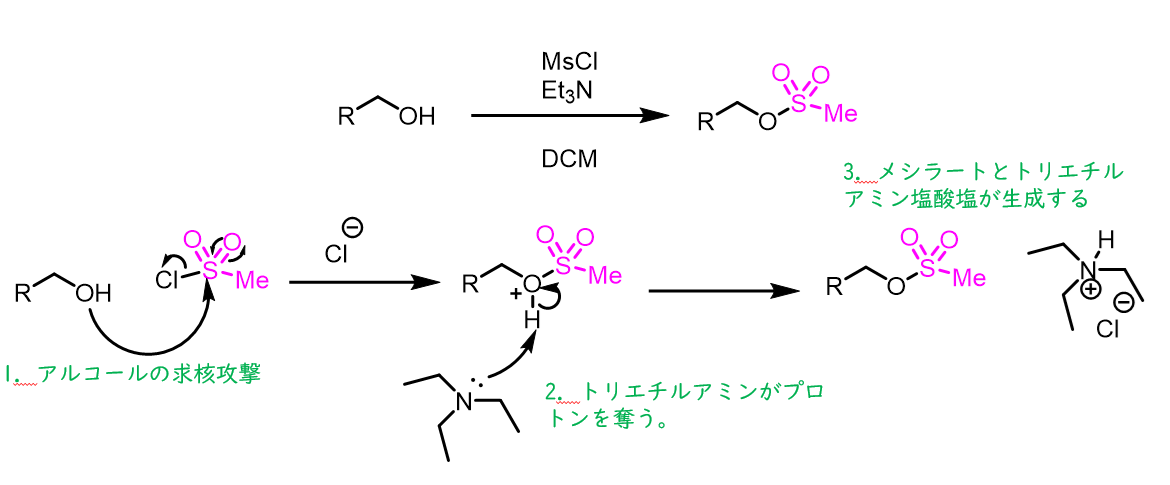
反応機構は単純です。メシル化で使用する塩基はトリエチルアミンやピリジン等の弱めの塩基であるため、アルコールのプロトンを奪ってアルコキシドが生成するーというよりも反応後のプロトンを奪っていると考えられます。
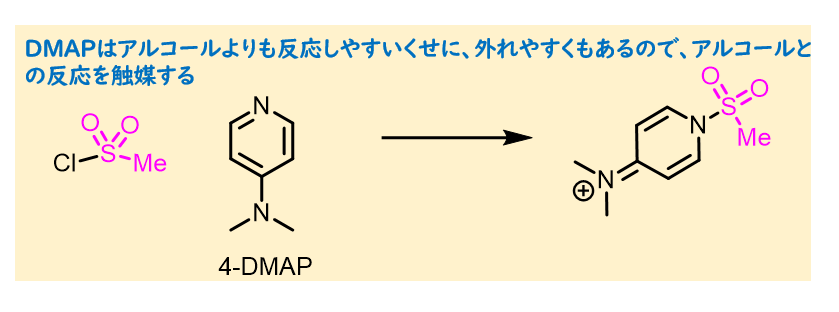 DMAPは反応触媒として加えることがあります。これは、DMAPがMsClと反応して生成する中間体が反応性を向上させていると考えられます。
DMAPは反応触媒として加えることがあります。これは、DMAPがMsClと反応して生成する中間体が反応性を向上させていると考えられます。
メシル化の反応条件
メシル化反応は単純で、アルコールと塩基(トリエチルアミンやピリジン)を適当な溶媒に溶かして、メシルクロライド(MsCl)を冷却して滴下させる方法で合成します。
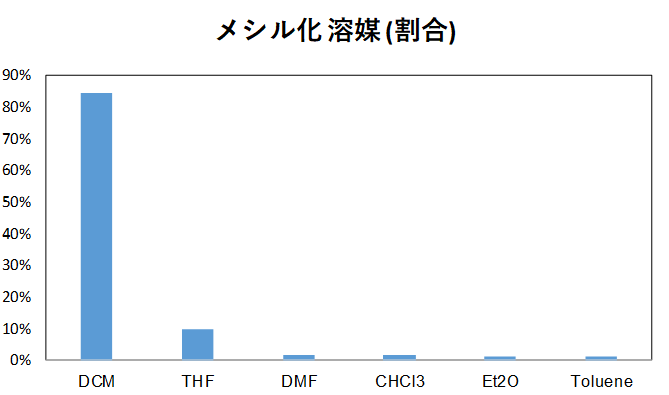
個人的な調査(参考程度)によると使用する溶媒は圧倒的にジクロロメタンが多いです。次いでTHFが多いですね。塩基もトリエチルアミンが多いですね。

田辺法?と呼ばれているメシル化(トシル化)方法を紹介します。この方法はピリジンを使わないでトリエチルアミン(1.5eq)を使って、トリメチルアミン塩酸塩(0.1 eq)も触媒量加えると反応が早くて副反応も起きにくい手法です。
Tetrahedron, 1999, 55, 2183-2192. or patent.JP2000219669A
ピリジンは塩基として用いないほうが良い? ピリジン塩酸塩のClアニオンが求核剤として作用してクロロ化が進行しやすいらしいです(ピリジンを溶媒量使ったり温度を上げると起こりやすい)。私は臭いし除去も面倒なので積極的に使いません。
反応例
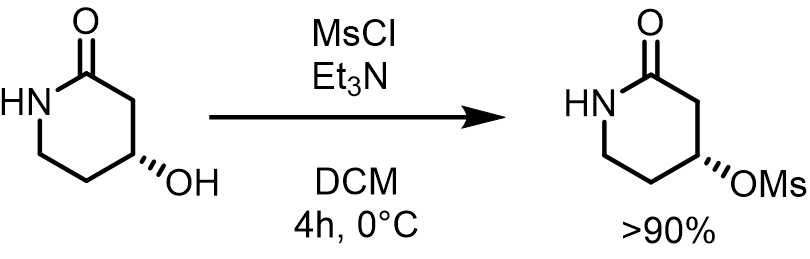
無水トリエチルアミン(1.8eq, 4.46 mmol)を、アルゴン雰囲気下0℃で、DCM(120 mM, 20mL)中のアルコール体(1 eq, 2.48mmol)およびDMAP(0.2 eq, 0.50mmol)の撹拌溶液に添加します。混合物を0℃に冷却した後、MsCl(1.5 eq, 3.72mmol)を加え、0℃から徐々に室温に戻して撹拌した。4時間後、反応混合物を真空中で濃縮し、カラムで精製してメシレートを得た。(>90%)
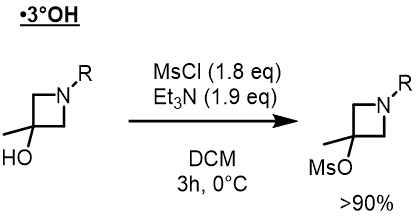
三級アルコールに対してもメシル化できる
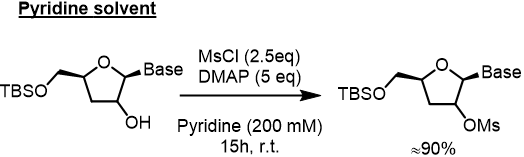
ジクロロメタン(30mL)+ ピリジン(3mL)に溶かしたアルコール体(1eq, 0.47mmol)の溶液に、MsCl(2eq, 0.94mmol)を滴下して加えて、その溶液を室温で3時間撹拌した。 水(10mL)を添加し、そして混合物を酢酸エチル(100mL)で抽出した。 有機溶液をブラインで洗浄し、そして硫酸ナトリウムで乾燥した。濃縮後、フラッシュカラムにより精製し、メシレートを得た(>80%) *MsClを加えるときは、冷却してもよい。ピリジンを加えるときは室温で加えることが多い?
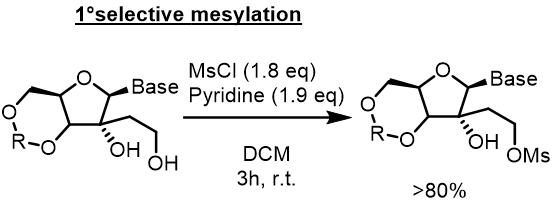 無水ピリジン(10ml)にアルコール(970mg; 2.09mmol)を溶解させ、室温でMsCl(0.41ml; 597mg; 5.21mmol)およびDMAP(1.28g; 10.44mmol)を加えます。15時間撹拌した後、反応混合物をMeOHでクエンチし、濃縮、ジクロロメタン(100 mL)に溶解し、そして水(2×50ml)で洗浄した。 乾燥、濃縮し、フラッシュカラムクロマトグラフィーにより精製してメシレートを得た(90%)
無水ピリジン(10ml)にアルコール(970mg; 2.09mmol)を溶解させ、室温でMsCl(0.41ml; 597mg; 5.21mmol)およびDMAP(1.28g; 10.44mmol)を加えます。15時間撹拌した後、反応混合物をMeOHでクエンチし、濃縮、ジクロロメタン(100 mL)に溶解し、そして水(2×50ml)で洗浄した。 乾燥、濃縮し、フラッシュカラムクロマトグラフィーにより精製してメシレートを得た(90%)
参考
JACS, 2013, 135, 924-932.
Synthesis, 2014, 46, 2591-2594.
研究室ですぐに使える有機合成の定番レシピp.34-35
Journal of Medicinal Chemistry, 2015, 58, 333-346.
<iframe style=”width:120px;height:240px;” marginwidth=”0″ marginheight=”0″ scrolling=”no” frameborder=”0″ src=”//rcm-fe.amazon-adsystem.com/e/cm?lt1=_blank&bc1=000000&IS2=1&bg1=FFFFFF&fc1=000000&lc1=0000FF&t=ntkagaku-22&language=ja_JP&o=9&p=8&l=as4&m=amazon&f=ifr&ref=as_ss_li_til&asins=4621081519&linkId=8a0bc38054a02e6469b6c3d9add7ae71″></iframe>