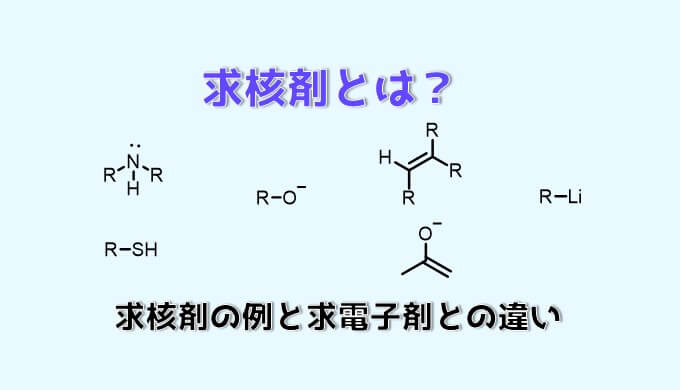
求核剤とは?
求核剤(求核種)とは、電子対を渡すことで他の分子と結合を作ることができる分子(化学種)のことです。
求核剤には以下の特徴があります。
- 電子が豊富(電子密度が高い領域をもつ)
- マイナスの電荷を持つ
- 非共有電子対を持つ
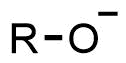
一方で求核剤とは逆の性質を持つものを求電子剤といい、電子を受け取りやすい性質があります。
求核剤や求電子剤は新しい化合物を作り出すのに重要なため、講義でも強調して解説されると思います。
例えば下記のような安定な化合物を混ぜても電子の受け渡しをしにくいため反応が起こりにくいです。
- 希ガス
- 二酸化炭素
- 窒素
逆に電子の受け渡しをしやすい求核剤・求電子剤の下記を組み合わせると反応が起こりやすいです。
- 塩酸(H+プロトンは求電子剤)
- 水酸化ナトリウム(HO-は求核剤)
- アンモニア(求核剤)
上のリストをみて「酸と塩基」だと思った方も多いのでは?
実は酸と塩基も電子の受け渡しが基本なので求核剤・求電子剤と捉えられます。
小学校でも酸と塩基を学ぶのは、酸と塩基の概念が化学反応において基本的で重要だからといえるでしょう。
化学反応と求核剤
酸と塩基を混ぜると激しく反応します。
例えばH+ と -OーHを混ぜるとHとOの間に結合が生まれてHーOーHができます。
これは電子を渡しやすい求核剤である-OHと電子を受け取りやすいH+が出会うことで、電子の受け渡しが起こった結果、新たな結合(分子)が生まれています。
酸と塩基は電子をもらいやすい求電子剤と電子を渡しやすい求核剤の組み合わせなので、激しく反応が起こることが予想できます。
「酸と塩基を混ぜれば激しく直ぐに反応が起こるだろう」と予想できますが、酸、塩基かどうか直ぐにわからないような組み合わせでも化学反応が起こるか?どこで結合が形成されるか?ということが電子の受け渡しやすさを考えることで予想できるようになります。
求核剤の概念の理解が化学反応を理解する上で重要だということがわかると思います。
極性反応は求核剤と求電子剤の反応
膨大な化学反応がこれまでに発見されていますが、分類すればいくつかのパターンしかないことがわかります。
- 極性反応
- ラジカル反応
- ペリ環状反応
化学反応は単純に考えれば結合が切れたり、つながったりするだけのことです。
その化学結合は電子対が作っているので、電子対の移動が起これば結合は切れたり繋がったりします。
上の3つの分類の中で、教科書でよく目にする化学反応は「極性反応」に分類されるものが多いと思います。
極性とはすなわち「電子の偏り」を意味するもので、極性反応は電子の偏った分子同士の反応です。
酸・塩基の反応、求核剤と求電子剤の反応がこの極性反応に分類されます。
求核剤・求電子剤をマスターすれば化学反応の大部分の反応機構や生成する分子構造を予測することができるでしょう。
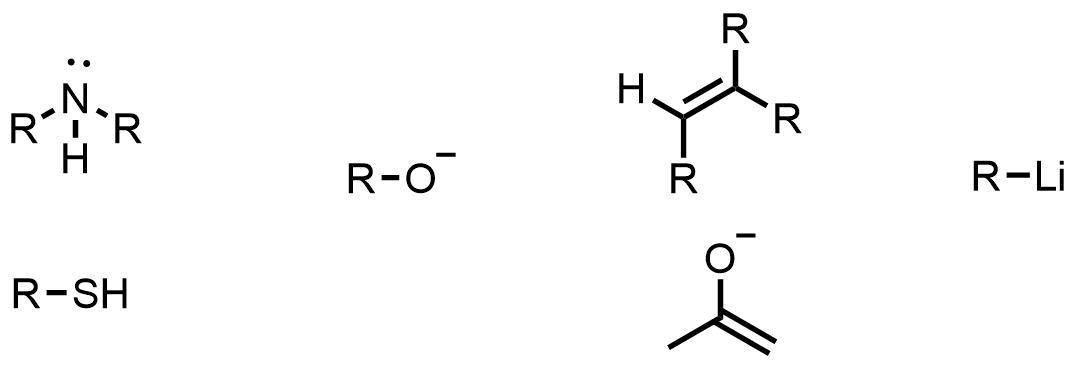
求核剤の例
どんな物質や官能基、化学種が求核剤に分類されるか例を見ていきましょう。
電子の受け渡しやすさは原子の種類等で変化します。
- どんな状態の電子を持っているか?
- 原子がどんな状態か?(原子の種類はなにか?)
例えば下記のような化学種が電子を渡しやすいです。
- 非共有電子対(結合に使われていない電子、アンモニアとか)
- アニオン(HO-とか)
- π電子(アルケンやアルキン、エノラートなど)
- 偏った不安定な結合(有機金属試薬・ブチルリチウム・グリニャール試薬など)
分子構造を見ると以下の物質があります。
求核性について
どの求核剤の強さを求核性と言います。
求核性と似ている概念に「塩基性」があります。塩基性が高いものは求核性も高いことが多いですが、全く同じではありません。
- 反応部位周辺が立体的にかさ高くなると求核性が減少する(原子と接近して結合を作ることができないから)
- 原子サイズが大きくなると求核性は大きくなる
- 共鳴による求核性の低下は塩基性と比べて小さい