ウィリアムソンエーテル合成について
ウイリアムソンエーテル合成はアルコール(脂肪族・芳香族)とアルキルハライドとの反応によりエーテルを合成する反応です。
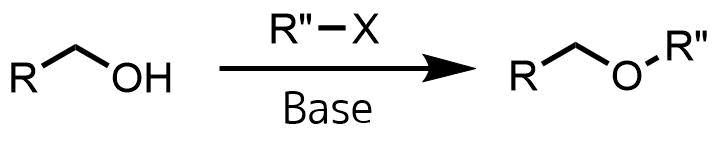
ウィリアムソンエーテル合成の概要
ウィリアムソンエーテル合成では塩基によりアルコールのプロトンを奪って、求核性の高いアルコキシド(R-O–)を発生させます。
エーテル合成法として最も広く使われる重要な反応であり、SN2反応の代表例として教科書にもしばしば登場します。
一般的に脂肪族アルコールよりも芳香族アルコールのほうが合成しやすいです。
求電子剤は脂肪族ハライドよりもベンンジルハライドのほうが反応性が高く合成しやすいです。
1850年にアレキサンダー・ウィリアムソンにより発見された反応です。カリウムエトキシドとヨウ化エチルからエーテルを合成したことを報告しています。
Williamson, Alexander. “XLV. Theory of ætherification.” The London, Edinburgh, and Dublin philosophical magazine and journal of science 37.251 (1850): 350-356.
ウィリアムソンエーテル合成の特徴や条件
アルコール
アルコールは求核性が低い(反応性が低い)ため、塩基によって脱プロトン化させてアルコキシドにしてから反応させます。
芳香族フェノールは酸性度が高いため、炭酸塩などの弱めの塩基(K2CO3)でも十分アルコキシドが生成します。
脂肪族アルコールは酸性度が低いので、強塩基(NaH, KHMDS)を使用してアルコキシド化します。金属ナトリウム使うこともあります。
塩基
フェノールに使用する塩基は
- 炭酸塩(炭酸カリウム、炭酸ナトリウム、炭酸水素ナトリウム、炭酸セシウム)
- 水酸化物塩(水酸化ナトリウム、水酸化カリウム、水酸化タリウム)
- 金属ナトリウム、カリウム
などです。もっと強い塩基を使っても良いですが、副反応を防ぐ点でも不必要に強塩基を使うべきではないです。アルキルハライドが分解する可能性があります。
脂肪族アルコールに使う塩基
- 炭酸塩 (炭酸セシウム)
- 水酸化物塩 (水酸化ナトリウム、水酸化カリウム、水酸化タリウム、水酸化リチウム)
- 金属ナトリウム、カリウム
- 水素化物塩(NaH、KH)
- ジシラザン(NaHMDS、KHMDS)
- LiTMP
- LDA
脂肪族アルコールの脱プロトン化は起こりにくいので強塩基を使います。特によく使うのはNaHです。ファーストチョイスだと思います。他にも炭酸セシウム、NaHMDSなども使います。KOHなどの水酸化物塩を使うこともあります。
溶媒
溶媒はアルコキシドのアニオンを溶媒和して反応性を低下させないために、非プロトン性の極性溶媒を用います。
- アミド系:DMF、DMA、NMP
- スルホキシド系:DMSO
- エーテル系:THF、ジオキサン、DME、CPME
- アセトニトリル
- HMPA(毒性)
- ニトロ系:ニトロメタン、ニトロベンゼン
などが使われます。
DMFやDMSOは代表的な溶媒で溶解性も良く良い結果を与えます。ただし沸点が高いDMSOは後処理が面倒になります。
THFやアセトニトリルは沸点が高くないので容易に留去できるのでお勧めの溶媒です。
個人的にはTHF・MeCN → DMF → DMSOあたりをよく使用します。高沸点溶媒は溶解性が低い芳香族アルコールなどを高温で溶解させるときなどに使用し、NMPやオルトジクロロベンゼン、ニトロベンゼン、ジフェニルエーテルなどを使います。
極性溶媒ではなく無極性溶媒を使用することもあります。無極性溶媒では塩基はあまり溶解しませんが気にせず、加熱還流して反応させます。
- ベンゼン、トルエン、キシレン
- クロロベンゼン類
- エーテル類:ジエチルエーテル、TBME
- ハロアルカン:ジクロロメタン、ジクロロエタン
ジクロロメタンやジエチルエーテル、トルエン、キシレンあたりはよく利用します。溶解性が低い場合もあるので、他の溶媒と混合溶媒とすることもあります。ジクロロメタンは加熱できないためジクロロエタンを使います。クロロホルムは強塩基と反応するので注意します。
反応が起こりにくい場合は濃度を濃くします(500 mM~1M)。そうでもない場合は濃くしすぎると副反応が起こりやすいので注意しましょう。
ハロゲン化アルキル
ハロゲン化アルキルはヨウ化アルキルが最も反応性が高いです。おおよその反応性の順序はI>=OTs>OMs> Br> Clとなります。
アルキル鎖による反応性の違いは、ベンジルハライドやアリルハライドは反応性が高いです。また、第一級>第二級の順序であり、アルキル鎖が小さいほど反応性が高いです。第三級アルキルハライドはアルキル基の水素が脱プロトン化されてE2脱離反応が起こりやすいのでエーテル化には向いていません。
反応が起こりにくい場合は、ハロゲン化アルキルの量を増やします。過剰量加えることもあります。ハロゲン化アルキルを大過剰に加えることもあります。
Williamsonエーテル合成の副反応
第二級、第三級アルキルハライドは脱離反応が起こりやすいので注意しましょう。副反応が起こる場合は、あらかじめアルコキシドを調製して使用するとよいかもしれません。Ca、Baアルコキシドを使用すると置換反応が進行しやすいようです。
アルコール以外に脱プロトン化しやすい官能基(アミン、ジケトン等)がある場合は副反応を誘発するので注意しましょう。塩基の加えすぎや強さに注意します。フェノールの炭素アルキル化が起こる可能性もあります。
反応機構
ウィリアムソンエーテル合成の機構はSN2で進行します。そのためキラルな場合は立体反転が起こります。
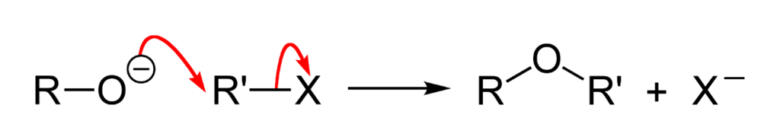
Williamson-ether-synthesis from wiki PD



質問になります。
>副反応が起こる場合は、あらかじめアルコキシドを調製して使用するとよいかもしれません。Ca、Baアルコキシドを使用すると置換反応が進行しやすいようです。
特にCaやBaを用いた場合に置換反応が進行しやすいということについて、その理由が知りたいです。それらを検証している元論文や参考文献などありますでしょうか。
よろしくお願いします。
アルカリ金属のアルコキシドは塩基性が高いため、プロトンを引き抜く力が強いので、第二級や第三級の求電子剤の場合は求核置換によるエーテル生成の他に脱離反応によるアルケンの生成も起こりやすいです。(高い塩基性→プロトンを引く抜く力が強い)一方でカルシウムやバリウムなどのアルカリ土類金属アルコキシドは塩基性が低いのでプロトンの引き抜きが起こりにくく置換反応が進行しやすいです。下記論文は日本語で読めます。
Masada, Hiromitsu, et al. “Synthesis of Ethers Using Alkaline Earth Metal Salts.” NIPPON KAGAKU KAISHI (1995): 635-635.