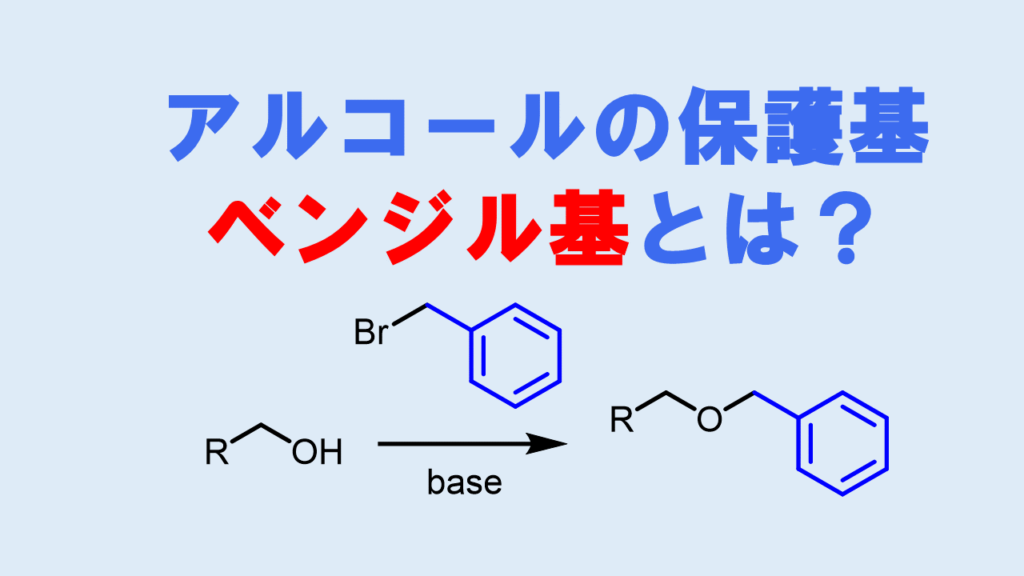
Bn基(ベンジル基)とは
Bn基はベンジル系のアルコールの保護基で、接触還元や過激な酸性条件以外では強く安定な保護基です。強い保護基であるため、脱保護が容易にできないことがあり、合成終盤での利用はためらわれます。一方でコストが低いため、合成序盤で用いやすい保護基です。
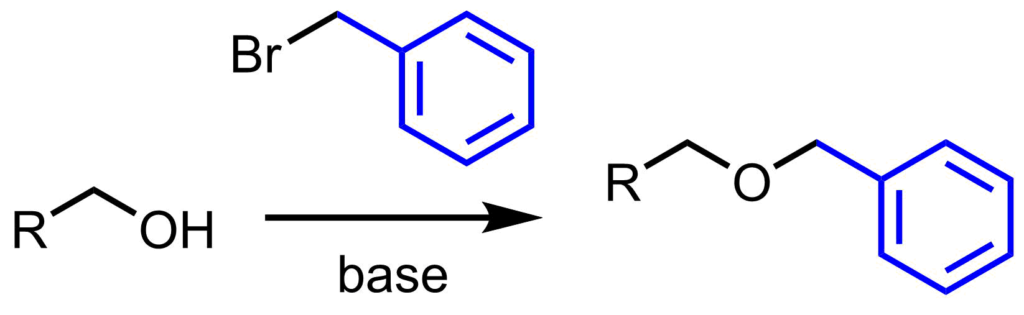
特徴・利点
ベンジル基の利点や特徴は
- 様々な条件下において強く外れにくい
- 安価
欠点としては
- 脱保護の選択肢が少ない
等の欠点があります。
反応機構
反応機構ー保護
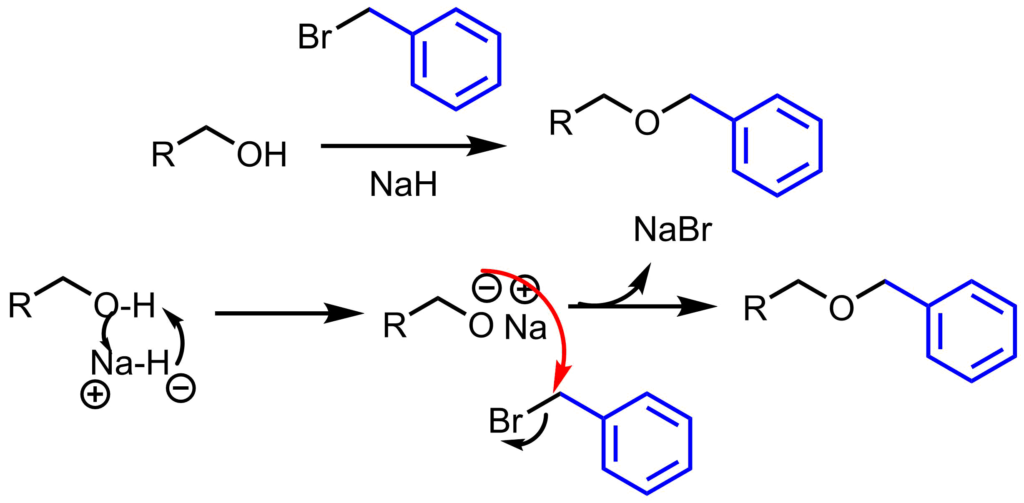 ベンジル化はベンジルブロミドと塩基を用いて行います。アルコールは塩基により脱プロトン化され、アルコキシドが生じます。求核性が向上したアルコキシドがベンジルブロミドを攻撃し、ベンジル化が進行します。
ベンジル化はベンジルブロミドと塩基を用いて行います。アルコールは塩基により脱プロトン化され、アルコキシドが生じます。求核性が向上したアルコキシドがベンジルブロミドを攻撃し、ベンジル化が進行します。
反応機構ー脱保護
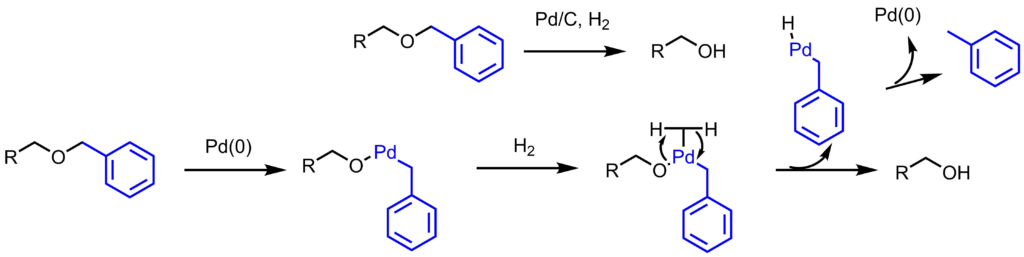
脱保護はPd/Cを用いた接触還元で行います。パラジウムが酸化的付加、トランスメタル化を経て、アルコールが生成します。ベンジル基は還元的脱離を経てトルエンになります。
反応条件-保護
ベンジル基の導入はアルコールを塩基性条件下でベンジルブロミドと反応させるまたは酸性条件下でベンジルトリクロロアセトイミデートと反応させることによって得た。
保護条件例1
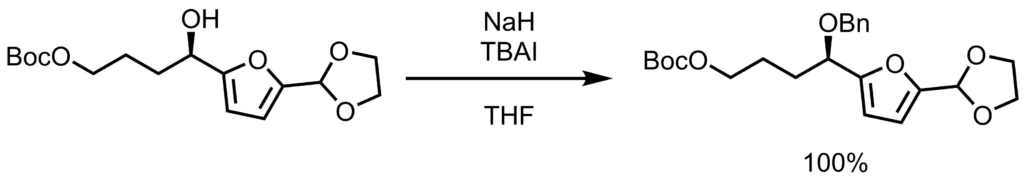 THF(1.0L)にアルコール体(59.0 g, 189 mmol,1.0eq)を加えて溶液を0℃に冷却した後、BnBr(56.2 mL, 472 mmol, 2.5eq)およびTBAI (34.9 g, 94.5mmol, 0.5 eq)を添加した。続いてNaH(香油中60%、30.1g,756mmol,4.0 eq)を少しずつ加え、反応混合物を25℃に温め16時間撹拌した。反応混合物を水(700mL)でゆっくりクエンチし、二層混合物をEtOAc(3×500mL)で抽出し、そして合わせた有機層を水(750mL)およびブライン(750mL)で洗浄し、次いで乾燥し(MgSO4)、濃縮した。フラッシュカラムクロマトグラフィー(シリカゲル、ヘキサン:EtOAc 9:1~3:1)により、ベンジル体を得た(75.9 g, 189 mmol, quant.)。 Nicolaou, K. C. et al. JACS. 2010, 132, 6861. より引用。
THF(1.0L)にアルコール体(59.0 g, 189 mmol,1.0eq)を加えて溶液を0℃に冷却した後、BnBr(56.2 mL, 472 mmol, 2.5eq)およびTBAI (34.9 g, 94.5mmol, 0.5 eq)を添加した。続いてNaH(香油中60%、30.1g,756mmol,4.0 eq)を少しずつ加え、反応混合物を25℃に温め16時間撹拌した。反応混合物を水(700mL)でゆっくりクエンチし、二層混合物をEtOAc(3×500mL)で抽出し、そして合わせた有機層を水(750mL)およびブライン(750mL)で洗浄し、次いで乾燥し(MgSO4)、濃縮した。フラッシュカラムクロマトグラフィー(シリカゲル、ヘキサン:EtOAc 9:1~3:1)により、ベンジル体を得た(75.9 g, 189 mmol, quant.)。 Nicolaou, K. C. et al. JACS. 2010, 132, 6861. より引用。
保護反応例2
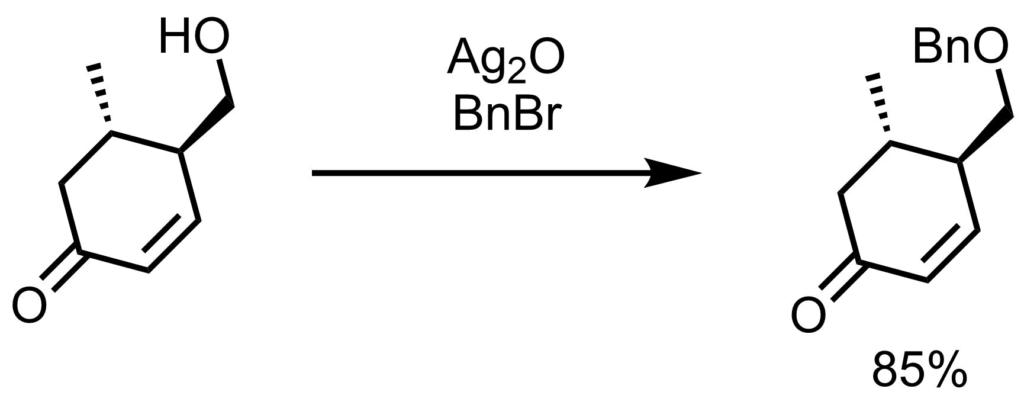 臭化ベンジル(300 mL)とアルコール体(1 eq, 40.0 mmol)の溶液に、Ag2O(2.7eq, 108 mmol)を加えて室温で3日間撹拌した。反応の合間に追加の酸化銀(1 eq, 40.0 mmol,3回)を加えた。反応が完了したら、懸濁液をエーテル(500mL)で希釈し、セライト濾過した。ろ液を真空下で濃縮し、過剰の臭化ベンジルを減圧蒸留(60℃)で除去し残渣をシリカゲルカラムクロマトグラフィー(9:1ヘキサン:酢酸エチル)により生成してベンジルエーテル体(85%)を得た。Smith, Amos B., et al. JACS. 2009, 131, 2358.
臭化ベンジル(300 mL)とアルコール体(1 eq, 40.0 mmol)の溶液に、Ag2O(2.7eq, 108 mmol)を加えて室温で3日間撹拌した。反応の合間に追加の酸化銀(1 eq, 40.0 mmol,3回)を加えた。反応が完了したら、懸濁液をエーテル(500mL)で希釈し、セライト濾過した。ろ液を真空下で濃縮し、過剰の臭化ベンジルを減圧蒸留(60℃)で除去し残渣をシリカゲルカラムクロマトグラフィー(9:1ヘキサン:酢酸エチル)により生成してベンジルエーテル体(85%)を得た。Smith, Amos B., et al. JACS. 2009, 131, 2358.
ベンジル化は塩基だけでなく酸化銀を用いることによっても得られる。中性条件で進行するのが利点ですが、反応が長時間に及ぐことが多く、酸化銀はフレッシュなものを用いないと収率が低下します。硝酸銀から反応の都度調製することをおすすめします。
保護条件
よく利用される塩基触媒:NaH、K2CO3、NaOH、Na
よく利用される添加物:TBAI、KI
溶媒:DMF、THF、アセトン、ジクロロメタン、アセトニトリル、エーテル
Dudleyベンジル化試薬
ベンジル化は、上述の通りアルコールに対して強塩基を作用させることによって生じるアルコキシドのベンジルハライドに対する求核置換反応により行うのが一般的です。NaHのような強塩基は基質によっては副反応が起きてしまうことがあるため、より温和な条件が求められます。強塩基を用いない条件としてはTfOH(トリフルオロメタンスルホン酸)を酸触媒としてベンジルトリクロロアセトイミデートを反応させるとベンジル化体が得られますが、TfOHは強酸であるため、温和な条件とは言い難いです。例えばβヒドロキシエステルに強塩基を作用させた際には、目的のアルコキシド体以外に、α位のプロトンが脱プロトン化して脱離反応が進行してしまうパターンがあります。また、キラルエステルの場合はヒドロキシアニオンが攻撃することによって、エピメリ化も進行してしまいます。こうした反応は強酸条件においても起こりうるもので、アルドール反応の逆反応であるレトロアルドール反応なども起こりえます。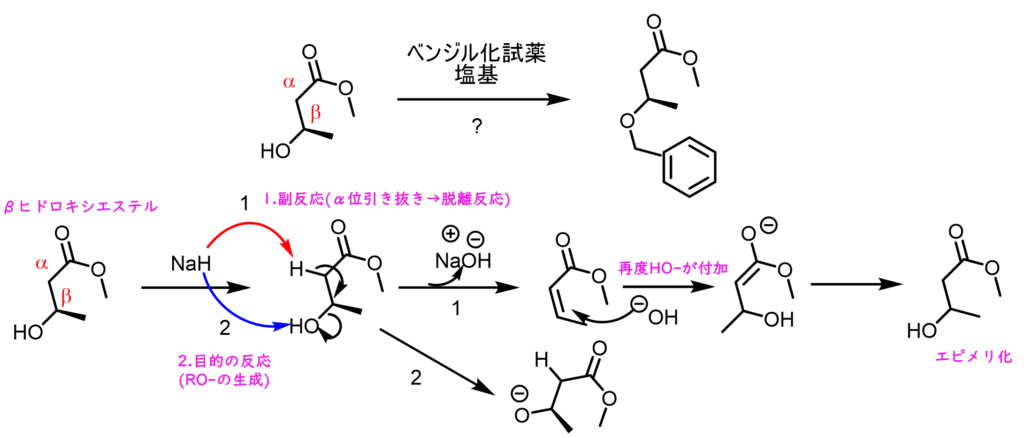 Dudleyベンジル化試薬は、こうした副反応が起こり難い中性条件下でのアルコールのベンジル化をおこなうための試薬です。Dodley試薬は活性化ピリジニウム塩となっていて、アルコールと溶媒中で加熱することによって簡単に得られます。
Dudleyベンジル化試薬は、こうした副反応が起こり難い中性条件下でのアルコールのベンジル化をおこなうための試薬です。Dodley試薬は活性化ピリジニウム塩となっていて、アルコールと溶媒中で加熱することによって簡単に得られます。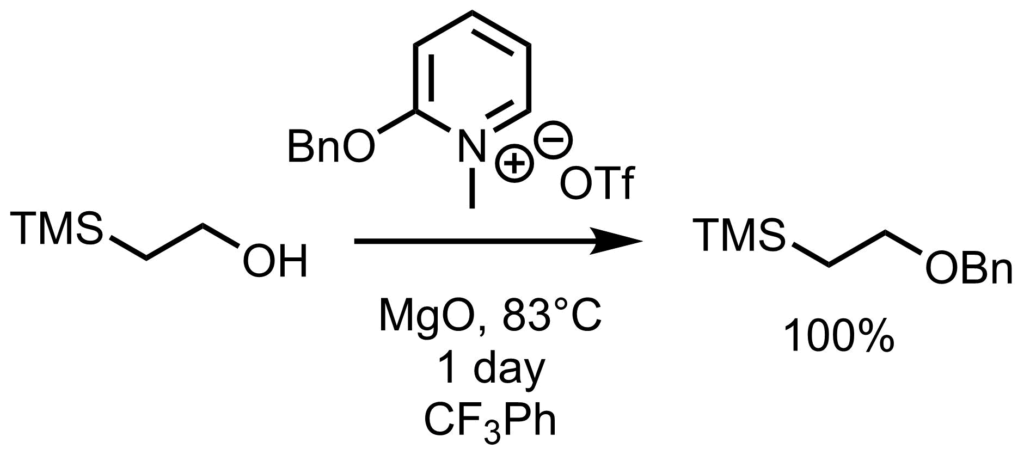 Dudley試薬により酸性、塩基性条件下で不安定なTMSエタノールを定量的にベンジル化した報告があります。ちなみにDudley試薬によるベンジル化に使用する溶媒はNMPといった極性溶媒では進行しにくく、トルエンやベンゼン、ジクロロエタンなどがよく、トリフルオロメチルベンゼンが収率が良いようです。ジクロロエタンは沸点が低く還流しやすいのでこれでも良いみたいです。(MgOは副生するヒドロキシピリジンのトラップ)。反応条件は、アルコールに対して2.0eqのDudley試薬、2.0eqのMgOを加えて約1日ほど80℃くらいで加熱することによってベンジル化できます。溶媒はPhCF3がおすすめです。 Poon, K. W. C.; Dudley, G. B., J. Org. Chem. 2006, 71, 3923.
Dudley試薬により酸性、塩基性条件下で不安定なTMSエタノールを定量的にベンジル化した報告があります。ちなみにDudley試薬によるベンジル化に使用する溶媒はNMPといった極性溶媒では進行しにくく、トルエンやベンゼン、ジクロロエタンなどがよく、トリフルオロメチルベンゼンが収率が良いようです。ジクロロエタンは沸点が低く還流しやすいのでこれでも良いみたいです。(MgOは副生するヒドロキシピリジンのトラップ)。反応条件は、アルコールに対して2.0eqのDudley試薬、2.0eqのMgOを加えて約1日ほど80℃くらいで加熱することによってベンジル化できます。溶媒はPhCF3がおすすめです。 Poon, K. W. C.; Dudley, G. B., J. Org. Chem. 2006, 71, 3923.
脱保護反応例
ベンジル基の脱保護はおもに接触還元により行います。
反応例1
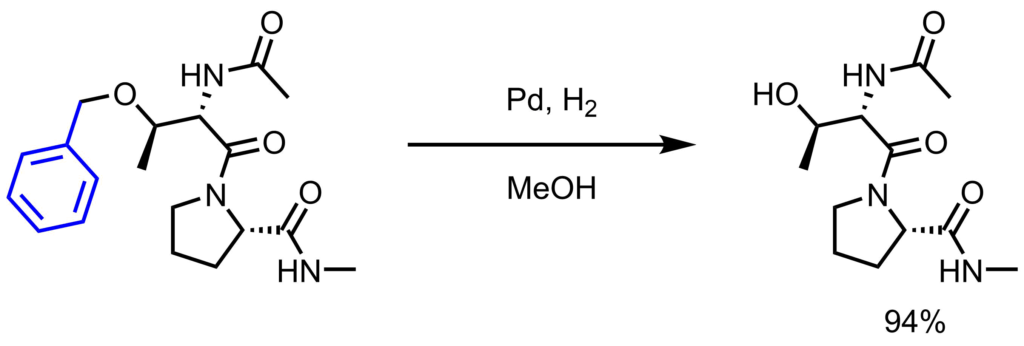 Pd/C (10%、15mg)をMeOH(2.5mL)とアルコール体(17mg,0.05mmol)の溶液に加えた後、水素置換し、一晩撹拌した。セライトろ過により触媒を除去し、濾液を濃縮、残渣をHPLCにより精製し目的物を得た(94%)。Karunaratne, Chamini V. et al. JACS, 2014, 136, 15175.
Pd/C (10%、15mg)をMeOH(2.5mL)とアルコール体(17mg,0.05mmol)の溶液に加えた後、水素置換し、一晩撹拌した。セライトろ過により触媒を除去し、濾液を濃縮、残渣をHPLCにより精製し目的物を得た(94%)。Karunaratne, Chamini V. et al. JACS, 2014, 136, 15175.
反応例2
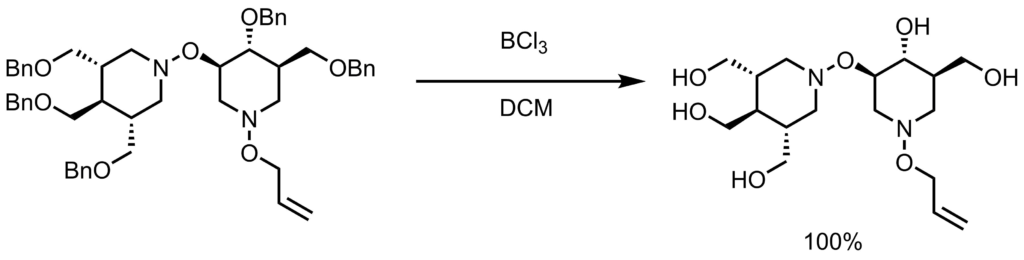 ジクロロメタン(0.16 mL)とアルコール体(10.8 mg,0.0135mmol, 1 eq)の溶液に、BCl3(1M in DCM, 220μL,0.203mmol, 15 eq)のを加えて室温で3時間撹拌し、反応終了後、濃縮した。粗生成物をシリカゲル(アセトニトリル/ 水 / アンモニア水(84:15:1))で精製し目的物を得た(4.7mg,0.0135mmol,100%)。 Ferry, Angelique et al. JACS, 2014, 136, 14857. より引用。ルイス酸のBCl3で脱保護する手法もよく用いられます。ルイス酸は他にもTMSIやFeCl3なども使用されます。他の脱保護方としてはバーチ還元条件などもあります。
ジクロロメタン(0.16 mL)とアルコール体(10.8 mg,0.0135mmol, 1 eq)の溶液に、BCl3(1M in DCM, 220μL,0.203mmol, 15 eq)のを加えて室温で3時間撹拌し、反応終了後、濃縮した。粗生成物をシリカゲル(アセトニトリル/ 水 / アンモニア水(84:15:1))で精製し目的物を得た(4.7mg,0.0135mmol,100%)。 Ferry, Angelique et al. JACS, 2014, 136, 14857. より引用。ルイス酸のBCl3で脱保護する手法もよく用いられます。ルイス酸は他にもTMSIやFeCl3なども使用されます。他の脱保護方としてはバーチ還元条件などもあります。
脱保護条件
溶媒:メタノール、THF、EtOH、ジクロロメタン
注意事項ーTips
- ベンジルブロミド(BnBr)は催涙性があるので気をつける。
- 溶媒によって接触水素化の反応性が変化する。(THFやプロパノールがメタノールやトルエンなどよりも早い)
参考まとめ
Wuts, Peter G. M.. Greene’s Protective Groups in Organic Synthesis fifth edition (p.273). Wiley.
[blogcard url=”https://www.organic-chemistry.org/protectivegroups/hydroxyl/benzyl-ethers.htm”]
[blogcard url=”https://ja.wikipedia.org/wiki/%E3%83%99%E3%83%B3%E3%82%B8%E3%83%AB%E5%9F%BA”]
[blogcard url=”https://www.chem-station.com/odos/2009/06/bn-protectiondeprotection-by-b.html”]