ウルマンエーテル合成について
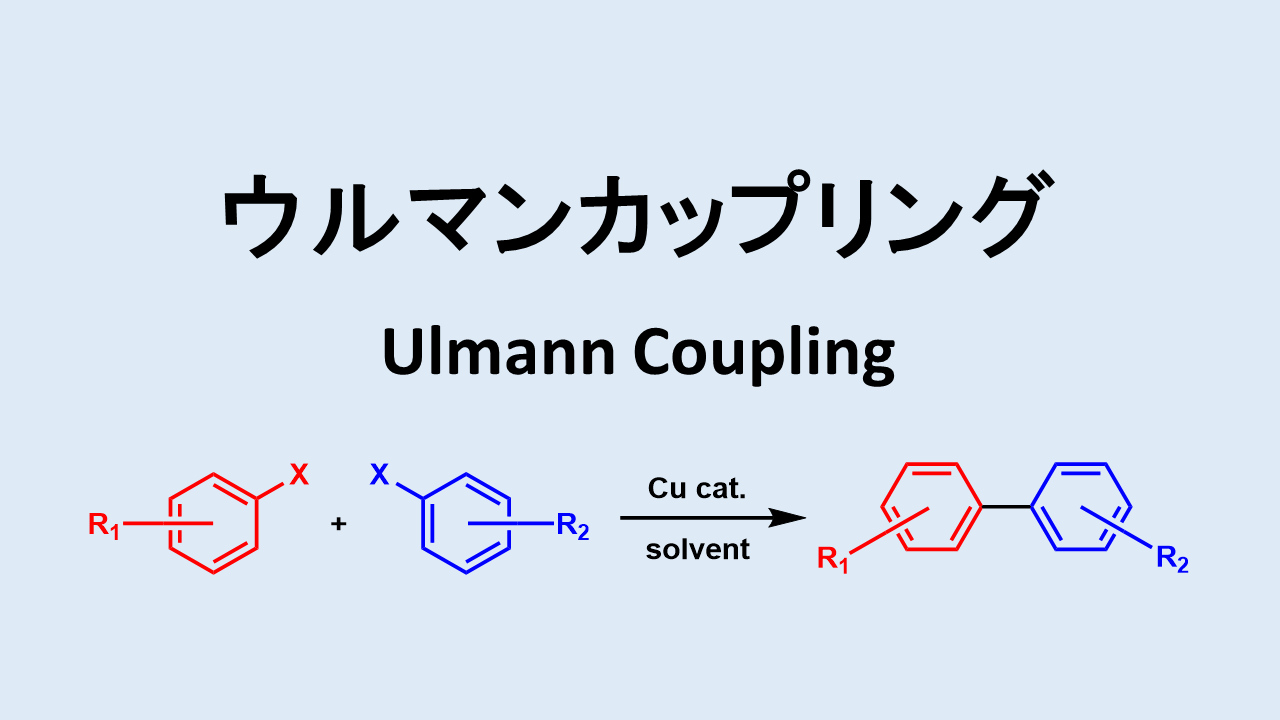
ウルマン反応は銅触媒下でハロゲン化アリール同士をカップリングさせる反応です。
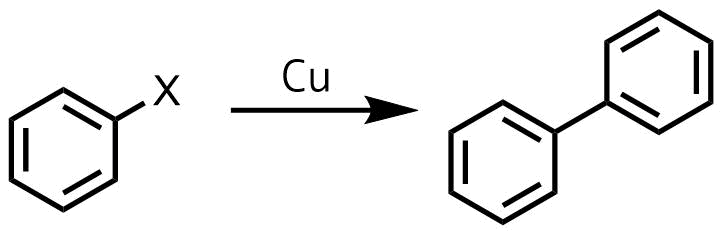
ウルマン反応の概要
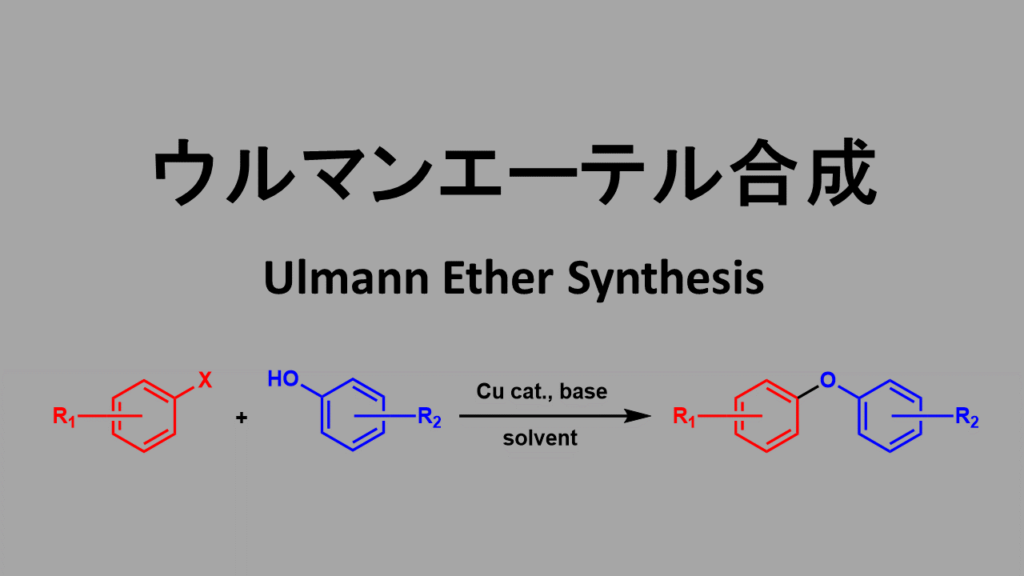
さらにこのウルマン反応を応用してハロゲン化アリールとフェノールとの縮合反応をウルマンらが開発しました。今日ではUllmann縮合あるいはUllmannエーテル合成と呼ばれています。
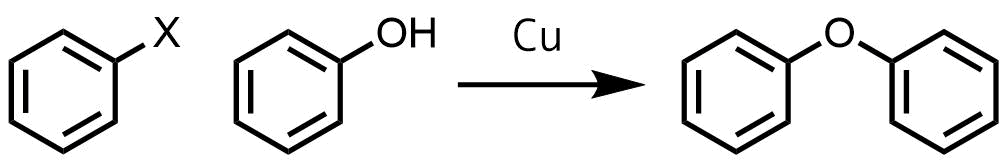
ウルマンエーテル合成の概要
ウルマンエーテル合成の条件
アリールハライドについて
ウルマン反応ではアリールハライドはヨウ化、臭化、塩化アリールが利用できます。
反応性はI> Br> Clの順番になります。
ウルマンエーテル合成は初期の報告では高熱・長時間反応が必要であることから官能許容性が低かったですが、配位子など、改良によって官能基許容性が高まっています。
エステル、アミン、ニトリル、クロリド、アルデヒド、メトキシ基などが入っていてもOKです。
Maiti, Debabrata, and Stephen L. Buchwald. “Cu-catalyzed arylation of phenols: synthesis of sterically hindered and heteroaryl diaryl ethers.” The Journal of organic chemistry 75.5 (2010): 1791-1794.
アリールハライドの置換基によって反応性はあまり変化しないようです。
温度
ウルマンエーテル合成は結構高い温度が必要になります。80℃~100℃くらいが多く、反応が進行しない場合は100℃以上の温度で反応かけます。
溶媒
溶媒はかけようとする温度や条件によって変わりますが、極性溶媒ではDMFやDMSOをよく使います。非極性溶媒ではトルエンを結構使います。
塩基
ウルマンエーテル合成では塩基を用います。リン酸カリウム、炭酸カリウム、炭酸セシウム、炭酸ナトリウムなどを使います。
配位子
配位子は銅を活性化するために入れます、ビピリジン類がよく使われます。
銅触媒
銅は金属銅、ヨウ化銅、酸化銅(I)、酸化銅(II)などが使われます。
ウルマンエーテルの副反応
副反応を抑えるにはアリールボロン酸を用いるChan Evans Lam改良法やBatey改良法など様々な改良法が報告されています。
フェノールの反応性が低い場合はハロゲン部が還元される副反応が起こりやすいです。
反応機構
銅が絡む反応の機構はまだよくわからないことが多いようです。ラジカル機構は反応に関係していないという知見があります。