ワインレブケトン合成は有用なケトン合成法
カルボン酸誘導体を求電子剤として、有機金属化合物で置換してケトンを合成するのは結構難しいです。
なぜなら生成したケトンの求電子性が高いため、ケトンに有機金属化合物が付加してしばしば第三級アルコールが生成してしまうからです。
ケトンよりも反応性の低いエステルやアミドなどを求電子剤とすると基本的に第三級のアルコールが生成しやすくケトンの前駆体としては向いていません。
したがって、ケトンよりも反応性が高い酸塩化物を過剰に利用して低温滴下条件で注意深くケトンを得るという方法を用います。
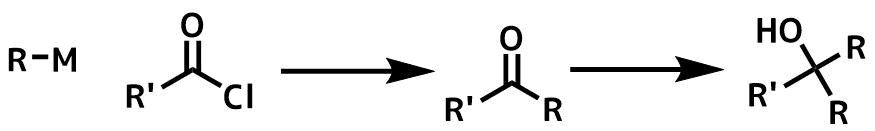
炭素求核試薬を使ったケトン合成の概要ー酸塩化物からの合成例
しかしカルボン酸が重要な場合第三級アルコールの生成は避けたいものであり(脱アルキル化は困難)、過剰量の酸塩化物を使うのも貴重なカルボン酸の場合は問題があります。
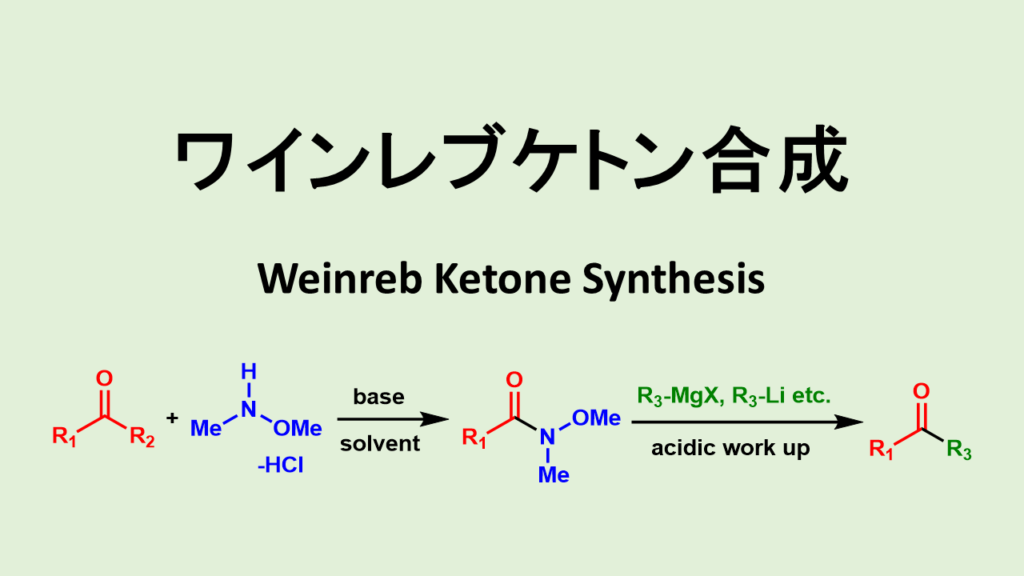
こうしたケトン合成の問題を解決した有力な方法が「ワインレブアミドを用いたケトン合成」です。
Weinrebケトン合成ではN-メトキシ-N-メチルアミド(Weinrebアミド)と有機金属化合物を用いてケトン合成を行います。
ワインレブケトン合成の機構と特徴
1981年にS. M. WeinrebとS. Nahmが発見したワインレブアミドは特殊なアミドでN-メトキシ-N-メチルアミンのアミドです。
Weinrebアミドは安定な化合物であり、特殊な取り扱いを必要とせずフラッシュクロマトグラフイーもしくは再結晶により容易に精製でき、保存に関しても問題ありません。
ケトン合成が可能な理由・反応機構
ワインレブアミドに対して有機リチウム試薬やグリニャール試薬を作用させるとアルキル鎖が付加して四面体中間体が生成しますが、この時、メトキシ基とカルボニル酸素アニオンが有機金属化合物の金属カチオンに配位して安定化させます。これによりアミンが脱離しなくなるので、有機金属試薬の付加反応が進行しなくなります。この中間体2を酸加水分解することによってケトン体が得られます。
ワインレブアミドを利用すれば有機金属化合物を過剰量加えてもケトン選択的に合成できます。
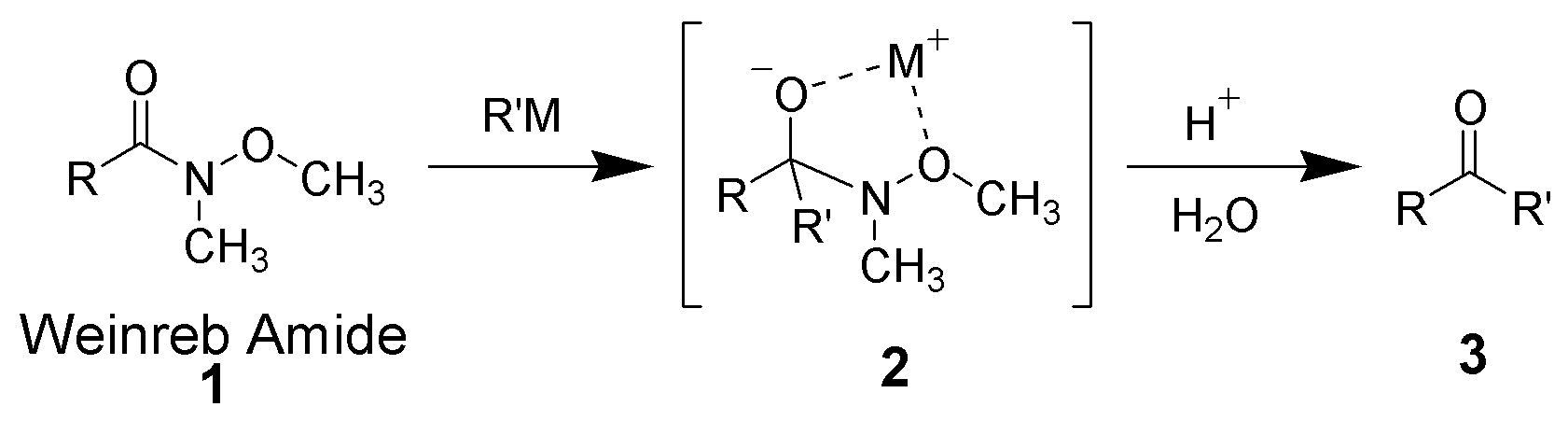
ワインレブアミドを用いたケトン合成の概要 from wikipedia
ワインレブアミドの調整法
Weinrebのアミドは塩基存在下、カルボン酸塩化物や酸無水物などの活性化されたカルボン酸誘導体とN、O-ジメチルヒドロキシルアミン塩酸塩から容易に合成できます。
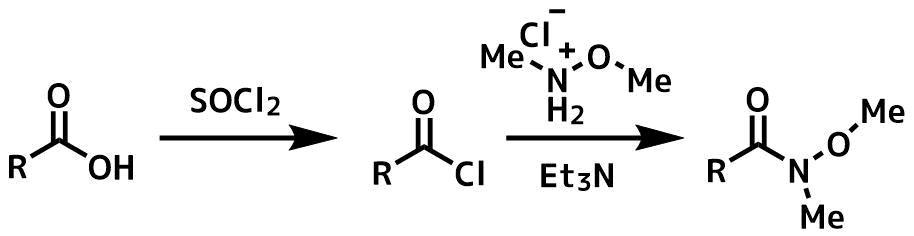
カルボン酸からワインレブアミドの合成法
カルボン酸は縮合剤(DCC、EDCI、CBr4 / PPhなど)を使ってWeinrebアミドへ変換することもできます。
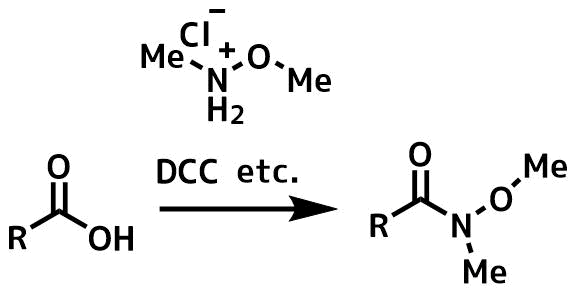
カルボン酸から縮合剤でワインレブアミドの合成法
エステルからワインレブアミドを得る方法としては、Me3AlやEt3Alといったアルキルアルミニウムを用いた方法がよく利用されています。
Levin, J. I., Turos, E., Weinreb, S. M. An alternative procedure for the aluminum-mediated conversion of esters to amides. Synth. Commun. 1982, 12, 989-993
立体障害の大きいエステルでは収率が低下することがあるので、iPrMgClを使った方法が有用であるという報告があります。
一般的な方法
エステル(10mmol)とN-メトキシN-メチルアミン(15.5 mmol)を20mLのTHFに溶かして窒素雰囲気下-20℃に冷却し、i-PrMgCl in THF(15 mL 2.0 M)を15分かけて-5℃を保ったまま滴下して加えた。-10℃まで温めて20分間撹拌後、飽和塩化アンモニウムでクエンチして、抽出、カラム生成でワインレブアミドを得る。
Williams, J. Michael, et al. “A new general method for preparation of N-methoxy-N-methylamides. Application in direct conversion of an ester to a ketone.” Tetrahedron letters 36.31 (1995): 5461-5464.
一般的な合成法
Me2AlCl(1.01 M hex 2- 5eq)を5分間かけてMeONHMe・HCl(2-5eq)のジクロロメタン20mL溶液に窒素雰囲気下0℃で滴下して加えた。そして室温に戻しながら1時間撹拌した。その後、エステル(1eq)のジクロロメタン(10mL)溶液を滴下して加えた。反応後、リン酸バッファーを加えて10分撹拌し、抽出、カラム精製によりワインレブアミドを得る。
Shimizu, Takeshi, Katsuhisa Osako, and Ta-I. Nakata. “Efficient method for preparation of N-methoxy-N-methyl amides by reaction of lactones or esters with Me2AlCl MeONHMe· HCl.” Tetrahedron letters 38.15 (1997): 2685-2688.
反応条件
低温でエーテル系溶媒中、Weinrebアミドに少なくとも1.1当量のGrignard反応剤もしくは有機リチウム反応剤を加えると強固にキレート化した金属錯体が生成し、1当量より過剰の反応剤の付加を妨ぐことができます。
希塩酸水溶液(HCl)による酸加水分解で容易にケトンを得ることができるので、通常他の官能基や保護基に影響を与えません。
ほぼどのようなアルキル、アルケニルアルキニル、アリール、ヘテロアリールの有機マグネシウム、もしくは有機リチウム反応剤でも使うことができます。
反応剤の過剰付加、α位不斉中心のエピメリ化といった副反応はほとんど起きません。
この方法の問題点としては、強塩基性もしくは立体的に込んでいる有機金属反応剤を用いた場合にOMe基からプロトンを引き抜き、結果としてN-メチルアミドを生成する可能性がある点です。
ワインレブアミドの応用
アルデヒドの合成
通常のアミドはLiAlH4による還元でアミンを生成しますが、Weinrebアミドではアルデヒドが生成します。
アミドは中間体としてイミンが生成し、これが還元を受けてアミンになりますが、ワインレブアミドでは金属イオンが配位して安定な錯体を形成するためそれ以上還元が進行せず、ワークアップでアルデヒドが生成します。
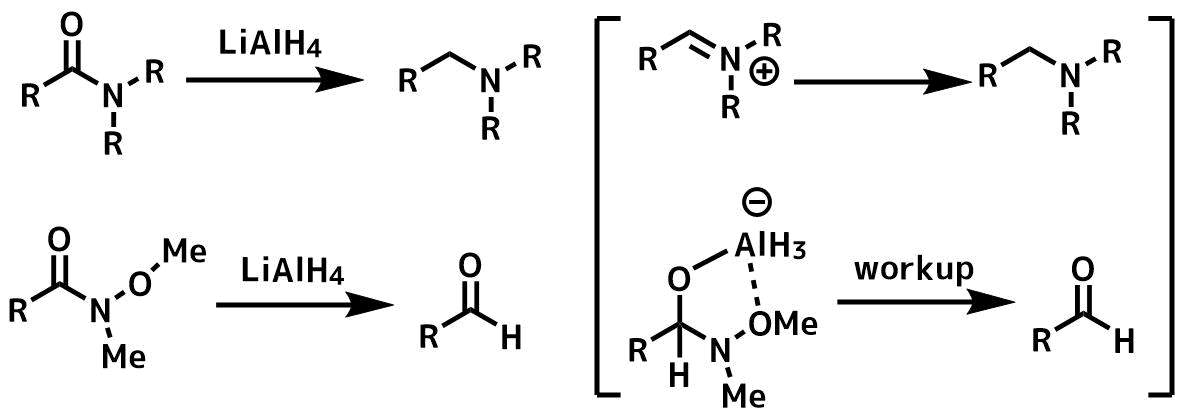
ワインレブアミドでアルデヒドが合成できる理由
LAHよりもDIBALのほうが高収率でアルデヒドが得られます。