トシル基はp-トルエンスルホニル基の略称で主に水酸基などをトシル化することによって脱離能を高めて求核置換反応などを起こさせるのに使われています。
 こめやん
こめやん
トシル基は有名な脱離基で他にはメシル基やトリフリル基があります。
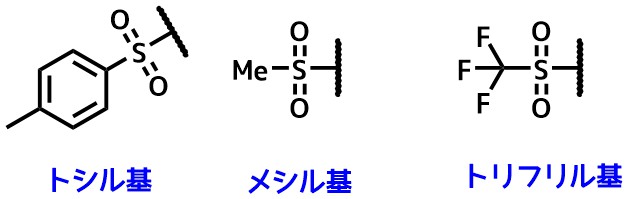
TsとMsとTf基
トシル基とは?
トシル基(Ts, Tos)はトルエンスルホニル基の略称です。ベンゼンスルホン酸のベンゼン上にメチル基がある構造をしています。
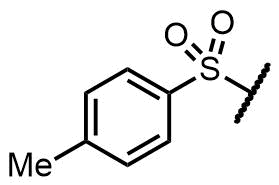
トシル基(p-トルエンスルホン酸)
トシル基はベンゼンのメチル基がスルホニル基のパラ位に位置するパラトルエンスルホン酸を指すことが慣例になっています。
トシル基はベンゼンスルホン酸の中でも最もよく耳にする化合物の一つです。
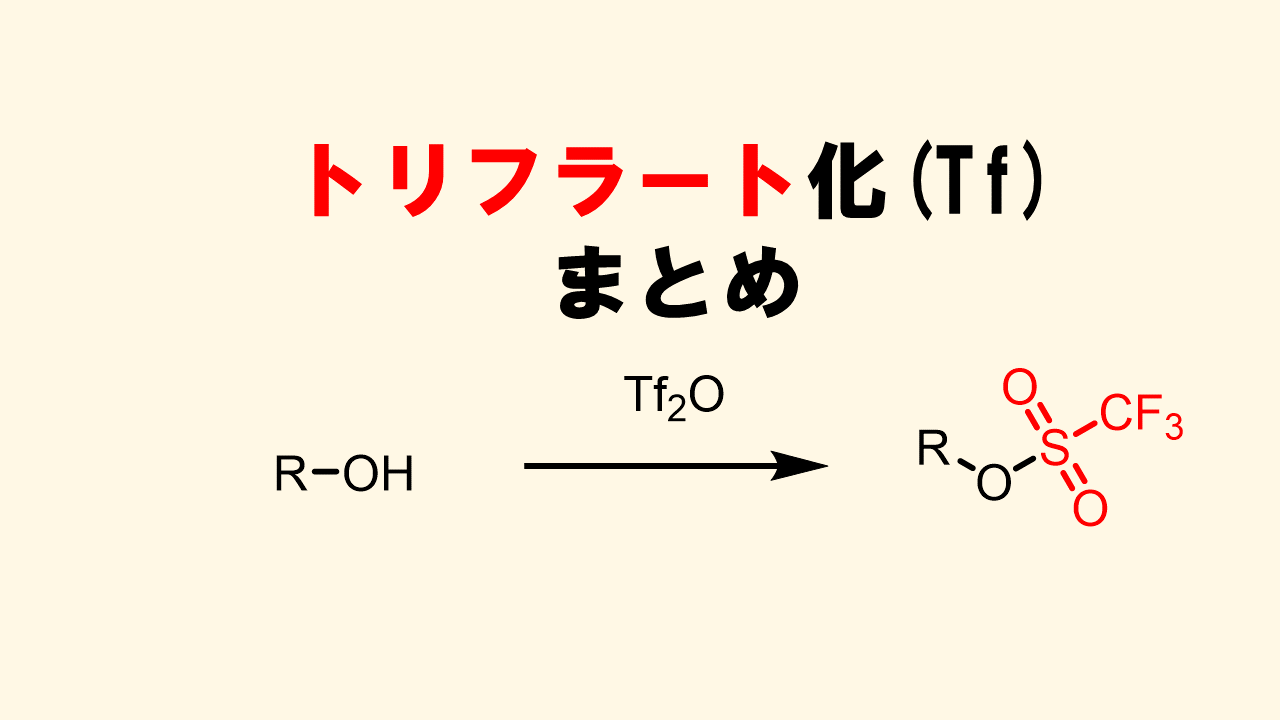
なぜトシル基が有名なのか?というと、アルコールをトシル化(トルエンスルホン酸エステル化)するとアルコールに対してSN2反応により様々な官能基を導入することが可能になるからです。
トシル化の反応機構
トシル化の一般的方法はTsClと過剰量(10eq以上)のピリジンを用います。
トシル化反応中に温度を高くするとトシルクロライドから副生した塩化物イオンによってクロロ化が進行してしまうので注意です。
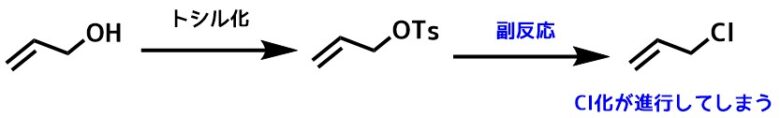
トシル化の副反応
クロロ化はアリルアルコールやエチニルアルコール、プロパギルアルコールで進行しやすいです。
トシル化の反応機構は以下のようになっています。
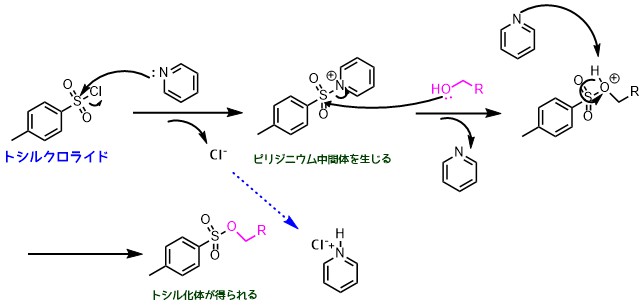
トシル化の反応機構
ピリジンの代わりに立体的が空いている第三級アミン(トリメチルアミン塩酸塩、TMEDA(テトラメチルエチレンジアミン)などを使うと塩素化することなく高収率にスルホン酸エステルが得られます。
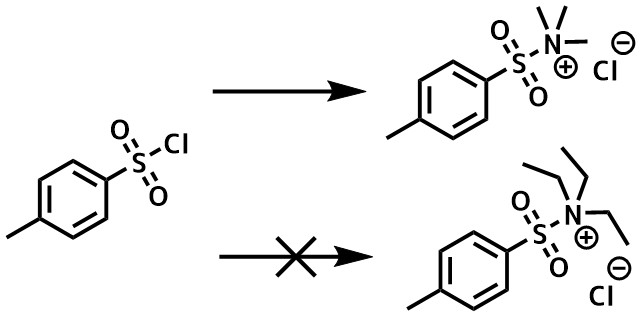
TsCl_トリメチルアミン法 – 嵩高いトリエチルアミンではなくトリメチルアミンを用いることでスルホニウムアンモニウム中間体が生成する。
反応溶媒はトルエン、MeCN、DCMが使えます。
基本的な方法はTEA(2.0eq), cat.Me3N・HCl(0.1eq) 0-5℃で反応させます。
塩基にKOHやK2CO3を使用するとTEAの使用量を抑えることが可能です。ショッテンバウマン条件も使用できます。
トシル体とSN2反応でアジドやアミン 反応機構
トシル体はアルコールの酸素を奪って安定なトシラートアニオンに変化するので、第一級アルコールのトシル体は求核性の高い化合物とSN2反応を起こして置換生成物を与えます。
トシル体はアルコールを脂肪族アジドに変換する方法として良く利用されています。アミンも変換可能ですが、ポリアルキル化を起こす可能性があるために通常は別のアミン合成法を使います。
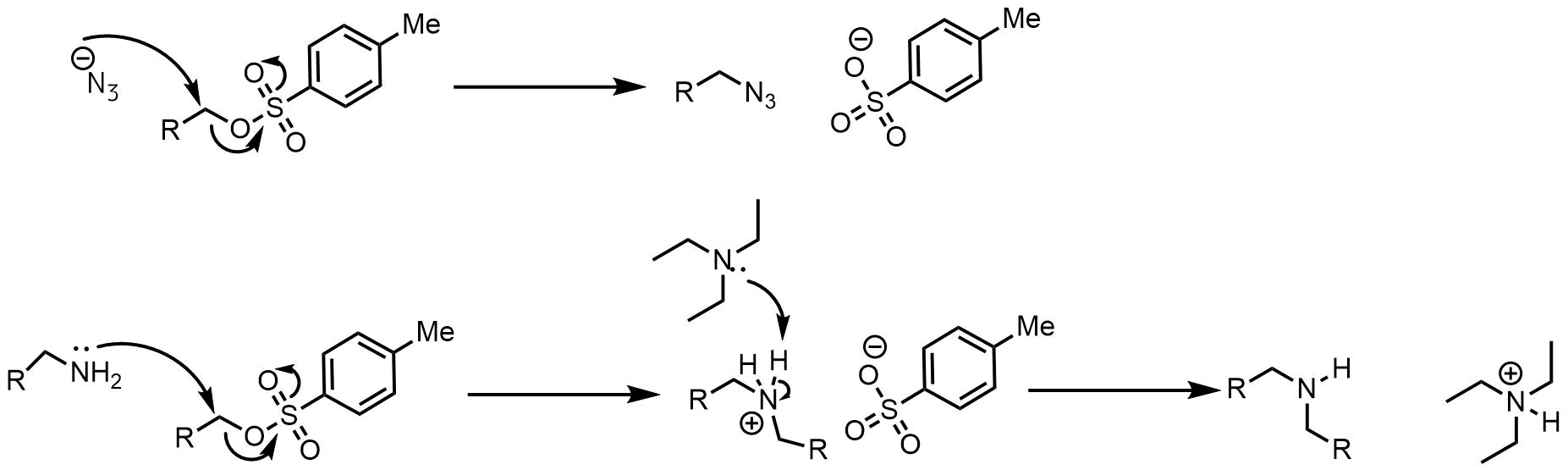
トシル体のSN2反応
トシル基を一電子還元で除去
トシル基を外す方法としてはナトリウムアマルガムやマグネシウムなどの金属をメタノールなどのアルコール中で一電子還元を行うことによって除去可能です。ほかにもラネーニッケルを含水エタノール中で反応、リチウムナフタレニド、ヨウ化サマリウム、トリブチルスズなどが使えます。
トシル基のNMRチャート
トシル基のNMRは1,4-置換ベンゼンなので見やすいです。
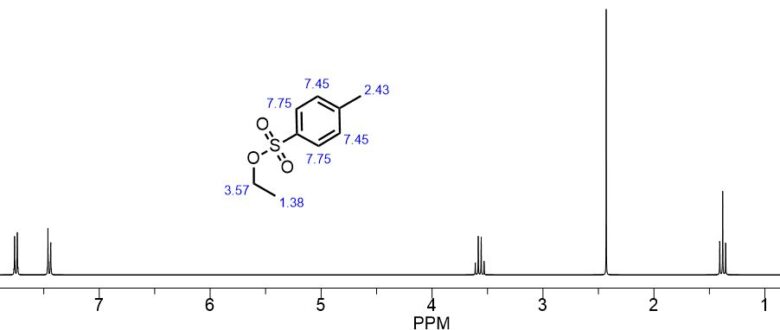
トシル基のH-NMR predicted by Chemdraw
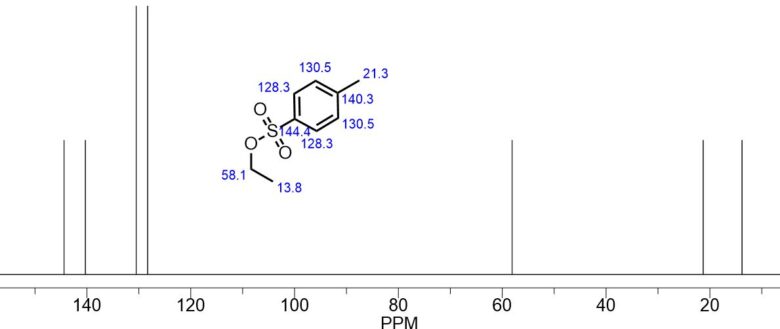
トシル基のCNMR predicted by Chemdraw
トシルとメシルの脱離能の違いは?
トシルとメシルの違いは主に
- 脱離能が若干トシルのほうが弱い
- トシルのほうが傘高い
- トシルのほうが疎水性が上がる
- トシルのほうが結晶性が高くなる
脱離能について
脱離能を比較するにはpKaを比較するのが良いです。
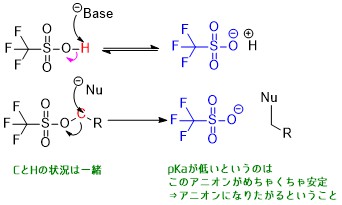
脱離能とpKaの関係
最も脱離能が高い脱離基の一つであるトリフリル基のトリフルオロメタンスルホン酸のpKaは-15にもなります。
 こめやん
こめやん
脱離能が高い=pKaが低い(酸性度が高い)といえるわけです。
実際にメシル、トシル、トリフリル基のpKaを比較してみましょう。
MsOH pka=-1.86 :Serjeant EP, Dempsey B; IUPAC Chemical Data Series No. 23 New York, NY: Pergamon Press pp. 989 (1979)
TsOH pKa = -1.34 ;Serjeant EP, Dempsey B; IUPAC Chemical Data Series No 23 NY, NY: Pergamon Press (1979)
TfOH pka =-15
pKaを比較するとメシル基のほうが若干脱離能は高いようです。
トシル基の傘高さ
トシル基はベンゼン環があるのに対して、メシルはメチル基のみなのでトシル基のほうがより傘高いです。
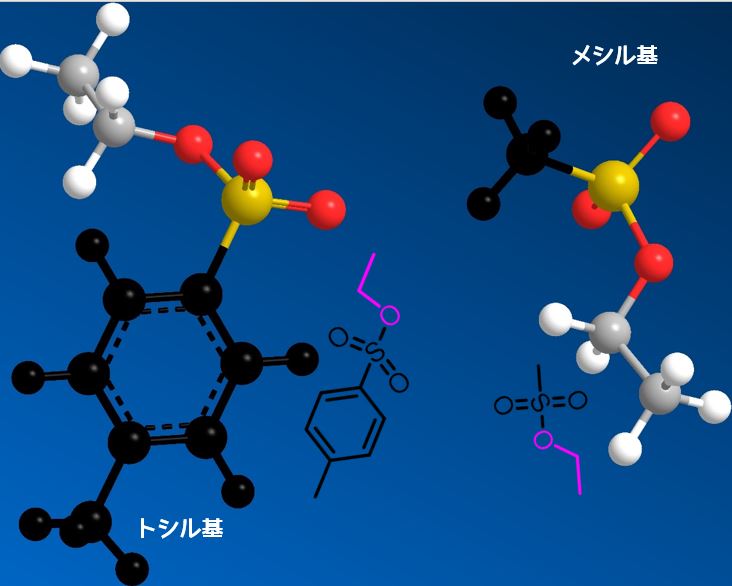
トシル基とメシル基の立体構造
疎水性が高い
トシル基はトルエンを持っているため、疎水性がメシル基よりも高いです。
エタノールのトシル体のcLogPは1.849、メシル体は0.051であり、トシル基のほうが脂溶性が高いです。
結晶性が高い
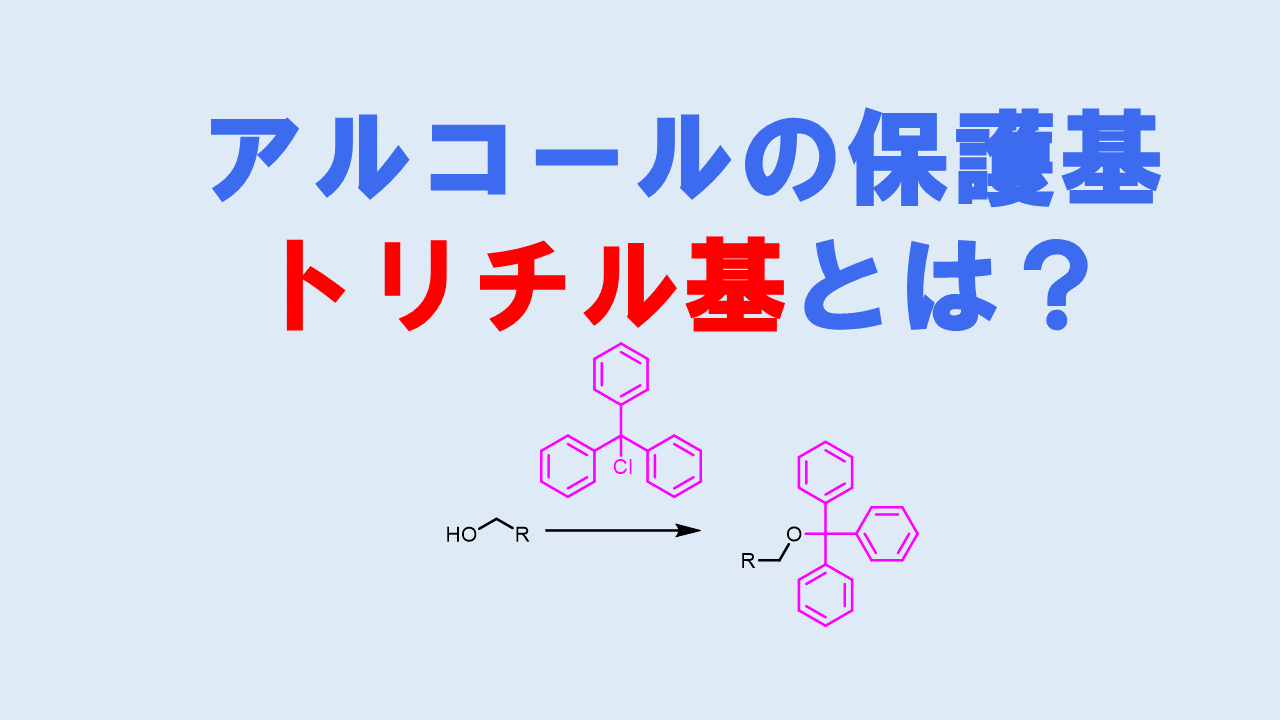
トシル基のように芳香環を持っている化合物で極性基を保護すると結晶性が高くなる傾向があります。水酸基を芳香環を3つ持つトリチル基で保護すると同様に結晶性が高くなります。結晶性が高いと再結晶で精製しやすくなるなどのメリットがあります。
 こめやん
こめやん
トシル化の反応例
トシル化の反応条件として一般的と言われているのはピリジンを塩基として利用した方法ですが、トリエチルアミンを用いた条件もかなり利用されています。反応性が悪い場合はDMAPを加えます。トリメチルアミンを触媒として加える方法も有用です。
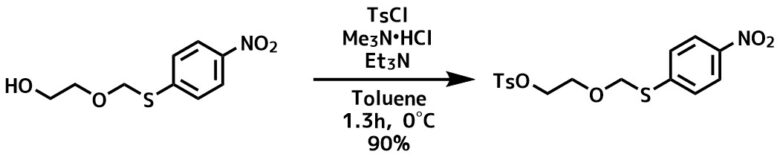
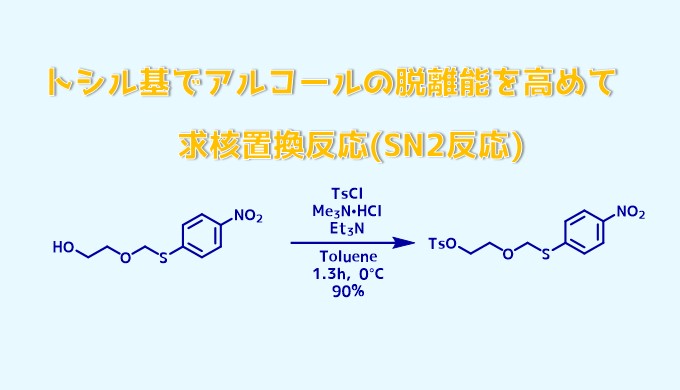
トシル化反応例1トリメチルアミン法, Morgan, Kate F. et al Synlett, 27(1), 106-110; 2016
アルコール (0.13 g、0.57 mmol)をトルエン(2 mL)中に溶解し、トリエチルアミン(0.24 mL、1.71 mmol)およびトリメチルアミン塩酸塩(6 mg、0.06 mmol)を0℃で加えて 0°Cで30分間撹拌しました。 4-トルエンスルホニルクロリド(0.22 g、1.15 mmol)を少しずつ加えて0℃で30分間撹拌した。30分間かけて室温までゆっくり温め、さらに1時間30分撹拌した。水(20 mL)を反応液に加え、生成物をEtOAc(4×20 mL)で抽出しました。後処理をしてカラム生成し、目的物(0.19 g、90%)を得た。
トシル化反応・ピリジン
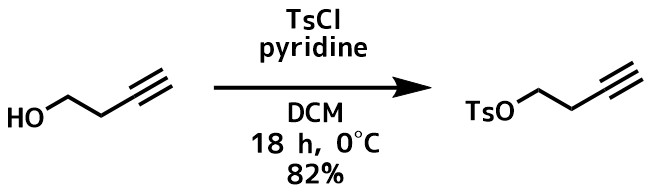
トシル化反応例2ピリジン, Pennell, Andrew Michael Kenneth, “Synthetic studies in the piperazine-2,5-dione area and novel radical substitution reactions” 1990
アルコール(1.04 g; 14.8mmol)、ジクロロメタン(14.5 mL)ピリジン(2.7 mL)の撹拌溶液に0℃でTsCl( 4.08 g; 21.4mmol)を5分かけて少しずつ加えて室温に戻しながら18時間撹拌した。反応後、ジエチルエーテル(45mL)とH2O(10mL)を加え、有機層をHCl(10%; 2mL)、飽和NaHCO3水溶液( 2 mL)、H2O(2 mL)で洗浄し、後処理を行いカラムで精製して目的物(2.71 g; 82%)を得た。
トシルクロライドはあらゆる求核性官能基と反応する可能性があります。求核性の高いものが反応します。フェノールやカルボキシレートとも反応するので選択的に変換したい場合は保護基などを活用しましょう。