ピリジンはヘテロ環のなかでも有名かつ、よく利用する化学物質であるため、ピリジンの化学については学ぶべきところがたくさんあります。同じ含窒素ヘテロ環の中でもピロールとは塩基性の違いについて問われることが多く、窒素上の孤立電子対は芳香環の共鳴に関与しないピリジンはピロールよりも塩基性が強く、この窒素の求核性・塩基性は生体内における生理活性の発現に一役買っています。そんなピリジンの化学についてまとめたので紹介します。
ピリジン環の窒素がピリジンの性質を表している!
ピリジンはベンゼンと同じ六角形(六員環)の環をしていますが、炭素(C)が一つだけ窒素(N)に置き換わっています。原子が一つだけ違うだけですが、両者の性質は大きく異なります。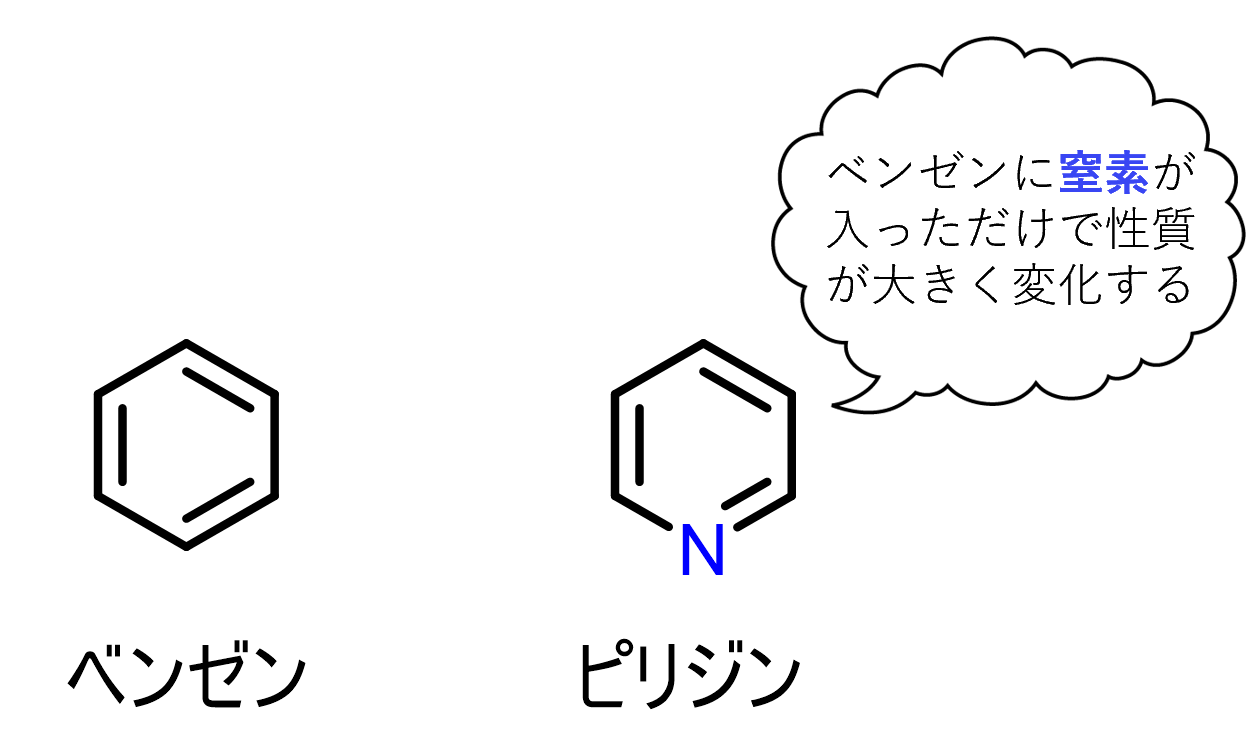 例えばベンゼンはガソリンや油性ペンの様な石油系の臭いがしますが、ピリジンはベンゼンとは似ても似つかない刺激臭がします。例えるならカニやエビが跡形もなくなるまで腐ったような臭いでしょうか?とにかく臭いです。
例えばベンゼンはガソリンや油性ペンの様な石油系の臭いがしますが、ピリジンはベンゼンとは似ても似つかない刺激臭がします。例えるならカニやエビが跡形もなくなるまで腐ったような臭いでしょうか?とにかく臭いです。
 こめやん
こめやん
今回はそんなピリジンについて詳しく解説していきます。
ピリジンの塩基性や沸点ー基本的性質
ピリジンの基本的な性質についてまとめてみました。
| 名称 | ピリジン, pyridine |
|---|---|
| 化学式 | C5H5N |
| CAS No. | 110-86-1 |
| 値段 | nacalai \2,600/500mL |
| モル質量 | 79.1 g/mol |
| 密度 | 0.9819 g/mL |
| 沸点 | 115.2℃ |
| pKa | 5.25(C5H5NH+) |
| 水への溶解度 | 混和 |
| 構造式 | 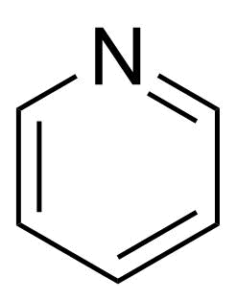 |
ベンゼンは水とは混ざらずに油のように浮いてしまいますが、ピリジンは水と混ざり合います。
ベンゼンとピリジンの違いは窒素原子によるものです。
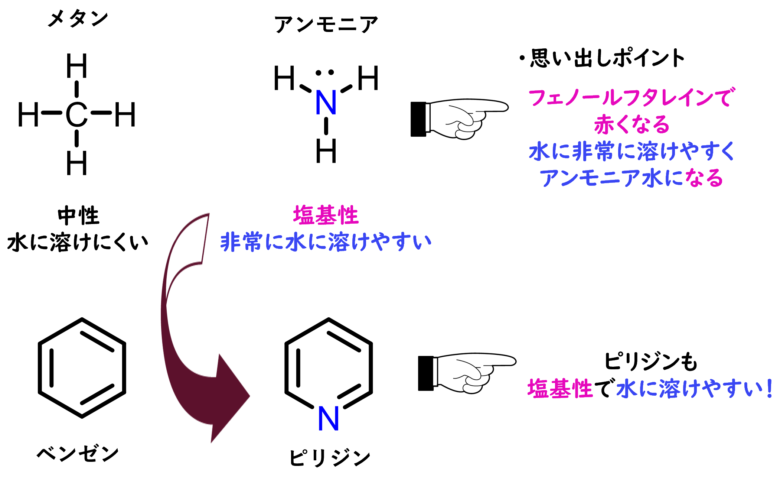
窒素が入ると水に溶けやすくなります。
例えば、メタン(CH4)とアンモニア(NH3)では、メタンは水に溶けにくいですが、アンモニアは非常に溶けやすいです。
また、アンモニア水は塩基性を示すことは有名ですが、これも窒素原子による性質です。
ピリジンも同様に水に溶けやすく、塩基性を示します。
 そんなピリジンは自然のどこに存在しているかというと、石油中にあるようです。また私達生物の身体の中にもピリジンの構造が入った化合物が存在しています。
そんなピリジンは自然のどこに存在しているかというと、石油中にあるようです。また私達生物の身体の中にもピリジンの構造が入った化合物が存在しています。
そんなピリジンですが研究・有機合成ではよく使われる化学物質です。使ったことがあるという人も多いと思います。
wikipediaによると皮膚に付着するとメラニンと反応を起こして色素沈着するらしいですが、私はなったことがありません。
ピリジンとピロールの塩基性
ピリジンはπ電子不足系ヘテロ六員環化合物に分類されます。π電子不足系というのはベンゼンなどの化合物と比べると、電気陰性の窒素原子がベンゼン環上に存在しているため、環の電子が引っ張られることによってπ電子密度がベンゼンよりも低くなっているため、π電子不足系です。
5員環のピロールは、窒素の孤立電子対が環に流れるので、6π電子が5つの炭素環上にあるため、ベンゼンよりも電子密度は高く、π電子過剰系に分類されます
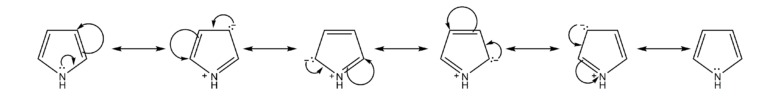
ピロールのように窒素上の孤立電子対が6π電子形成に関与していないので、ピリジンは孤立電子対が窒素上にあり、塩基性が保たれています。といっても、ピリジンの塩基性は脂肪族アミンと比べると弱いです。これは、ピリジンの窒素はSP2混成軌道であり、S性が大きいからです。
ピロールが水に溶けにくくピリジンが水溶性を示す理由
アンモニアの例のように窒素が水溶性を示す原因となっていますが、同じ窒素を持つピロールは水に溶けにくく、有機溶媒に溶けやすいです。一方でピリジンは水に溶けやすいのはなぜなのでしょうか?
ピリジンが水とけるのは下図の右側のようにピリジン環の窒素原子が水と水素結合をするためです。このように電気的にマイナスな窒素や酸素原子はプラスに分極した水の水素原子と水素結合します。
ならば、窒素や酸素をピリジンにもっと入れれば水溶性がもっと向上するかというとしない場合があります。例えば、図左側のようにピリジンの2位にOHやNH2が存在すると分子内で水素結合が形成されるため水溶性は低下します。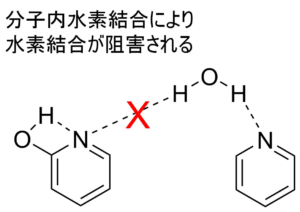
ピロールが水に溶けにくいのア、ピロール窒素上の電子が環に非局在化していることが原因です。水分子の水素と水素結合できる電子が窒素上にないので水素結合できなくなり、水に溶けにくくなります。
このような分子内水素結合は芳香族化合物の1,2置換体ではよく見られます。化学反応性にも影響するので心に留めておくと後に役立つかもしれません。
ピリジンの化学的安定性-還元に弱い?
ピリジンは同じヘテロ六員環化合物と比べると酸、塩基に安定で加水分解されにくいです(ピリミジンは塩基性条件に弱く、加水分解される)。
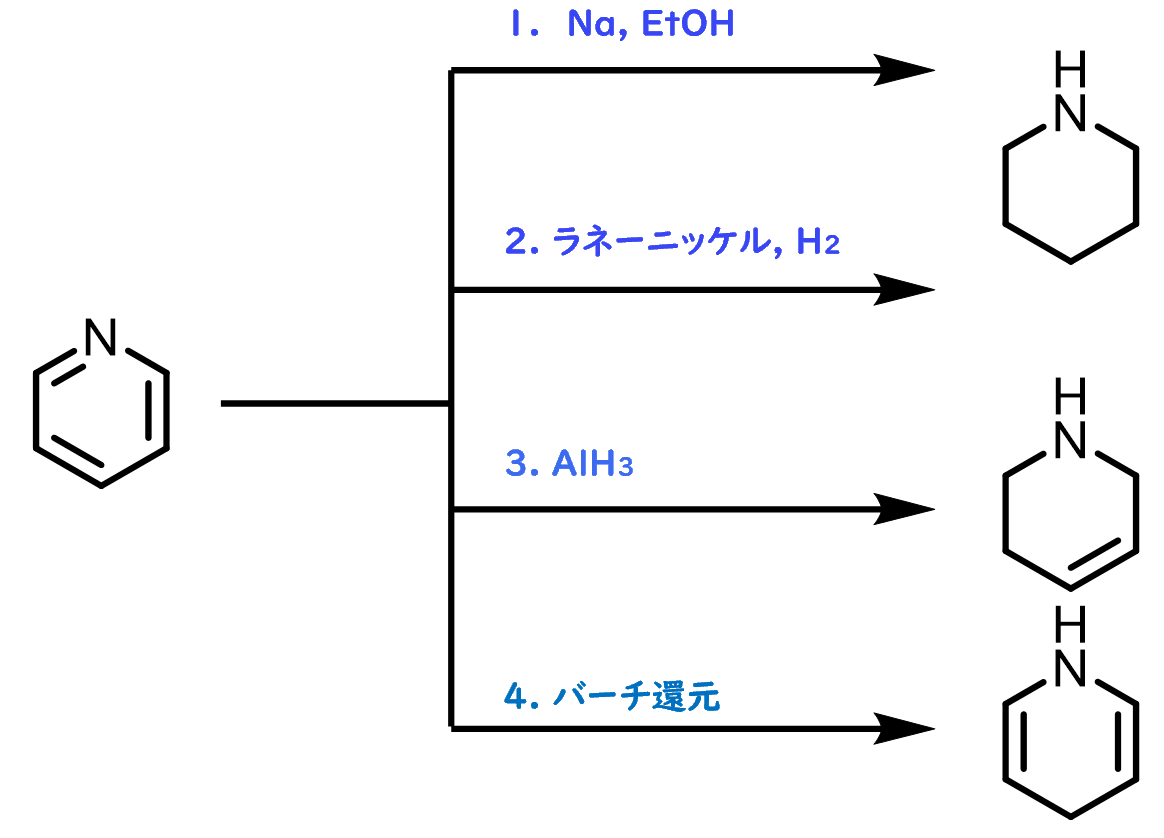
また、ピリジンは酸化には強いですが還元には弱いです。アルコール溶液中でナトリウムを作用させたり、ラネーニッケルによる水素化によってピペリジンに還元されます。また、やアラン(水素化アルミニウム)では二重結合が1つ残った1,2,3,6-テトラヒドロピリジンに還元され、条件にもよりますが、バーチ還元では1,4-ジヒドロピリジンに還元されます。
NMRのシフト値

NMRではピリジンの2位(Nのオルト位)水素が最も低磁場に現れます。これは窒素原子による電子求引性によるものです。(右はピリジンN-オキシド)
天然物や医薬品に存在しているピリジン
ピリジンが含まれる構造をまとめてみました。有機合成でもよく使われます。ピリジンの他に2,6-ルチジンや触媒として使われるDMAP、配位子としてビピリジンや酸化剤として有用なPCC、弱酸性触媒のPPTSなどがあります。どれもよく利用されるものです。
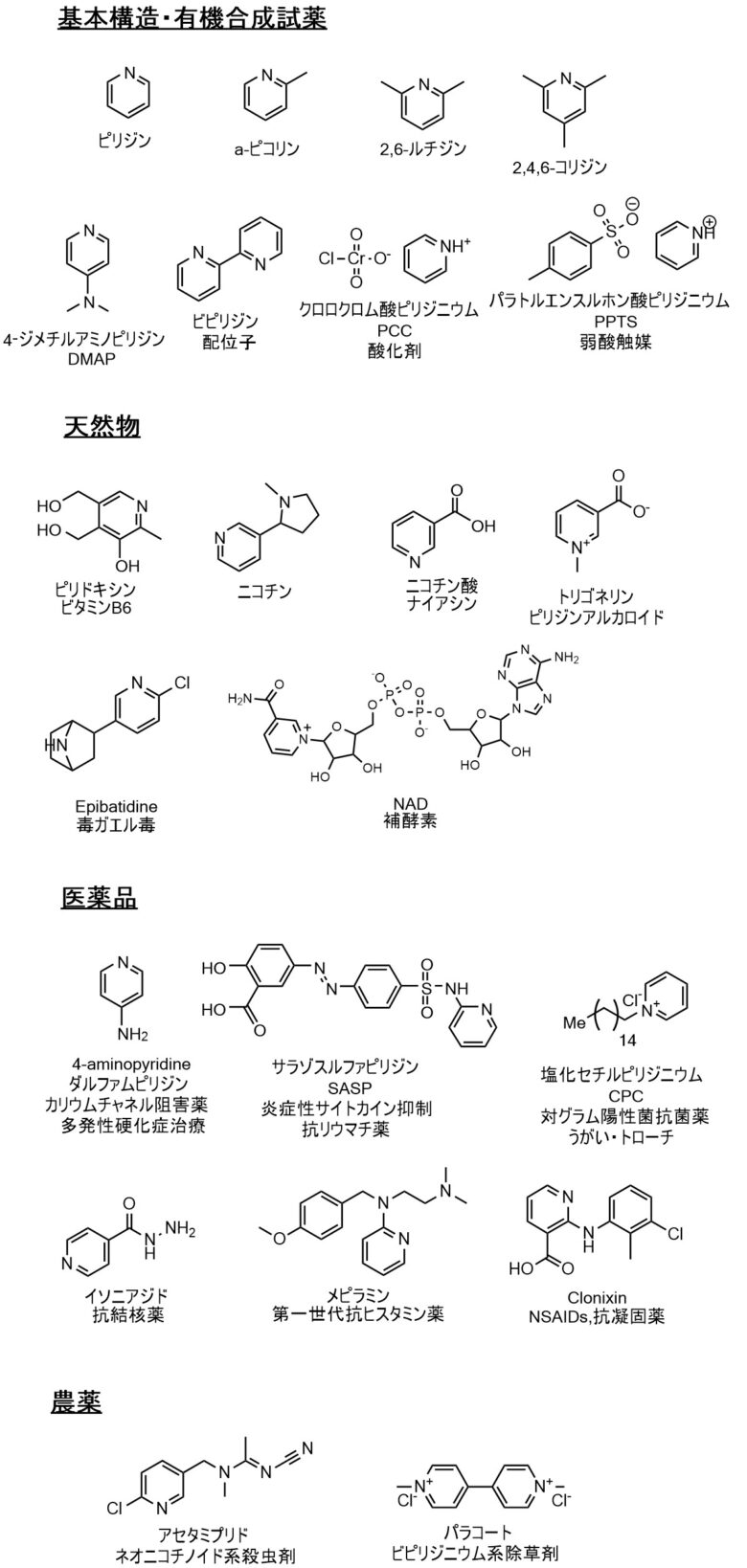
ピリジンの構造は天然物中にも見られます。生体内の重要な物質としてはビタミンB6やNADなどがあります。医薬品にもピリジンの構造はみられます。4位にアミノ基が入っただけのダルファムピリジン(4-アミノピリジン)はとても簡単な構造ですが医薬品として多発性硬化症の治療に使われています。農薬にもその構造が見られています。タバコの成分であるニコチンには殺虫効果があることが知られていて、より強い殺虫効果を求めて構造展開していった結果、ネオニコチノイド系と呼ばれる殺虫剤が生まれました。除草剤として有名なパラコートもピリジン構造を含んでいます。
 こめやん
こめやん
生合成経路ーキヌレン経路
ピリジン環が存在する生体内物質がたくさんあると紹介しましたが、一体このピリジンはどこから来るのでしょうか?実はピリジン誘導体はアミノ酸のトリプトファンからキヌレニン経路によって生合成されます。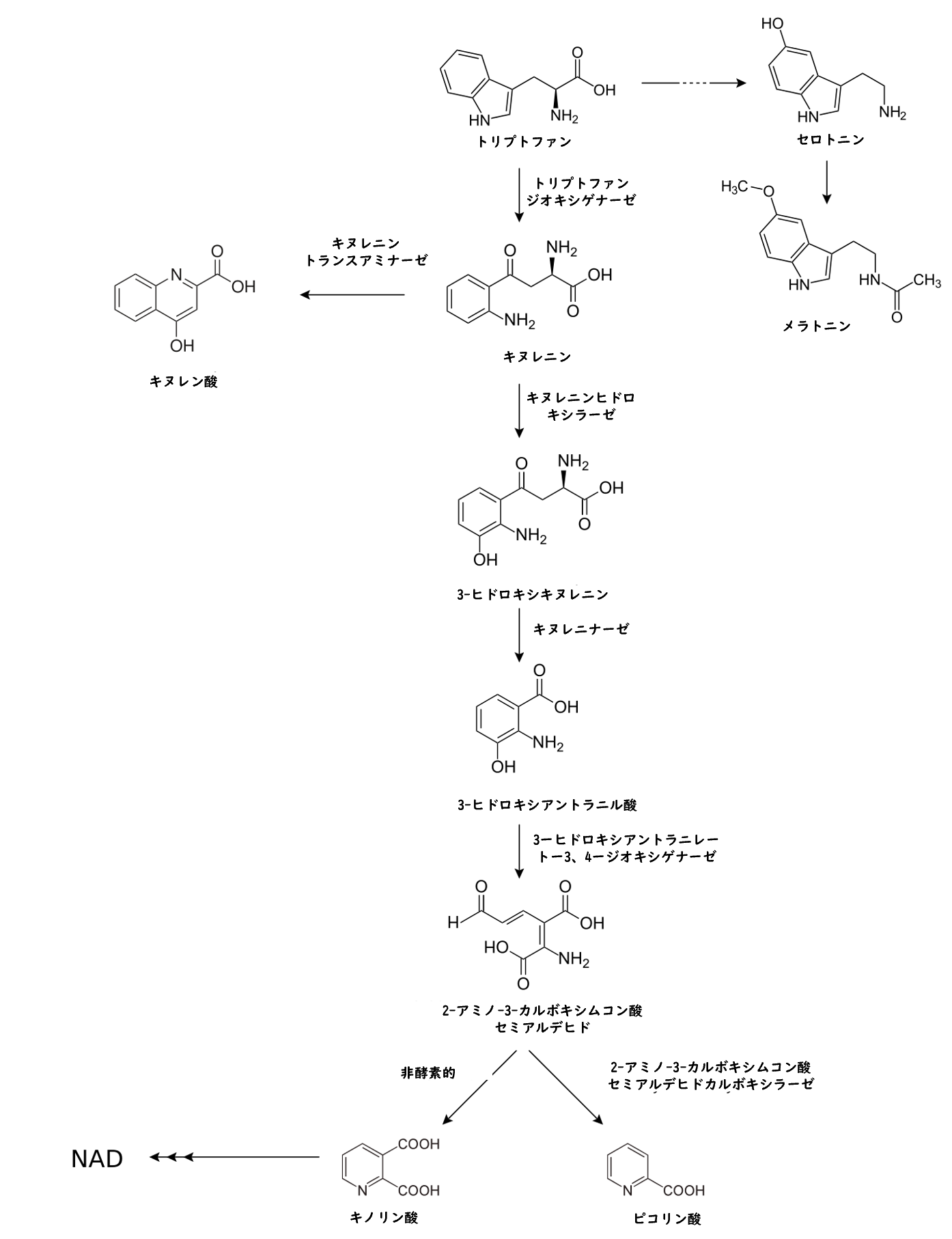
NADもキヌレニン経路から生合成されたキノリン酸またはニコチン酸(ナイアシン)によって作られます。
怒りっぽい人は牛乳を飲め!と言われますが、これは牛乳に含まれるトリプトファンが心を落ち着かせる作用をもつセロトニンやメラトニンを作る原料となっているためです。セロトニンやメラトニンは脳内で働く神経伝達物質で、睡眠などに関わっています。
有機合成ーピリジン合成
ピリジン環の構築
Bohlman-Rahtz ピリジン合成
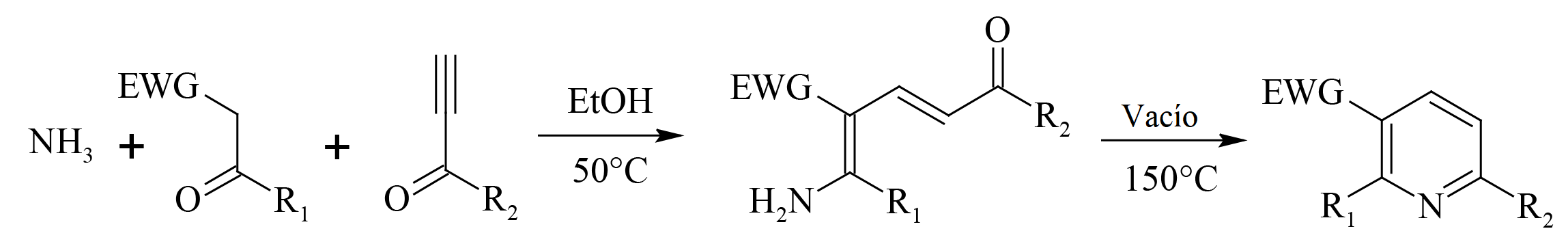
エナミンとエチニルケトンとを加熱し得られた中間体を脱水環化して得られる。
チチバビンピリジン合成
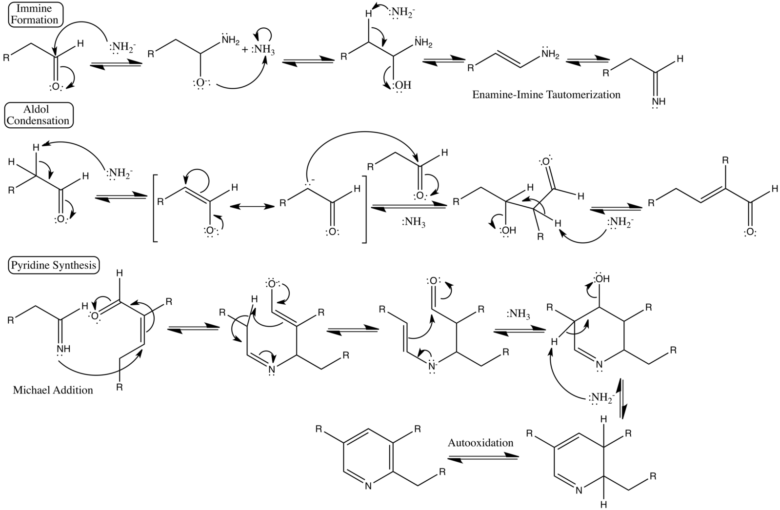
1924年にチチバビンによって報告されたアルデヒドとアンモニアを用いてピリジン環を構築する反応です。
Hantzsch Dihydropyridine 合成

二当量のβ-ケトエステル(1)とアンモニア、アルデヒドを縮合させることによってジヒドロピリジン誘導体の合成を行う。得られたジヒドロピリジン誘導体(5)を酸化により、ピリジン-3,5-ジカルボキシレートとし、脱炭酸によって、対応するピリジンが得られます。
この反応はケトエステルとアンモニアにより得られるエナミン(6)とアルデヒドとケトエステルとのKnoevenagel縮合(3+4→7)により得られるα,β-カルボニル体(7)が中間体です。
このエナミン(6)のα,β-カルボニル(7)へのマイケル型付加反応により脱水環化を経てジヒドロピリジン体が得られます。
ピリジンの反応性
芳香族求電子置換反応
ピリジンは電子豊富な環にも関わらず、芳香族求電子置換反応は進行しにくいです。
芳香族求電子置換反応で反応するのは3位です。
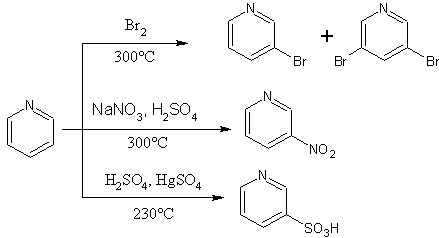
ピリジンへの芳香族求電子置換反応は高温の激しい条件でないと進行しません。
ニトロ化は硝酸ナトリウムと硫酸を300℃に熱する必要があります。
スルホン化は厳しい条件ではありますが進行しやすい部類です。このようにピリジンの反応性が低い原因の一つがピリジンのプロトン化です。ニトロ化やスルホン化などの芳香族求電子置換反応は酸性条件で進行させることが多く、この酸が塩基性のピリジン窒素と反応してプロトン化してしまうことで環の電子密度が小さくなり反応性が低下してしまいます。同じ原理でフリーデルクラフツーアシル化なども進行しません。(AlCl3が窒素に配位するため)
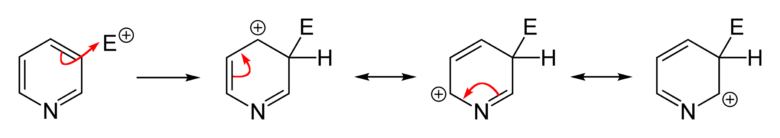
ピリジンは3位置換が優先して起こる

4位置換体の経路では電気陰性な窒素上にプラスの電荷がつく不利な共鳴式が登場するため進行しにくいと考えられる
ちなみにピリジンの芳香族求電子置換反応は3位で進行しやすいです。原理は共鳴式を書くとわかります。4位に置換した場合は、電気陰性なピリジン窒素が正電荷を帯びる不利な共鳴式を含みますが、3位に置換した場合ではこのような不利な共鳴式は含まれません。
求電子置換反応を進行させるには2位など、アルキル基やアミノ基などの電子供与基を導入することによって進行しやすくなります。特に2,6位の置換基が嵩高いなど、求電子試薬の窒素への配位を阻害すると反応性は上がります。
ピリジンN-オキシドは共鳴式をみるとわかるようにピリジンとは共鳴が異なり、4位の電子密度が高いです。そのため、ピリジンN-オキシドは4位で芳香族求電子置換反応を起こしやすいです。
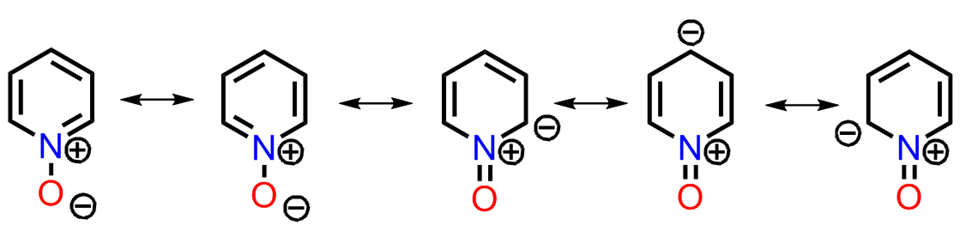
4位置換体を作りたいときはピリジンをN-オキシドに変換してから行うと良いでしょう。
芳香族求核置換反応
芳香族求電子置換反応と比べて芳香族求核置換反応(SNAr)は進行しやすいです。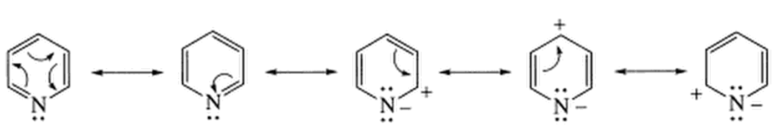
ピリジンの共鳴式をみると環状に正電荷が局在しています。これからも分かる通り、SNAr反応は2位と4位で起こります。ピリジンとナトリウムアミド(NaNH2)を反応させると2-アミノピリジンが高収率で生成します。
ピリジンの用途のまとめ
溶媒(弱塩基性でよく溶かす溶媒として)
ピリジンは活性プロトンを持たず極性が高いため、非プロトン性極性溶媒として利用できる。沸点が高い(115℃)ため少し苦労しますが減圧下で留去することが可能です。極性が高く難溶性のものが多い糖類(核酸系も)ではよく溶媒として利用されます。しかし、塩基性・求核性があるため使用できる場面は限られています。
逆にこの反応性を利用する場合もあります。例えば、ヒドロキシ基のアセチル化など求核アシル置換反応では、無水酢酸とピリジンが反応して生成する反応性の高い中間体は水酸基との反応を加速させます。ヒドロキシ基の水素を奪う塩基としての機能も果たすため一石二鳥です。
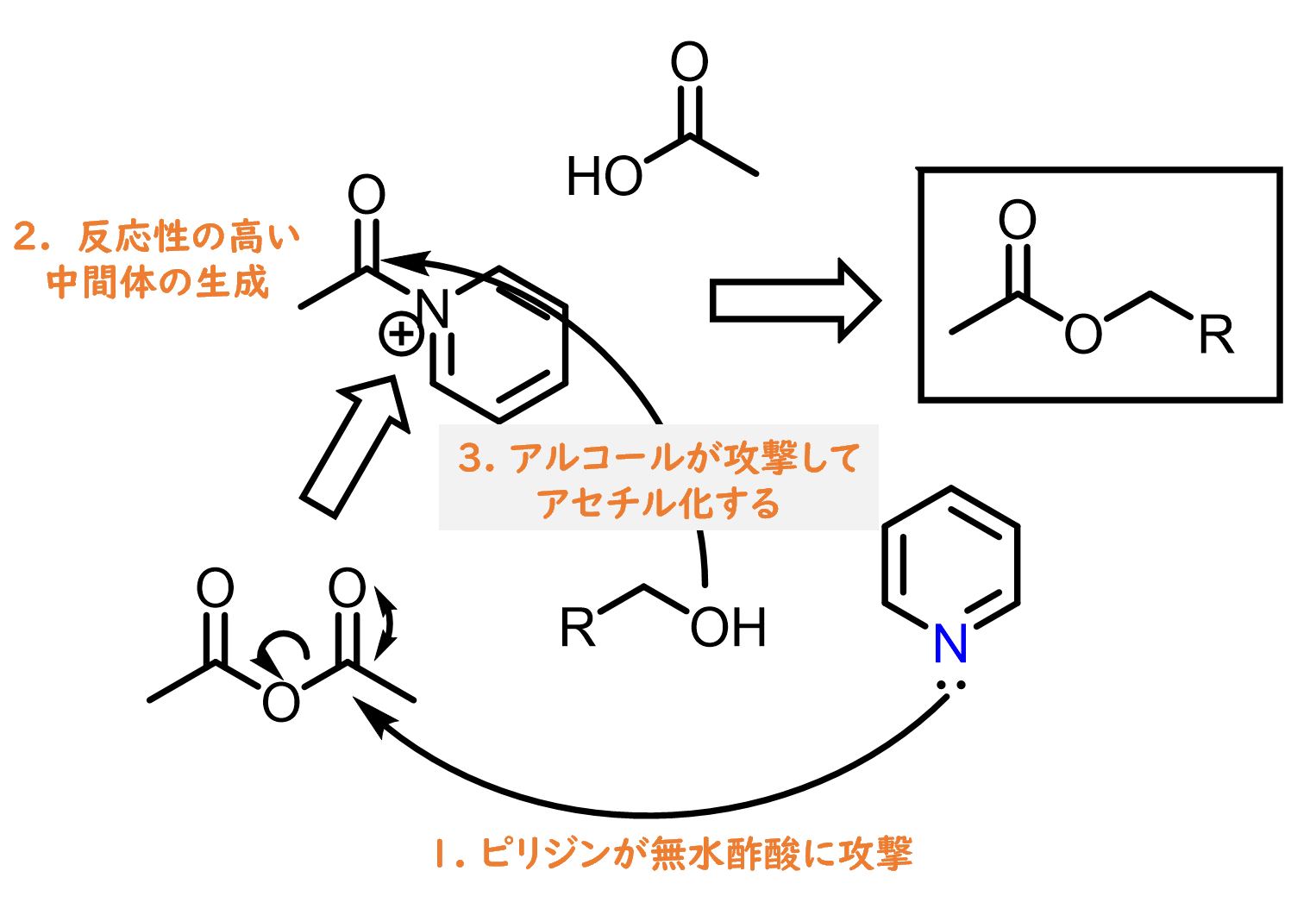
共沸で水を除去
ピリジンは水と共沸点93℃で共沸します。水との共沸混合物の質量比は(58:42=ピリジン:水)です。共沸溶媒としてはトルエンが良く用いられると思いますが、極性が低いため溶解しにくい化合物が多くあると思います。トルエンを用いると化合物中に水が残って水の抜けがわるいことがあります。そんなときピリジンを用いると溶解しやすく、共沸効率も上がります。核酸などの糖類の化合物を反応前に脱水したい時には脱水ピリジンを加えて2,3回エバポで飛ばすことで、化合物中の水を共沸除去します。
ピリジンの除去方法
ピリジンはアセチル化など特定の反応では溶媒として用いることも多いです。反応後にはピリジンを取り除くためにエバポレーターで飛ばすか分液によって水層に除去するという2つの選択から適したものを選ぶことになるでしょう。ピリジンは熱(50-60℃)をある程度かけて減圧すれば留去できます。大量にピリジン(数百mL以上)を使用した場合はなるべく留去した方がよいです。一方で、熱をかけると壊れそうな場合やポンプの性能が悪くて飛ばせないという場合は分液によって取り除きます。
分液操作は、酸性水溶液でピリジンを塩にして水への溶解性を上げて除去します(ピリジンは水溶性ですが、有機溶媒にも溶けやすくそのままでは有機層に残こりやすいため)
- 化合物が酸に弱い場合
- 標的物の水溶性が高い場合
- 塩基性の官能基がある場合(酸性にして塩になると水層に行ってしまうため)
は分液除去は諦めたほうが良いかもしれません。酸性物質は薄い塩酸(0.5-1M HCl)や硫酸水素ナトリウム、クエン酸、硫酸銅などをつかいます。
硫酸銅を使った除去法
反応後の反応液を適当な溶媒(酢酸エチル、ジクロロメタン、トルエンなど)で希釈し、飽和硫酸銅水溶液(最初は飽和しすぎると沈殿が生じるので水で希釈する)を加えます。撹拌すると硫酸銅水層がピリジンと反応して濃い青色に変化します。濃青色に変化しないくなるまで繰り返します。