過酸化物の代表は「過酸化水素」です。
オキシドールと聞くともうすこし身近に感じるかもしれません。
オキシドールに二酸化マンガンやレバーを加えると気体酸素が発生する実験は有名すぎるものです。
このように過酸化水素は中学校あたりからでも登場する化学物質ですが実は中高だけでなく大学、大学院まで活躍?する奥が深い分子でもあります。
過酸化物は簡単に捉えれば「酸化」にかかわる物質であり、大学レベルになると「ラジカル反応」に関わってきます。
この過酸化物についてなるべく簡単にできるだけ専門的に紹介していきます。
過酸化物とは何か?
過酸化物とは化学構造中に酸素ー酸素結合があるものを過酸化物といいます。過酸化物の代表例は消毒薬や漂白剤として使われる過酸化水素や過酢酸があります。薄い過酸化水素水はオキシドールという別名で呼ばれることもあります。
過酸化物はとても不安定でオキシドールとして消毒薬として使っている過酸化水素ですら高濃度では爆発の危険があります。実際に過酸化水素が原因と思われる事故なども起きています。不安定というのはそれだけ反応性が高いということでもあり、
過酸化物が不安定な理由は酸素ー酸素結合が切れやすいのが原因です。
化学構造式でみた過酸化物
化学構造式で見た時、過酸化物には「O-O」の構造があります。酸素ー酸素結合はペルオキシド構造、パーオキシド構造、ペルオキシ基と呼ぶこともあります。
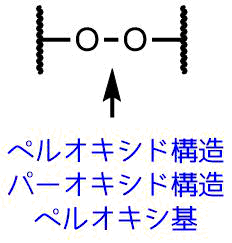
このペルオキシド構造を含むものを「過酸化物」と呼びます。
過酸化物とは一つの物質を指すものではなく、複数の物質を表す総称です。
ここでもう一度「過酸化水素」の構造を見てみましょう。
下の図を見ていただければお分かりだと思いますが、過酸化水素にはOーO結合を含んでいるので過酸化物ということになります。
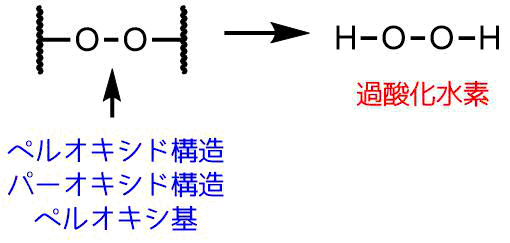
過酸化水素の構造
過酸化物の「過酸」は過剰に酸素があるというニュアンスですね。
もちろん過酸化水素以外もたくさんの過酸化物があります。
過酸化物かどうかを名前で見分けるポイント!
物質名に「ペルオキシ~」とか「パーオキシ~」「過~酸~」というような名前がついている。
有名な過酸化物を紹介します。
- 過酸化水素→消毒・漂白
- クメンヒドロペルオキシド→クメン法の中間体
- 過炭酸ナトリウム(過酸化水素と炭酸ナトリウムの付加体)→お掃除・漂白
- 過酸化ベンゾイル → ラジカル開始剤
- 過酸化アセトン → 爆発物
- 過酢酸 → 強力な消毒薬

過酸化物一覧
過酸化物の分類
過酸化物にはどのような分類があるのか紹介します。
- ヒドロペルオキシド (R-OOH)
- ペルオキシド (R-OO-R’)
- 過酸 (RCOOOH)
- ペルオキシエステル (RCOOOR’)
- ジアシルペルオキシド (RCOOOCOR’)
が主な分類です。
先ほど例に挙げた物質を分類すると以下のようになります。
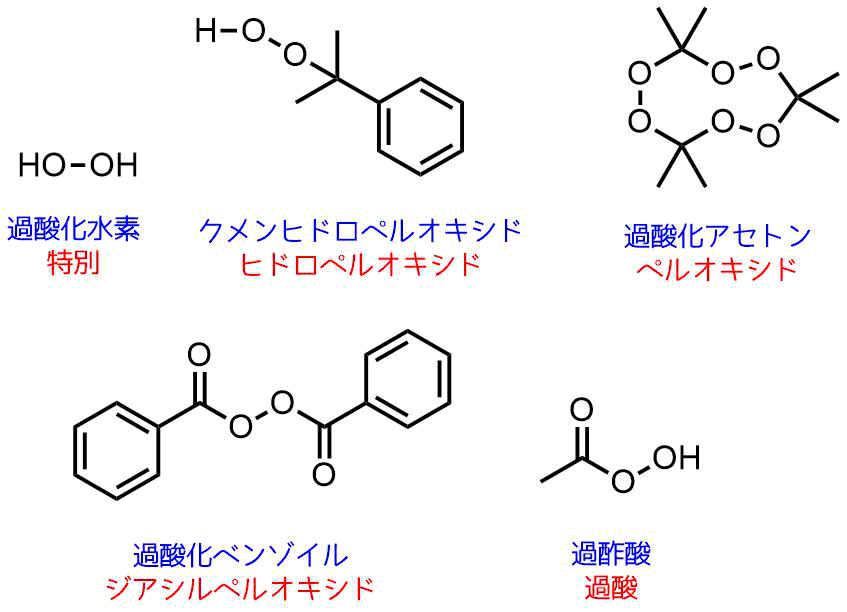
過酸化物の分類
過酸化物の化学的性質や特徴は?
過酸化物の特徴は「O-O」結合に由来しています。
この酸素ー酸素結合は非常にもろく切れやすいです。
切れやすい結合をもつ→反応性が高い→急激に結合形成しやすい→爆発する
酸素2つを持つ→酸化
酸素ー酸素結合の強さはどのくらい?
そもそも原子と原子の結合はその組み合わせによって、「強い結合」や「弱い結合」など様々です。
結合の強さを表す「結合解離エネルギー」というものを比較してみると結合力の強弱を数字で比較できます。
水素化物の同じ元素間の結合解離エネルギーを比較すると水素ー水素結合や炭素ー炭素結合は安定ですが、同じ原子でも酸素ー酸素結合は結合解離させるのに必要なエネルギーは最も小さく、切れやすいことがわかります。
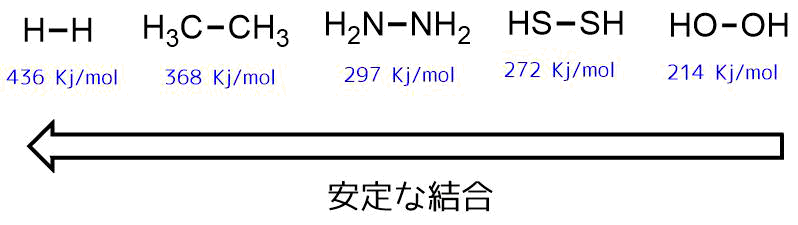
結合解離エネルギーの比較 Luo, Yu-Ran. Comprehensive handbook of chemical bond energies. CRC press, 2007.
酸素-酸素結合が弱いことが理解できたと思います。
過酸化物は爆発しやすい
過酸化物は反応性が高く爆発性があります。
ですから爆発させないように配慮が必要です。
爆発させないようにするための注意点は
- 衝撃を与えない
- 鋭利なものを避ける
- 大量に使わない
- 直射日光などをさける
- 熱を与えない
- 濃縮しない
- 金属との接触をさける
などの工夫が必要です。
過酸化物の存在はヨウ素の遊離で確かめる
過酸化物があるかどうか?については、ヨウ化カリウム水溶液あるいはヨウ化カリウムでんぷん紙に付着させると、無色のヨウ化カリウム溶液が酸化されて単体のヨウ素を遊離します。
ヨウ素は茶色(でんぷんに触れると青色)なので視覚的にその存在を確認できます。この方法は他の酸化剤でも使える手法です。
参考 ADVANTECH ヨウ化カリウムでんぷん紙取得できませんでした
酸素系漂白剤の正体ー過酸化水素でなぜ漂白される?
日常使われている漂白剤は大きく分けて次亜塩素酸などを使った「塩素系漂白剤」と過酸化水素をつかった「酸素系漂白剤」の二種類があります。
塩素による漂白は良く知られたものですが、過酸化水素による漂白はなぜ起こるのでしょうか?
過酸化水素による漂白は「色素成分と過酸化水素が反応して色を持たない物質に変化するから」と予想されますが、意外にそのメカニズムは明確にわかっていないようです。
過酸化水素による漂白のメカニズムは
- ヒドロキシラジカルなどの「活性酸素」によるラジカル機構によるもの
- 過酸化水素アニオンによるもの
二種類が提唱されていますが、後者の機構が有力です。なぜならラジカルトラップ剤を加えて活性酸素を消去しても漂白が進行するからです。アルカリ性では漂白効果が増すことから過酸化水素アニオンによる漂白作用が疑われています。
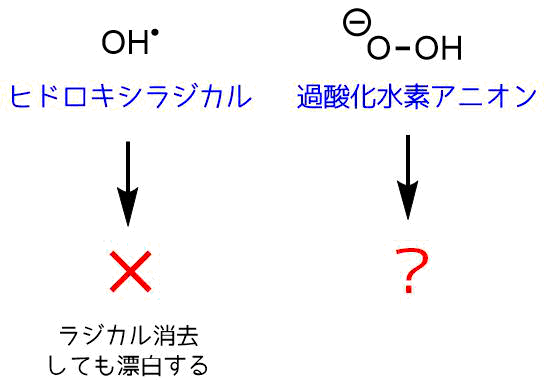
漂白作用の正体
Yamamoto, Nobuyuki, Takayasu Kubozono, and Yoji Kinoshita. “過酸化水素によるアントラキノン系染料の酸化的分解機構 (原標題は英語).” Journal of oleo science 50.6 (2001): 507-513.
過酸化物の反応と性質各論
ヒドロペルオキシドの合成法
自動酸化でヒドロペルオキシド合成
ヒドロペルオキシドは過酸化物のなかでも高い反応性持つ化合物です。有名なヒドロペルオキシドはフェノールとアセトンの工業的製法であるクメン法における中間体である「クメンヒドロペルオキシド」があります。
クメンヒドロペルオキシドはクメンの自動酸化により生成します。
自動酸化は空気中の酸素(ビラジカル)による反応によるもので、ヒドロペルオキシド合成の一つの方法です。
脂質の酸敗は自動酸化によって過酸化脂質(ヒドロペルオキシド)の生成することで起こります。
ラジカルはゆく当てのない一個だけの電子です。反応性が高くどこかの電子を一つ奪って結合を作りたがります(電子2個で結合一つを作れる:C-C→C:C)。これが水素引き抜きです。さらにラジカルがあればお互いに出し合って結合をつくります。これでヒドロペルオキシドが生成します。
自動酸化はヒドロペルオキシド合成法の一つです。
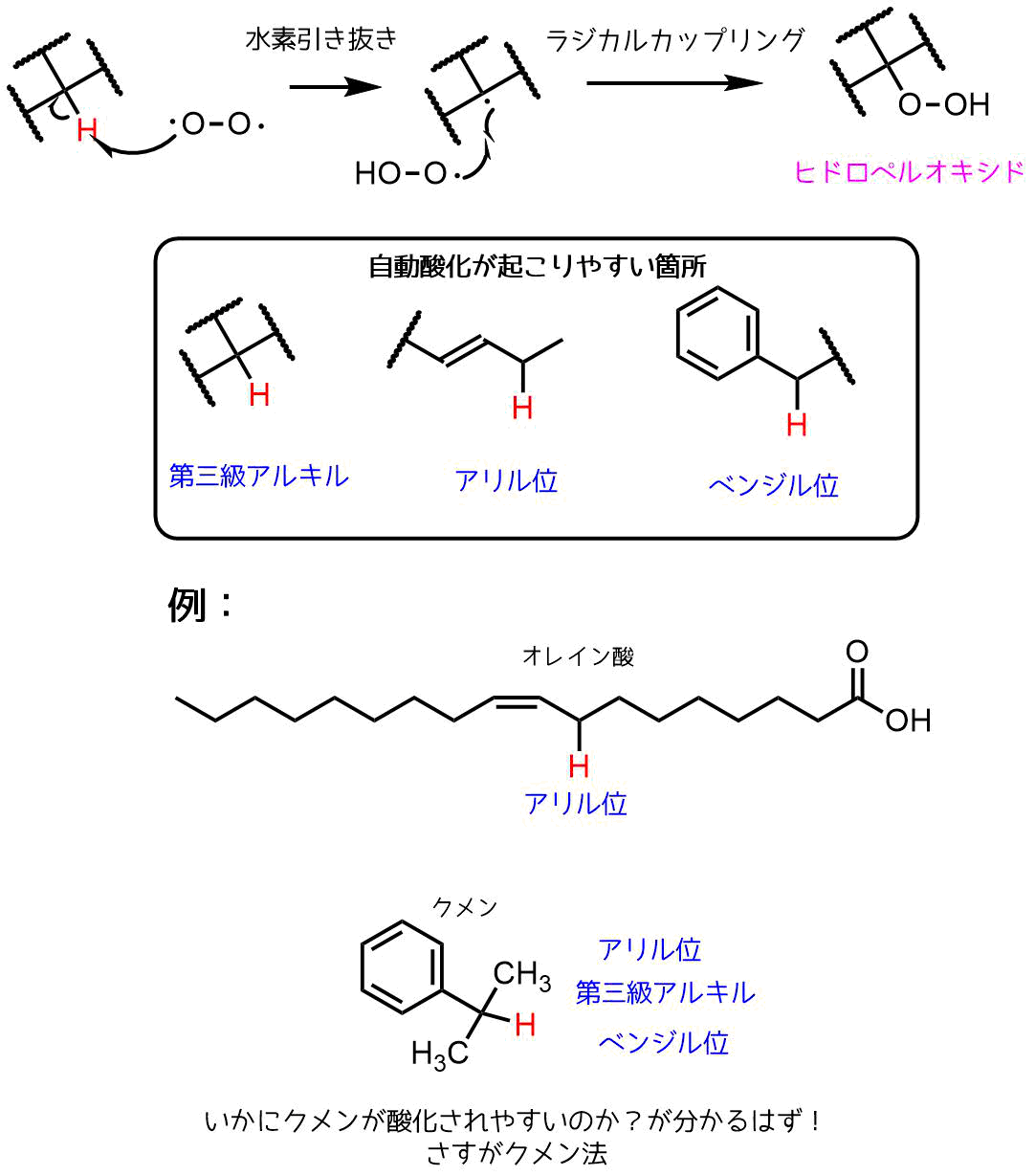
ヒドロペルオキシドの合成法ー自動酸化
自動酸化によりヒドロペルオキシド合成が可能な構造としては
- 第三級アルキル
- アルケン
- ケトン
- アミン
- エーテル(環状エーテル、アセタールも)
があります。
隣の炭素にヘテロ原子があっても自動酸化をうけやすいです。カルボニル化合物もその一つでベンズアルデヒドが酸化しやすい理由の一つです。
エーテルが過酸化物を作りやすいのは有機合成では有名な話で、テトラヒドロフランやジメトキシエタンは過酸化物を作りやすいものの一つです。
アルキルハライドと過酸化水素で合成
アルカリ性条件下で過酸化水素はヒドロペルオキシドアニオンを生成します。このアニオンは反応性が高く、アルキルハライドのような求電子剤と反応してヒドロペルオキシドを生成します。一般的にヒドロペルオキシドは第三級アルキルのほうが安定であるため、反応はSN1で進行すると考えられ、酸条件下でも進行します。
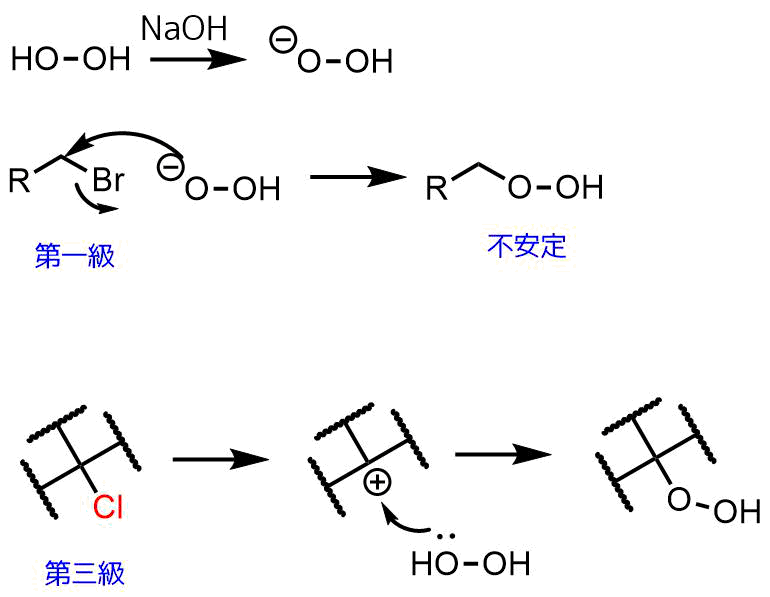
ヒドロペルオキシド合成-過酸化水素との反応
脱離基としてはハロゲンだけでなくトシル基などのスルホナートなどもOKです。第三級アルコールなどもOKです。
ヒドロペルオキシドの性質や反応
ヒドロペルオキシドは弱酸性を示し、求核性を持ちます。
ヒドロペルオキシドは過酸化水素と同じようにアルキルハライドと反応してペルオキシド(ROOR)を生成します。これがペルオキシドの合成法の一つです。
塩基性条件下カルボン酸とも反応して過酸エステルを生成します。
過酸の性質と反応
過酸は、過酢酸のように消毒薬としての用途以外にも有機合成にもよく使われる重要な分子です。m-クロロ過安息香酸(mCPBA)などがその例です。
- バイヤー・ビリガー酸化
- プリリツェフエポキシ化
などが有名です。
過酸の反応の特徴は、過酸の末端酸素の求核性とペルオキシド結合の開裂が起こりやすいことに由来します。バイヤービリガー酸化はその代表例です。
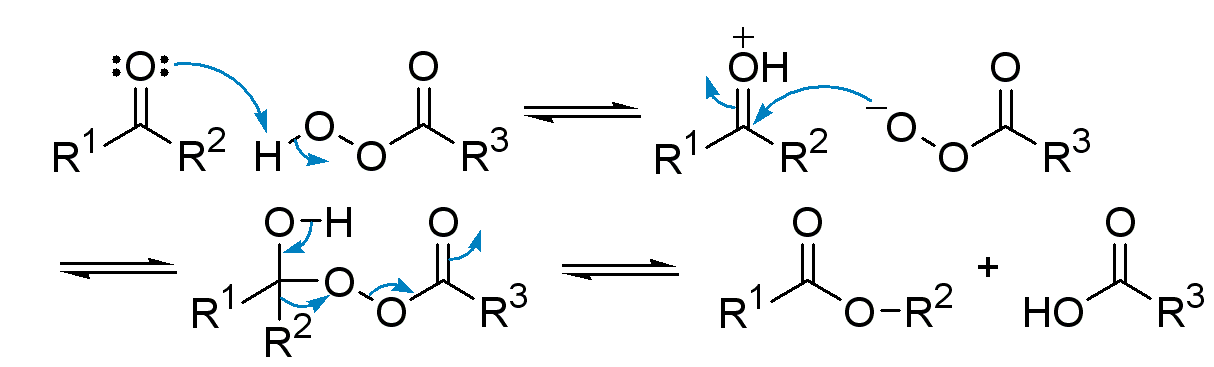
バイヤービリガー酸化の反応機構 from wikipedia public domain
ジアシルペルオキシドの性質と反応
ジアシルペルオキシドの代表例である過酸化ベンゾイルは過酸結合がホモリシスしやすいため、ラジカル開始剤として利用されています。
それだけ反応性も高いということなので注意が必要です。危険物第五類の自己反応性物質の代表例ですね。





