自動酸化は大気中の酸素によっておこる酸化反応のことで、フリーラジカル機構で起こっています。
食品では脂質が自動酸化を受けることが知られています。
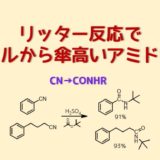
有機合成ではアルケンやエーテル類(THF等)、アルデヒド類(ベンズアルデヒド等)は自動酸化を受けやすい物質として有名です。
自動酸化を理解するためにはラジカルを知る
自動酸化は酸素分子によって起こる酸化反応で、フリーラジカル機構というメカニズムで起こっています。
そのため、自動酸化を理解するためには、酸素分子とラジカルについて理解する必要があります。
ラジカルとは?
ラジカルは不対電子を持つ化学種のことです。
ラジカルはメタンを例にとってみるとわかりやすいです。
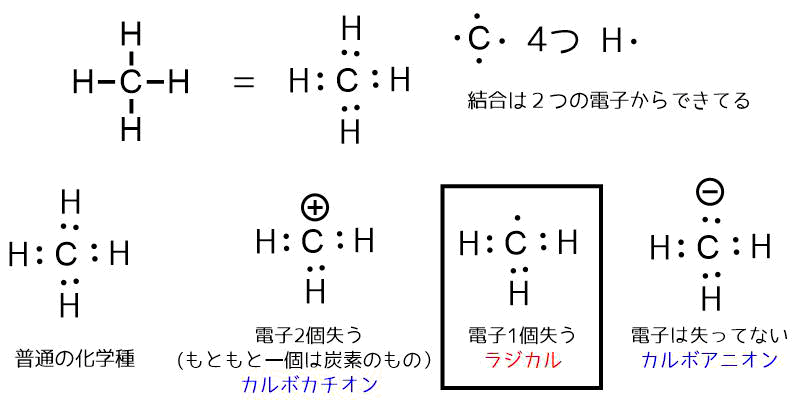
ラジカル種の構造
メタンは価電子4つの炭素と1つの水素4つからなる分子です。ルイス構造式で書くと、結合に2つの電子が関わっているのがわかります。
この電子から水素が2つの電子を奪って脱離すると、炭素は電子を2つ失い(これはもともと持っている炭素の電子1つを失ったことになる)、形式電荷がプラスのカルボカチオンが生成します。
一方で水素が電子を奪わずに脱離すると炭素は元あった電子よりも一つ多くの電子を得たカルボアニオンが生成します。残った電子は2つの電子で対になっているので「孤立電子対」と呼びます。
ここで、もしも水素が電子一つだけを持って脱離したら、炭素には1つの電子が残されます。これを「不対電子」と呼びます。
このような不対電子を持つ分子をラジカル(フリーラジカル)と呼びます。
形式電荷=価電子数–ローンペア数×2–共有結合数
酸素分子は二重結合でラジカル?
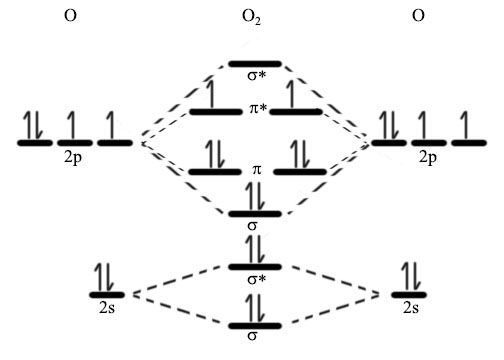
酸素分子O2の分子構造を電子を含めて理解するのは意外と難しいです。これにはオクテット則だけでなく、分子軌道の概念を理解する必要があるからです。
結論から言うと酸素は二つの不対電子を持つビラジカルであると考えられています。

酸素はビラジカル
なぜ酸素がビラジカルなのか?ということが気になる方は下のとじを空けてください
「あれ?二重結合じゃないの?」と思った人もいるかもしれません。
酸素分子をはO=Oの二重結合で結合していると学んだ人も多いのではにでしょうか?
オクテット則に従えば確かに二重結合になります。しかも構造を見ると酸素原子間が単結合であるとされる過酸化水素「H-O-O-H」のO-O結合の距離は1.475Åであり、酸素分子O2同士の距離は「1.207Å」とより短くなっていることからも酸素分子の二重結合説は支持されそうです(原子間距離は短いほど結合が強い→多重結合の可能性)。
しかし、酸素分子には二重結合であると考えると説明しにくい現象がいくつか知られています。
そのうちの一つが磁性です。磁性を持つ分子は「不対電子」を持つはずだからです。
これを理解するにはこれまでの原子価結合法に代わって分子軌道法の考え方を用いる必要があります。
分子軌道法は原子価結合法とは異なる考え方なので別物として考えると混乱しにくいです。
酸素原子には1s(2),2s(2),2p(4)の電子があります。この原子2つの分子軌道は2s,2pを考えます。
p軌道はpx,py,pzの3つがあります。
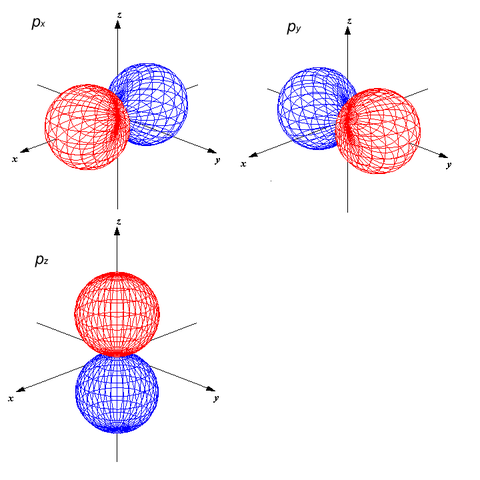
From wikipedia by Azu [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/4.0)]
これを分子軌道で表すと2p軌道には軌道エネルギーが小さいものから順にσ1つπ2つ、π*2つ、σ*1つの計4つの分子軌道ができます。
ここに一つの軌道いは2つの電子が入るというパウリの排他原理となるべく電子のスピンが平行になって一つずつ軌道に入っていくというフントの規則に従って電子を埋めていくと、下の図のような電子配置が最も安定な電子配置になります。
この電子配置を見るとO2の分子軌道にはπ*軌道に二つの不対電子があるのがわかります。つまり、酸素分子はビラジカルであるということが分子軌道法から明らかになります。
ちなみに2pのπ*にスピンが同じ向きに入っている酸素を三重項酸素、上下逆向きで入っているものを「一重項酸素」と呼びます。
from wikipedia TCReuter [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)]
ラジカルの反応性
先ほどのメチルラジカルのようにラジカル分子は、プラスでもマイナスでもない中性の電子です。
ラジカルは、電子をあげてカルボカチオンになるか、電子を奪ってカルボアニオンになるどちらにも行けるため反応性が高い分子です。
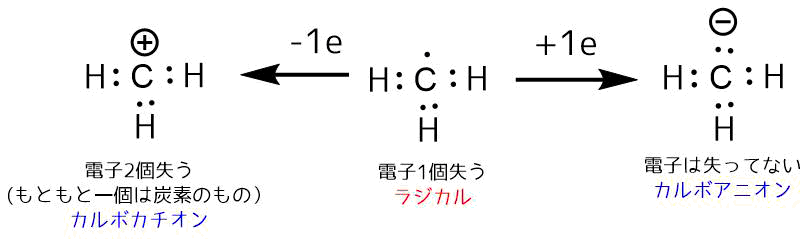
ラジカルからのカルボカチオンとアニオン
実際に自動酸化の反応機構についてみてみましょう。
酸素分子のラジカルは水素引き抜きといって水素に電子を提供して結合形成する代わりに水素は炭素との結合を切って、ラジカルが発生します。
酸素ラジカルは水素引き抜きの後、もう一方のラジカルとラジカルカップリングをして過安息香酸を生じます。
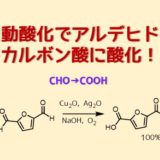
ちなみにベンズアルデヒドはそのまま放っておくと自動酸化して安息香酸が生じることが知られています。これを過安息香酸からみていくと、不安定な過酸結合のO-Oの結合開裂(ホモリシス)により生じたラジカルがアルデヒドの水素引き抜きを起こすと安息香酸が生じる例が考えられます。
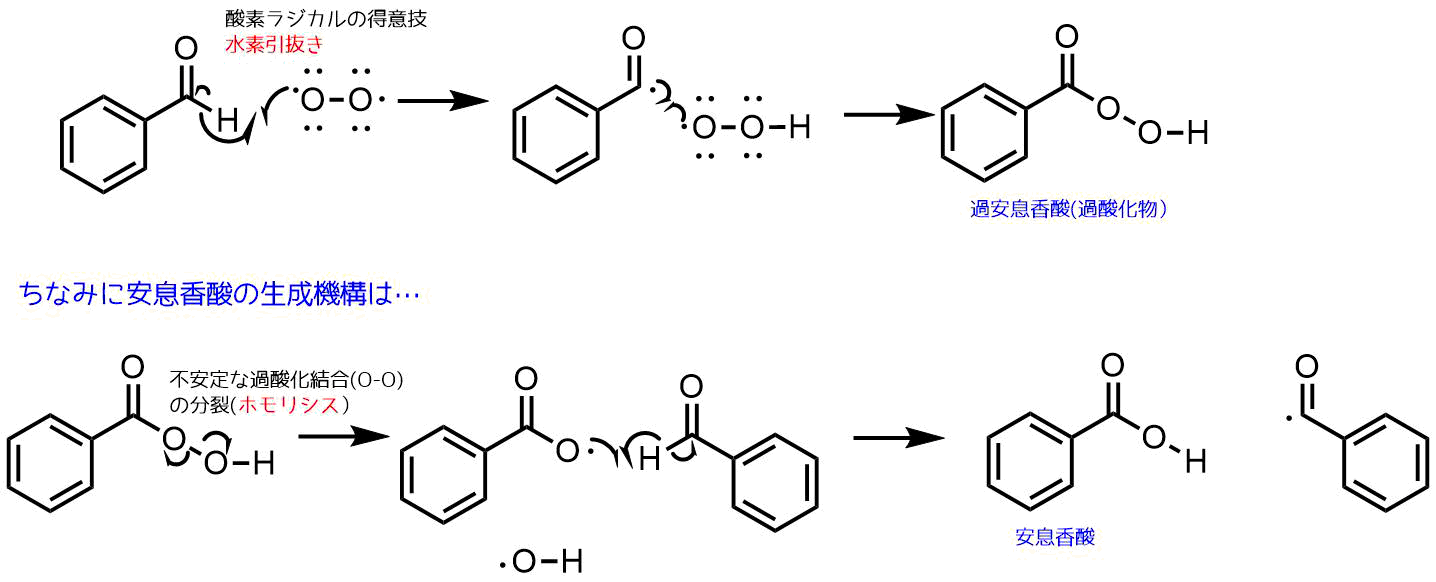
酸素による自動酸化反応
このようにラジカルの反応はラジカル同士が結合しない限りどんどんラジカルが発生するので連鎖的に反応が進行していきます。予測不能なラジカル反応が連鎖的に起こるため有機合成では使いにくい反応ですが、近年はラジカルを活用した様々な反応が開発されています。
脂質の酸化
脂質は空気のあるところで長期間保存したり、熱していると酸化して過酸化脂質が生成するというのは聞いたことがあると思います。
これが起こる原因はもちろん酸素です。
酸素ラジカルが脂質と反応して過酸化物を作ることが知られています。
ラジカル生成しやすい化学構造の一つに「二重結合」があります。
オレイン酸などの植物油には二重結合を含むものが多く、この二重結合の隣の炭素についている水素(アリル位)は他の炭素-水素結合よりも反応性が高く、ラジカルによって水素引き抜きが起こりやすいです。
これによって生成した脂質ラジカルとラジカルカップリングすることによって「過酸化脂質」が生成します。
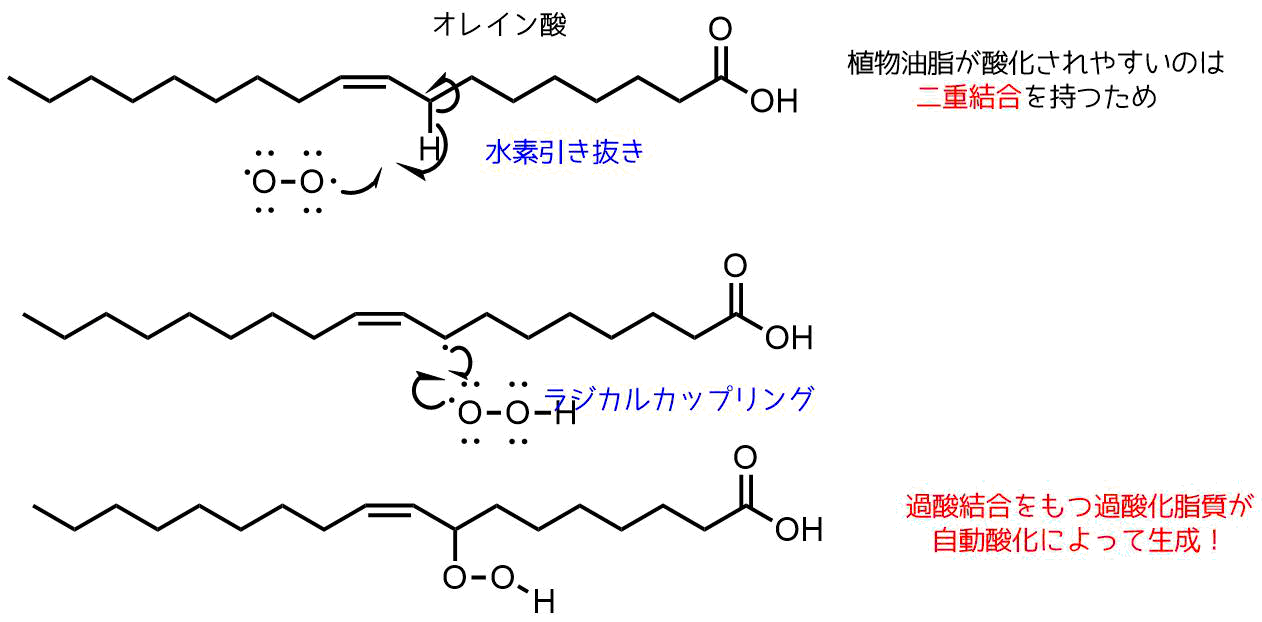
脂質の過酸化
二重結合をもたない脂質はこの過酸化が起こりにくいです。脂質ラジカル及び不安定な過酸化脂質はラジカルであるため、様々な反応を起こすことが知られています。