水酸化リチウムはアルカリ金属水酸化物の一つで強塩基です。水酸化リチウムの水溶液はエステルの加水分解などによく利用されます。市販品には無水の水酸化リチウムと水酸化リチウム一水和物があります。
水酸化リチウムとは?
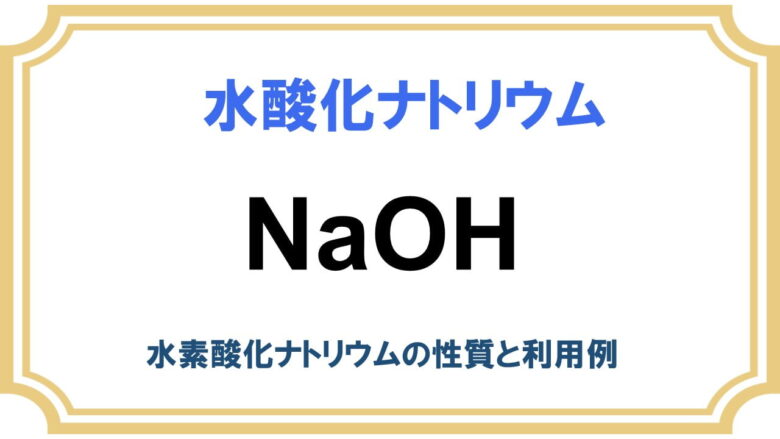
水酸化リチウムはアルカリ金属の水酸化物で、水酸化ナトリウムや水酸化カリウムと同じ分類に入っている強塩基です。
水酸化リチウムは炭酸リチウムと水酸化カルシウムとの反応によって生成します。
水酸化リチウムの特徴として、二酸化炭素をよく吸着するため、二酸化炭素吸着剤として利用されることがあります。
水酸化リチウムのプロパティ
- MW: 23.95 (41.97 一水和物)
- 化学式: LiOH
- 融点 : 471℃
- 密度 : 2.54 (一水和物1.51)
- 溶解度 : 水に溶解、エタノールわずかにとける
水酸化リチウム一水和物を無水物にしたい場合は?
水酸化リチウムのいち水和物は110℃程度まで温めると水分を失って無水物になります。
水酸化リチウムの劇物指定について
水酸化リチウム一水和物は、平成30年7月1日より、毒物および劇物取締法による取締を受けて「劇物」に指定されています。
一方で水性インク用顔料分散液などに水酸化リチウム一水和物が少量利用されていることからこの濃度域では劇性がないと判断され、0.3%以下の水酸化リチウム一水和物を含む製剤に関しては劇物から除外されています(厚生省:平成31年3月)。
水酸化リチウムの廃棄方法について
水酸化リチウムの廃棄は塩酸などの酸により中和を行った後、水性溶液として廃棄します。中和反応では熱が発生するため、冷却しながら中和しましょう。
炭酸リチウムとの違い
炭酸リチウムはLi2CO3よりなる炭酸塩で、水酸化物である水酸化リチウムとは異なります。炭酸塩の法が塩基性が弱いです。水酸化リチウムは二酸化炭素を吸着すると炭酸リチウムに変化します。
炭酸リチウムは双極性障害の治療に用いられる医薬品です。気分を安定させる効果があります。炭酸リチウムを摂取することによって、女性は体重が増える傾向がある報告があります。
水酸化リチウムを利用した反応例
エステルの加水分解では水酸化リチウムをよく利用します。1M程度の水酸化リチウム水溶液を数滴溶媒(水、THF、対応するアルコール)に加えて反応を行います。
エステルだけでなく、アミド、カルバメートの分解にも利用されます。