マクロライド系抗菌薬 クラリスロマイシン
クラリスロマイシンはマクロライド系の抗菌薬の中でも比較的新しめのもので、ニューマクロライドと呼ばれることもあります。
マクロライド系薬剤の特徴は副作用が少なめで長期間作用する点です。
代表的なマクロライド系はクラリスロマイシン(クラリス、クラリシッド)やアジスロマイシン(ジスロマック)
マクロライド系はその名前にある通りに大環状のラクトン環(マクロライド)を持つ物質群です。
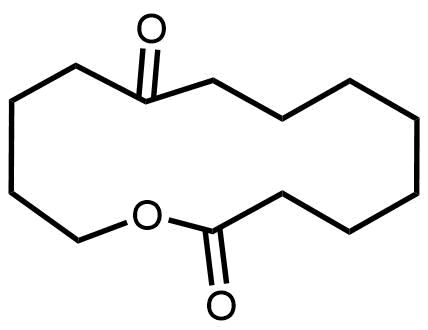
大環状ラクトン 環状エステル
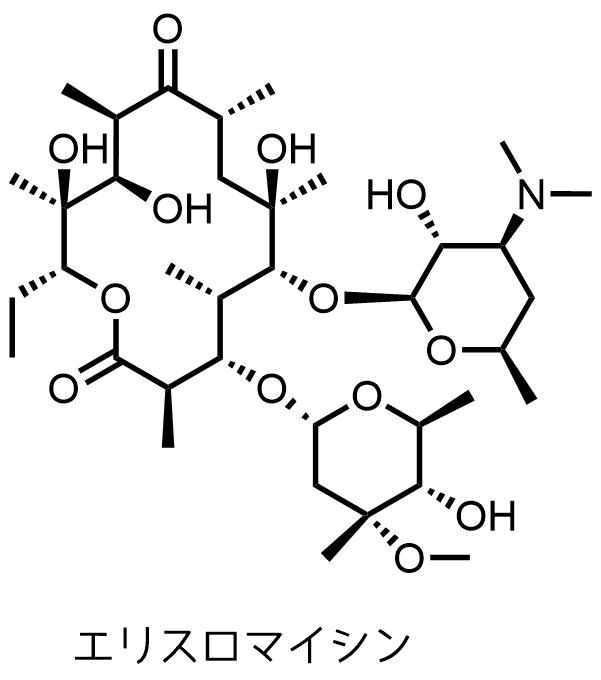
最初に報告されたマクロライド系薬剤はエリスロマイシンで1952年にStreptomyces erythreus(放線菌)から発見されました。
クラリスロマイシンの登場と改良
エリスロマイシン(EM)はペニシリンと似た抗菌活性を示すため、ペニシリンに対するアレルギーを持つ患者に対して代替として用いられたり、グラム陽性菌に対する効果が高いことから肺炎や黄色ブドウ球菌に対する治療薬として用いられてきました。
しかし、エリスロマイシンにはいくつか弱点があることが分かってきました。
- グラム陰性菌に対する弱い抗菌活性
- 酸に対する安定性
- 低吸収性
こうしたエリスロマイシンの弱点克服のため化学構造を変えて改良しました。そうして登場したのがクラリスロマイシンです。
エリスロマイシンの弱点である酸に弱いというのは「胃酸によって分解される」ということです。
酸に弱いのはエリスロマイシンのどこの構造に由来するでしょうか。
ラクトンの加水分解による開環、あるいは糖のエピメリ化やグリコシド結合が切断などがあるかもしれません。
それはマクロライド環にあるケトンと6位水酸基にあります。
エリスロマイシンが酸性条件にさらされるとケトンのカルボニルがプロトン化されて活性化します。そこに求核性のある6位の水酸基が攻撃、脱水によりエノールエーテルが生じます。分子内にはほかにも水酸基がありますが、立体化学的に5員環を形成する6位の水酸基による攻撃が起こりやすいです。
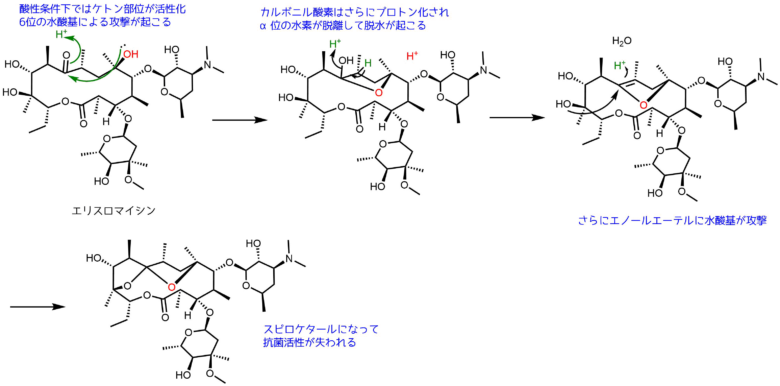
こうして生成したスピロラクトンは抗菌活性が失われるため、抗生物質としての作用を示さなくなります。
どうすればこの分解を防ぐことができるでしょうか。
ケトンを水酸基やフッ素などの別の構造に変換して求電子性を失わせるなどの方法もあるかもしれません。
一つの方法として6位の水酸基の求核性を失わせればよいので、水酸基をメチル化してメトキシ基にします。メトキシ基は水酸基と比べて求核性が低下するのでケトンへの攻撃が起こらなくなります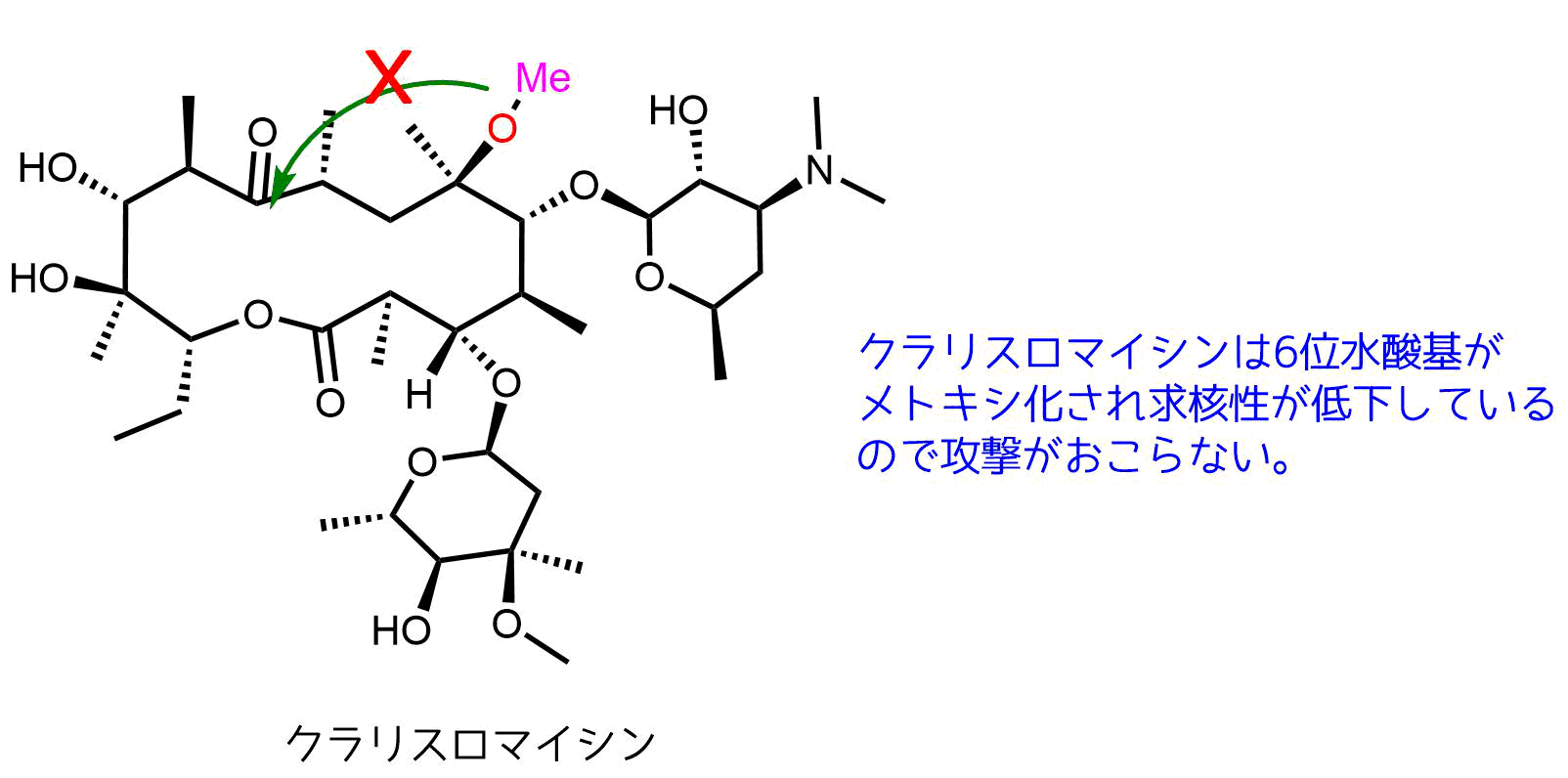 このように一部の構造を変えることで胃酸で分解しにくくすることができます。
このように一部の構造を変えることで胃酸で分解しにくくすることができます。
結果だけみると水酸基をメチル化するだけで簡単そうですが、実際に作ってみるのは大変です。たくさんある水酸基の中から選択的に水酸基をメチル化する必要があります。
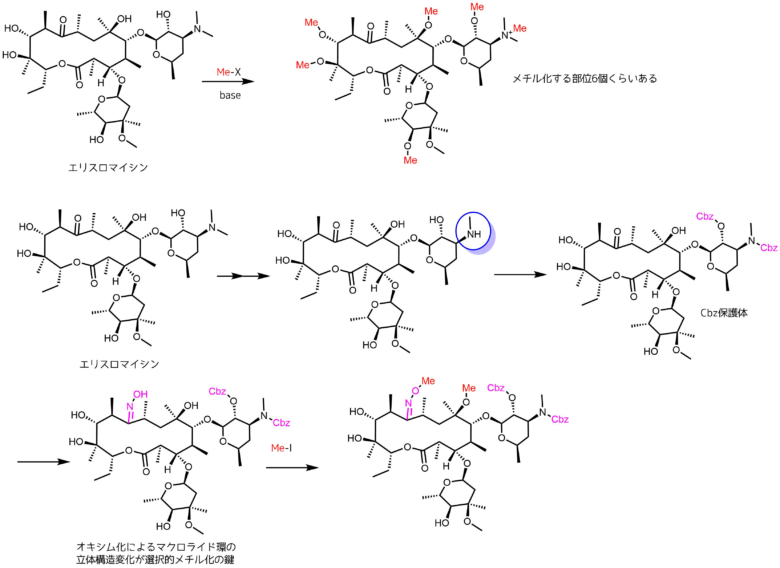
クラリスロマイシンの合成法
上の例のように選択的メチル化を達成するために様々な検討を行います。選択的メチル化反応の鍵はケトンのオキシム化であったため、オキシムの保護基や水酸基の保護基を検討して最適化していきます。
6位の水酸基のメチル化で酸による安定性が向上しても抗菌活性が低下したら意味がありません。抗菌活性を保ちつつ酸に安定な物質を作る必要があります。6位メチル化体は抗菌活性がEMと同等か少し高い程度であるため、目的が達成できています。
参考
- Hardy, Dwight J., David RP Guay, and Ronald N. Jones. “Clarithromycin, a unique macrolide: a pharmacokinetic, microbiological, and clinical overview.” Diagnostic microbiology and infectious disease 15.1 (1992): 39-53.
- Flynn, Edwin H., Hubert W. Murphy, and Robert E. McMahon. “Erythromycin. II. Des-N-methylerythromycin and N-methyl-C14-erythromycin.” Journal of the American Chemical Society 77.11 (1955): 3104-3106.
- 渡邉慶昭. マクロライド抗生物質クラリスロマイシンの製造研究: エリスロマイシン A9-オキシム誘導体の 6 位水酸基の選択的メチル化. Diss. 城西大学, 1994.
- Watanabe, Yoshiaki, et al. “Method for selective methylation of erythromycin A derivatives.” U.S. Patent No. 4,672,109. 9 Jun. 1987.