タンパク質のラベル化とは?
細胞内においてタンパク質は数多くの生理機能を担っています。
これらの生理機能を解明する手法であるタンパク質ラベル化技術の開発は、生命科学研究・医薬品開発の基盤となる技術として応用されてきました。特に、様々な生体分子が入り乱れている細胞内環境下において、標的タンパク質を選択的なラベル化する手法の有用性は高いです。
そこで今回は、タンパク質のラベル化手法についてまとめてみます。
タンパク質ラベル化の目的
タンパク質の機能を解析するには、生体内にある無数のタンパク質の中から解析したい標的のタンパク質が「細胞内のどこに存在しているか?」調べたり、あるいは、「そのタンパク質だけを取り出す」ことで構造を調べたりして直接機能を調べる方法があります。こうしたタンパク質研究においてラベル化は
タンパク質に色素を結合させて色を付けて顕微鏡で見やすくしたり、特定の物質と非常に強く結合する部分を標的タンパク質に結合させて精製しやすくできることから重要な研究手法の一つになっています。
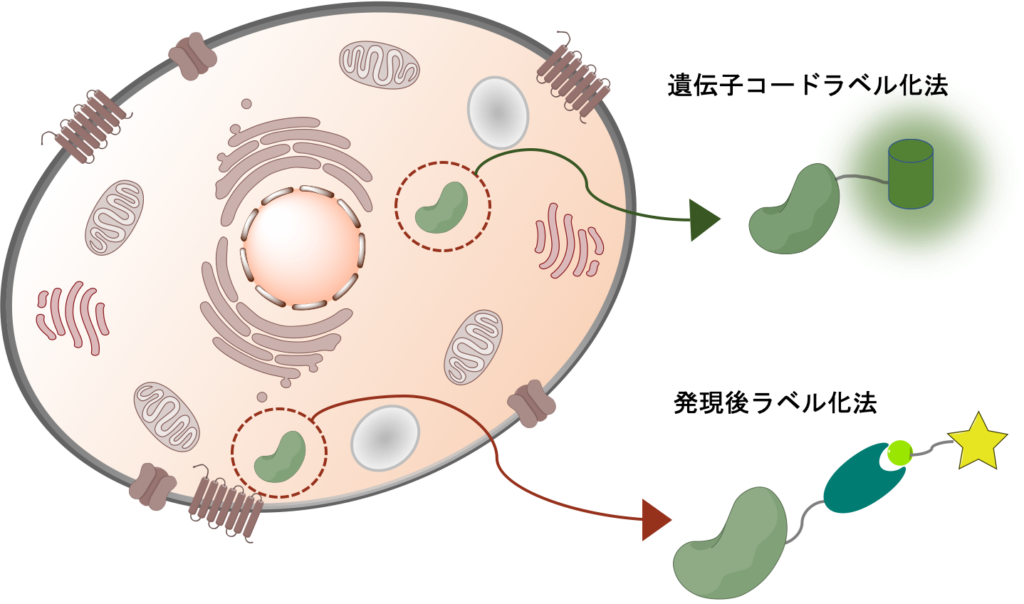
遺伝子コードラベル化法
遺伝子コードラベル化法は、機能性プローブを発現する遺伝子を、標的タンパク質を発現する遺伝子に組込むことでラベル化する手法です。
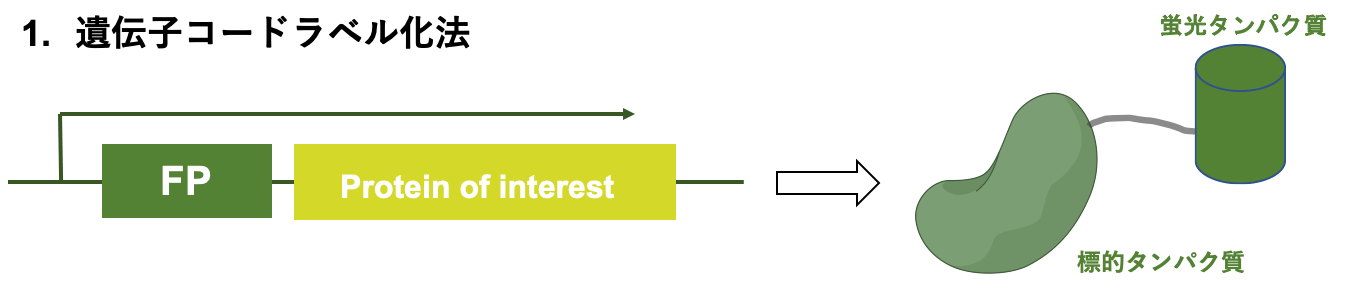
遺伝子コードラベル化法(FPはFluorescent protein:蛍光タンパク質,)
本手法は、GFPなどの蛍光タンパク質によるラベル化などが挙げられ、生細胞内でのイメージング研究に応用されています。
発現後ラベル化法
発現後ラベル化法は、SNAPタグ及びHaloタグシステムなどをはじめとした発現している標的タンパク質と機能性プローブを分子間で作用させラベル化する手法です。

発現後ラベル化法
本手法は、様々な機能性分子を容易にラベル化可能であり、機能性分子のラベル化量・ラベル化のタイミングなども自在に制御できる点から、近年盛んにこれらの手法を用いたタンパク質の解析が行われています。
最後に
今回は、近年主に用いられている2つのタンパク質のラベル化手法の概要をまとめました。今後は、それぞれの手法の詳細についてまとめていきます。



タンパク質のラベル化手法について、分かりやすく解説していただき、ありがとうございます。この記事を読んで、発現後ラベル化法に大変興味を持ち、詳細を知りたくなりました。そもそも、SNAPタグ及びHaloタグを、どのように、生体内にある無数のタンパク質の中から、解析したい標的のタンパク質のみに結合させるのでしょうか。
もし可能であれば、こちらの疑問について、解説して頂けたら大変嬉しく思います。
お忙しいところ恐縮ですが、どうぞよろしくお願いいたします。
先程コメントをお送りしたのですが、メールアドレスを書いていなかったため、再送いたしました。ご確認の程よろしくお願いいたします。
タンパク質のラベル化は遺伝子工学やケミカルバイオロジー分野の中で一つの大きなテーマで関連する多くの研究があるので他にも調べてみると面白いと思います。
Halo Tagの正体はタンパク質なので、ベクターを使った組み換えタンパク質生産技術を使用することができます。
ご質問の標的のタンパク質にHalo Tagを選択的に結合できるのか?については
まず、Haloタグはベクターの形で販売されています。ベクターとは細胞が持たない外部の遺伝子を細胞の中にいれてタンパク質をら作らせるためにつかいます。
haloタグベクターはhaloタグタンパク質以外の遺伝子も入れられるようになっていて、そこに標的のタンパク質をコードしている遺伝子を導入すれば、haloタグ・標的タンパク質の遺伝子を持つベクターが作れます。
これを細胞の中に入れて発現させるとhaloタグ・標的タンパク質融合タンパク質が作れます。
https://www.thermofisher.com/jp/ja/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/molecular-cloning/cloning/traditional-cloning-basics.html#insert
つまり、このようにして標的タンパク質にhaloタグを選択的に結合させたタンパク質を作り出します。
haloタグの優れている点は比較的小さく真核細胞は持たないタンパク質なので融合させても元のタンパク質の機能に影響が小さい点と蛍光分子をはじめとしてさまざまなリガンドを結合させることができる点です。
すでに発現しているタンパク質に対してhaloタグを選択的に結合できるか?についてはhaloタグでは難しいです。
こちらに関しては標的タンパク質に対する選択的ラベル化法といってさまざまな方法が研究されています。
タンパク質の特異的な部分に注目して、受容体であればそれと強力にくっつくリガンドに蛍光物質等を結合させたり、下記URLのようにリガンドが受容体にくっついた時に受容体タンパク質に直接反応して機能性分子をラベル化する方法などが使われます
https://www.jst.go.jp/pr/announce/20131216/index.html
丁寧な解説、ありがとうございます。
関連するURLも教えてくださり、大変参考になりました。
https://www.jst.go.jp/pr/announce/20131216/index.html
こちらについて質問なのですが、一般的に、リガンドとその標的タンパク質との結合は可逆結合なのでしょうか。リガンドが標的タンパク質に結合するなら、リガンドに蛍光基のみついていればよく、反応基はいらないのではないかと考えてしまいました。もしリガンドとタンパク質の結合が可逆なら、蛍光基のついたリガンドがタンパク質から再び離れてしまう可能性があるので、それを防ぐためにタンパク質と不可逆的に結合する反応基をつけるのだろうか、と思ったのですが、どうなのでしょうか。
丁寧に解説してくださり、ありがとうございます。
関連するURLも載せてくださり、ありがとうございます。大変勉強になりました。
https://www.jst.go.jp/pr/announce/20131216/index.html
こちらについて質問なのですが、一般的に、リガンドとその標的タンパク質との結合は可逆結合なのでしょうか。リガンドが標的タンパク質に結合するなら、リガンドに蛍光基のみついていればよく、反応基はいらないのではないかと考えてしまいました。もしリガンドとタンパク質の結合が可逆なら、蛍光基のついたリガンドがタンパク質から再び離れてしまう可能性があるので、それを防ぐために、タンパク質と不可逆的に結合する反応基をつけるのだろうか、と思ったのですが、どうなのでしょうか。
一度同じコメントを送信したのですが、ちゃんと送信できているかが分からなかったため、再び送信しました。もし重複して届いていましたら申し訳ありません。
一般的にリガンドは共有結合しません。
そのため、目的によっても異なりますが共有結合させることでタンパク質と離れないようにします。
ただし非常に強い結合親和性(kd)を示す場合は可逆的であっても目的を達成することも可能です。例えば、抗体抗原反応やビオチンーアビジン相互作用は非共有結合ですが非常に強い結合親和性を示します。
結合親和性の高いリガンドや基質が見つかっていない場合は共有結合させるような仕掛けは有効であると思います。
・補足
天然のリガンド・基質は受容体や酵素とは水素結合やイオン結合、ファンデルワールス力等の非共有結合(可逆的な結合)を介してタンパク質と相互作用します。
共有結合しない理由は酵素や受容体はタンパク質と結合ー解離を行うことで、化学反応を触媒したり、生体の活性状態のオンーオフを制御しているからです。
しかし共有結合するパターンもあります。光認識に重要なタンパク質・ロドプシンはリガンドのレチナールと共有結合します。とはいえ天然の例は少なくアスピリンなどの一部の医薬品や毒物では共有結合する例は多いです。サリン(有機リン系神経毒)はコリンエステラーぜという酵素の活性中心のセリンと共有結合して酵素を不活化するため本来の基質であるアセチルコリンが結合できず体に異常(痙攣)を起こし、最悪の場合は死亡します。