分液は混合物から目的物質を取り出す精製操作の一つです。
本記事では、初めて分液をやる人から、ある程度分液に慣れてるが遭遇しやすいトラブルの対処法を紹介します!
分液・抽出とは?
分液の目的
分液・抽出は混合物から目的物を得る精製方法の一つです。
コーヒを淹れる → 固液抽出
抽出は身の回りにあふれています。
例えば、コーヒー豆にお湯を注いでコーヒーを淹れるのも抽出です。コーヒー豆中の水溶性の成分がお湯に抽出されています。

「固体:豆」と「液体:水」の間で行うため「固液抽出」と呼びます。
分液 → 液液抽出
コーヒーの抽出と分液は同じ抽出でも分類が違います。
分液は互いに混じり合わない2つの液体間で行うため「液液抽出」と呼びます。
水と油は混ざりあわないことは皆さんご存知かと思います。参考までにオリーブオイルと水を混ぜた動画が上がっていたので載せておきます。
水と油が混ざらない理由とは?
分液では互いに交じり合わない液体同士・水と油の二液間で行います。
水と油は互いに性質が異なるため、反発しあって分離しています。
同様に、物質の性質が似ているもの同士は混ざります。
分液ではこの性質を利用してとある物質Xを水と油どちらかに抽出します。
食塩(NaCl)は水と油どちらに溶けやすいか?
実際にやってみればすぐわかると思います。
食塩水にサラダ油を入れてふり混ぜて静置した後、油を舐めてみましょう。ほとんど塩辛さを感じないと思います。これは塩が水に溶けやすく、油に溶けにくいからです。
逆に唐辛子の辛味成分カプサイシンは油に溶けやすいため、ラー油は水ではなく油を使っています。
つまり、食塩は水層に抽出され、カプサイシンは油層に抽出されます。
構造式から水と油どちらに溶けやすいかを予測する
構造式を見ると水と油どちらに溶けやすいかを予測することができます。
実際に以下の4つの物質はどちらに溶けるか構造式を見て考えてみましょう。
- ベンゼン
- カプサイシン
- エタノール
- 食塩
・油の特徴
油といえば、サラダ油のオレイン酸やガソリンのオクタンなどがあります。
これらに共通する構造は「炭化水素」です。下図では赤色で示しています。
・水の特徴
水の特徴は「水酸基:O-H」です。下図の構造式では青色で示しています。
これらの特徴をもとにどちらに移動するかを予想してみましょう。
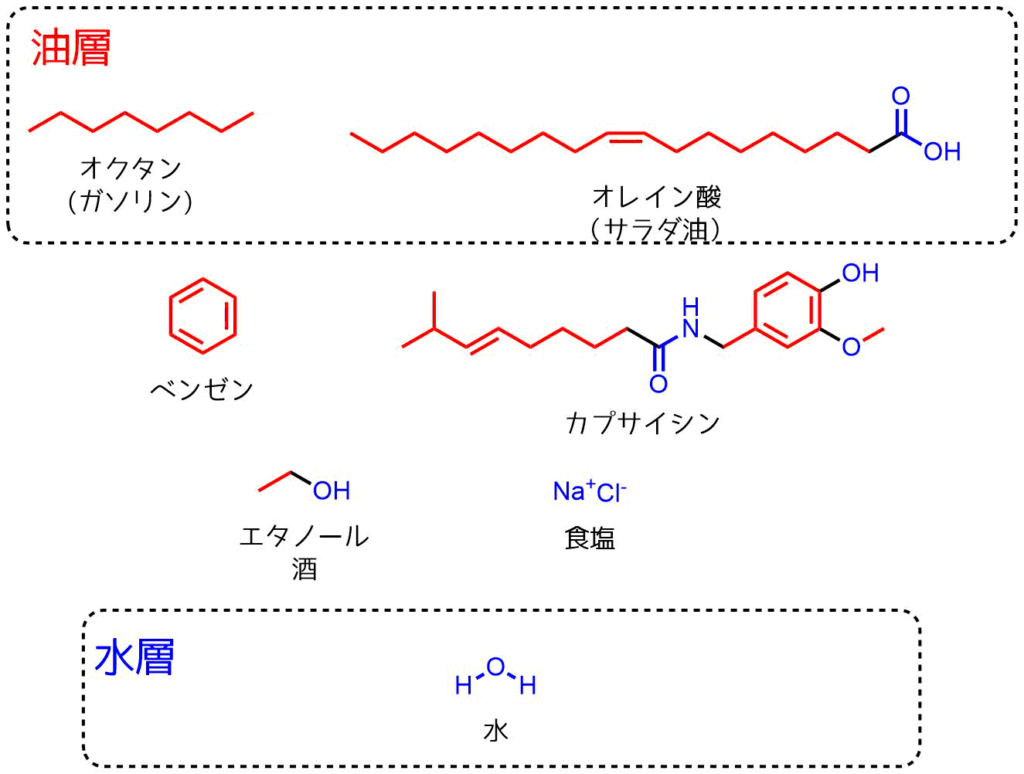
水と油どちらに溶けやすいか
答えは以下のようにベンゼン、カプサイシンは油層、エタノール、食塩は水層に移動します。
- ベンゼン、カプサイシン → 油層
- エタノール 食塩(NaCl)→ 水層
ベンゼンとカプサイシンは炭化水素の赤い部分の構造が占める割合が大きいので油層に移動します。
エタノールは水酸基をもっており、炭化水素の割合が小さいので水層に移動します。
NaClは酸素や窒素元素は無いですがイオンになっており、極性が高いので水層に移動します。
水層に移動する物質は酸素以外にも、電気陰性度の大きな元素(O,N, Cl)が結合して分極している分子があります。例)アンモニア(NH3)
有機化学における油 有機溶媒
分液では油といってもサラダ油などは使用しません。もっと沸点が低い液体を使います。
有機化学では油のことを有機溶媒と呼びます。
沸点の低い油を使用する理由は、有機溶媒中に抽出した物質のみを取り出すためです。目的物が溶けている有機溶媒を蒸発させれば目的物のみを取り出すことができます。
たとえば油に溶けやすいカプサイシンをサラダ油で抽出しているラー油をいくら温めても沸点が高いので水のようにサラダ油を蒸発させるのは困難です。一方、サラダ油の代わりに沸点の低いエーテルを使用すれば蒸発によりカプサイシンのみを取り出せます。
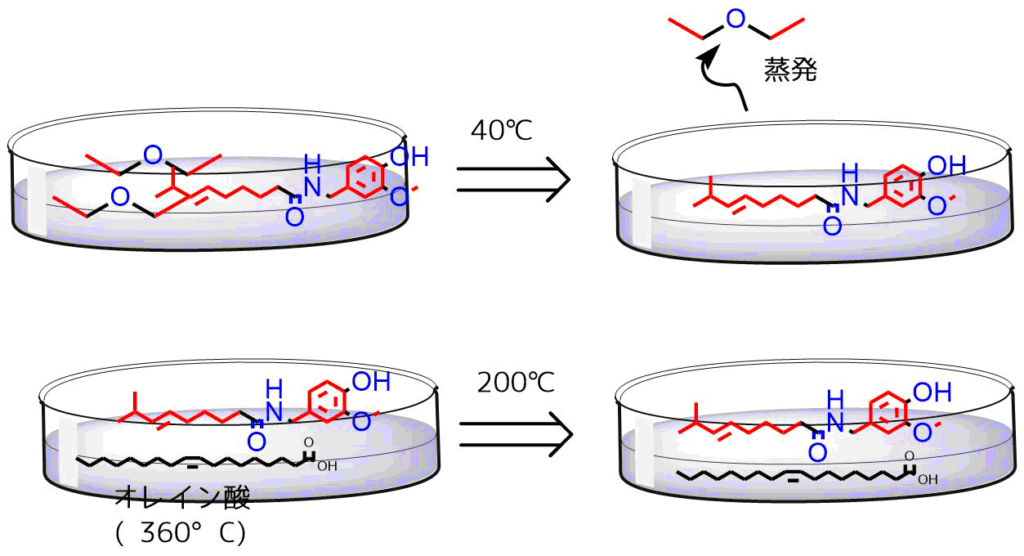
分液で沸点が低いものを扱う理由 沸点の高いオレイン酸では200℃に温めてもオレイン酸は蒸発しない
分液の目的!
分液とは2つの液を分けること→有機溶媒層と水層の2つの層を別々に分けることです。分液をすることによって、目的物を抽出できます。分液ロートは2層に別れた液体を分ける、分液するときに使うガラス器具です。
実際の分液操作方法
分液操作は化学反応後にやります。反応後には反応に使った化学物質がたくさん混じっているからです。
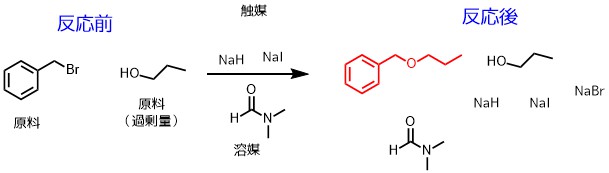
この反応溶液中で必要な目的物は赤い構造式のエーテル体のみです。
目的物を取り出すのに分液が使えます。
水に溶けるもの、有機溶媒に溶けるもの の大きく2つに分類してみましょう。
幸運なことに目的物質は有機溶媒に溶けやすいので有機溶媒を蒸発させれば目的物を得られます。
それでは具体的な分液操作の流れを紹介します。
反応後の溶液に水やアルコールを加えてクエンチ
水を加えて反応を停止させよう: クエンチ
化学反応は反応性の高い物質を使用することが多いです。先ほどの反応でいうとNaHが高反応性の物質です。
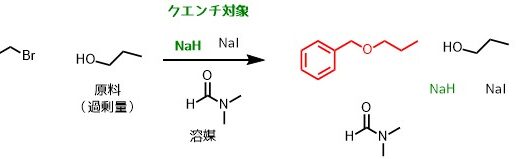
高反応性の物質(クエンチ対象の物質)
反応性の高い物質の多くは水と反応して安定な物質に変化します。
そのため反応を停止するときには水を加えることが多いです。反応停止操作をクエンチと呼びます。
クエンチ時は激しく反応することが多いので氷で冷やしながら水をゆっくり加えます。
氷冷水でも反応が激しすぎる場合は、アルコールやエステル、塩の水和物を加える場合もあります。
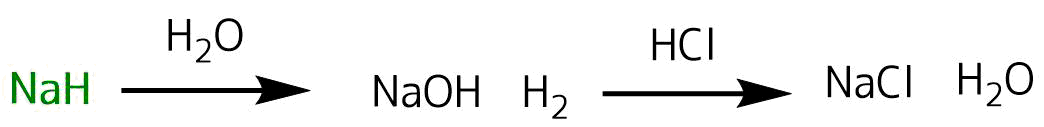
クエンチの例
先ほどの反応例ではNaHをクエンチするために水を加えると安定なNaOHと水素に変化します。NaOHも強塩基性で危険なので薄いHClを加えて中和してNaClとH2Oにします。
クエンチしないとどうなるの?
クエンチせずに水を加えて分液すると爆発的に化学反応が起こり分液漏斗から吹き出す、時には爆発する場合もある。
特にグラムスケールでは注意が必要です。
どんなクエンチ方法がある?
具体的なクエンチ方法は文献を参考にしましょう。同様の反応でどんなクエンチ方法を選択しているかを見比べてみるとよいです。
- ニトロ化:多めの氷に反応溶液を流し込む。濃硫酸が水と接触すると発熱して沸騰して危険です。なので氷を使います。クエンチの基本は冷やすことです
- tert-ブチルリチウム:ドライアイス、氷冷した状態でイソプロパノールを滴下してクエンチする。イソプロパノールは水と激しく反応してときに発火するような化合物のクエンチに利用されます。例:金属水素化物、アルカリ金属類。
- 強酸性:化合物が強酸性でなければ、分液前にある程度中和させる。分液漏斗で炭酸水素ナトリウムで中和させると気体発生により内圧が上がって吹き出るから。
水溶性有機溶媒は除去する。
反応によく使うDMF, THF, MeCN等の非プロトン性極性溶媒などの多くは水にとけます。
これらの溶媒が大量にある状態で分液すると二層に分かれなくなるため、なるべく留去してから分液しましょう。
DMF、MeCN、EtOH、MeOH、THF、ジオキサン、DMEなどは加温して減圧すれば除去できます。
溶媒の濃縮前に反応性の高い物質、酸・塩基はクエンチしておくほうがよいです。蒸発により濃縮されて意図しない反応が起こる場合があります。無理に完全に飛ばす必要はなく少し残っても分液できます。
固体は除去しておく
細かい固体粒子はエマルジョンの原因になるため除去しましょう。細かい粒子はセライトで除去します。※エマルジョンは二層にならずに一層になっている状態です。

クルードを希釈し、分液ロートに入れる。
反応後に溶媒を蒸発させた混合物【分液後のものも同じく】をクルードと呼びます。
分液前にはクルードに抽出溶媒を加えて希釈します。
抽出溶媒には酢酸エチル、ジクロロメタン、エーテルがよく使われます。
クルードの希釈と水を加える際の注意点をまとめました。
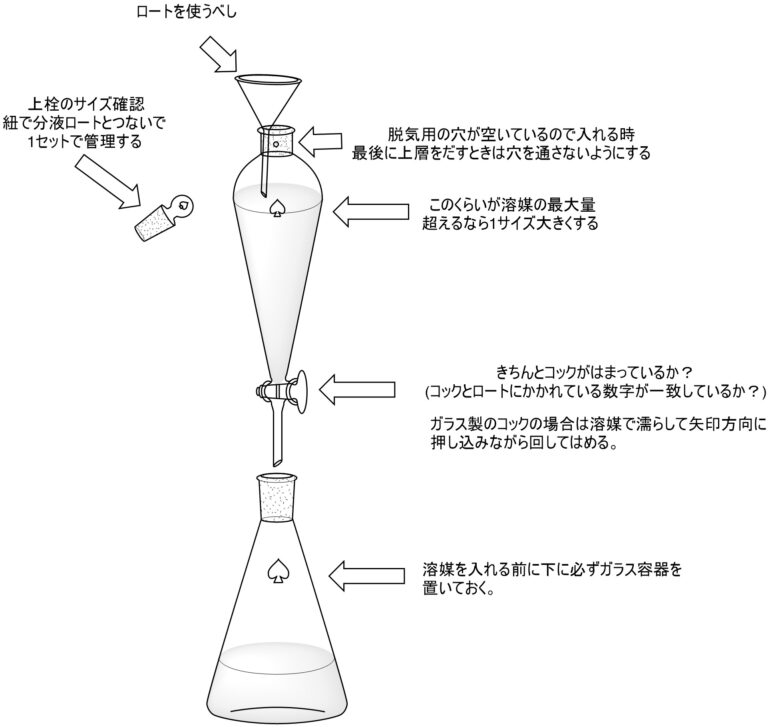
- 溶媒量
- 反応に使った溶媒量~2倍量程度。完全に溶解していればOK。入れすぎ注意
- 水の量
- 有機溶媒の1/4-1/2くらい。水量増やすなら抽出回数を増やす
- エマルションしやすい or 水溶性物質が多い場合は水量を増やす
- 分液ロートのサイズ
- 全液の1.5-2倍くらいの大きさ(100mLなら150mL-200mLの分液ロート)
- 迷ったら大きいサイズを使用する
- コックの材質
- テフロン製がおすすめ。ガラス製は取り外しやすく、洗浄はしやすい
- 分液ロートの形
- 縦長が下層を取りやすいのでおすすめ。攪拌効率は丸形のほうが高いらしい
まずは適切なサイズの分液ロートをカットリング等を使って静置します。分液のロートの下には三角フラスコなどを設置します。
下のコックが閉じているのを確認してから、ロートを使って適当な量の有機溶媒を加えて希釈したクルードを加えます。ロートは脱気用の穴から漏れるのを防ぐために使用します。
反応溶液を加えたら溶媒量の半分くらいの水を加えて、上部のガラス栓を閉じます。この時脱気用の穴が閉じた状態になるようにします。
ひたすら振る
しっかり上栓、コックがはまっているのを確認します。栓の穴と溝がズレていればOKです。
まず上のガラス栓が右手のひらの真ん中あたりに来るようにして握ります。左手は中指と人差し指の間にコック下のガラス管を挟み込み、コックを握るようにして持ちます。
この状態で一度ひっくり返して、コックを回して開放します。これを脱気といいます。
最初のうちはいきなり振らないで、上下ひっくり返すくらいで脱気して様子を見ます。その後数回振ってまた開放します。なれてくれば初回の「シュッ」という音で本格的に振っても良いか判断できます。
振った後、放置して二層になっているか確認します。この時二層になるのが遅かったり、泡泡しているようならエマルジョンになる可能性があるので強く激しく振るのはやめます。
平気そうなら激しく上下に100往復くらい振ります。化合物の物性によって、有機層に行きやすいものはそんなに振らなくても平気です。極性の高い物質はちゃんと振らないと水層に残って回収できず収率が下がります。学生実習ではここが低収率の原因であることが多いです。
静置して下層を取り出す
振り終わったら、「Y」みたいな、カットリングとよばれる鉄製の小さいさすまたみたいな形をしたものに分液ロートを置いて静置します。
出典:株式会社 石井理化機器製作所製品ページより引用http://www.ilw.co.jp/mainpage/machine/opt-mac/opt-clamp.html
数分間放置後液体の変化が見られない状態になったら、下層を取り出します。このとき上栓を開放状態にしてから下層を取り出します。そうしないと下から空気が入って層が乱されてしまいます。
有機層の水溶性不純物を除くための分液なら下層の水層は置いておいて、再度有機溶媒の上層を分液ロートに戻し、水を加えて再度分液します。
一方、水層から有機溶媒で化合物を抽出する場合は水層を分液ロートに戻して新しい有機溶媒を加えて再度分液します。
2-3回繰り返したら、最後は飽和食塩水で洗浄して、有機層を取り出します。このときの水層は捨てずにとっておきます。
上層を取り出す時は、しのコックから取り出すとコックの間に入った水もでてきしまいます。分液ロートを傾けて上から出せば、水は入り込まないです。
乾燥剤で乾燥
乾燥剤はたくさんの種類があります。一番のスタンダートは無水硫酸ナトリウムです。
速くてしっかりとした脱水を求める時は無水硫酸マグネシウムを用いることが多いです。無水硫酸マグネシウムの場合は粉っぽいのでろ過が多少面倒です。硫酸ナトリウムの場合は30分くらいは乾燥時間が必要です。
乾燥剤は入れすぎないようにします。水分量が多い時はさらさらの硫酸ナトリウムが底面で水に触れて固まります。揺すって固まっていれば硫酸ナトリウムを追加しましょう。サラサラしていれば十分です。
有機溶媒を除去(エバポ)
乾燥剤は綿栓ろ過などでろ過して、エバポレーターで溶媒を飛ばします。溶媒を飛ばしきったら、最後に油圧ポンプ真空下で数十分から数時間放置して、重さを量ります。
十分回収できてそうならそれでOKです。水層を捨ててもよいです。不安なら構造決定するまではとっておきます。半分も回収できてないなら分液がきちんとできていないので、溶媒を変える、塩析をするなどして水層から抽出しましょう。
注意点やコツ
炭酸〇〇塩で酸を中和するときは吹き出しに注意!
研究だけでなく、有機化学実習でも酸性溶液に炭酸水素ナトリウム水溶液などを加えて中和、あるいは塩基性にして分液することは多々あります。炭酸塩は酸と反応すると二酸化炭素を放出するので泡が出ます。少量なら平気ですが量が多かったり、密閉していると爆発的に吹き出してきます。ニトロ化反応は濃硫酸・硝酸を大量に使うので、中和しきる前に吹き出すと強酸性の液体が吹き出すので注意してください。おすすめは分液ロートの中で中和する前に、反応容器である程度中和してから分液することです。mgスケールなら直接でも良いですが、gスケールでは危険です。中和する塩基も炭酸塩ではなく、水酸化物を使うなどの工夫も必要です。熱が出るので冷やしながら中和します。
低沸点溶媒でも吹き出す
実習でもよく使うエーテルは沸点が低く、揮発しやすいので、分液ロートで密閉状態で振っていると内圧が上がって吹き出すことがあります。特に分液の初めのほうは、吹き出しやすいので、転倒させてすぐに脱気したほうがよいです。最初のうちは、数回ふったらすぐに脱気してを繰り返して注意しながら分液しましょう。
水層はすぐ捨てない
目的物の脂溶性が高く抽出しやすいもの、一度やったことがある反応など目的物の物性を良く知っている場合以外は、抽出のときに使った水層をすぐに捨てないようにしましょう。特に極性が高い化合物などは抽出が難しいので、水層に結構な量残ったままのときがあります。反応収率を出すまでは、水層はとっておきましょう。
かといって、ずっと残しておいても邪魔になります。恐らく大丈夫そうだというものに関しては、水層のTLCを確認してみましょう。複数回スポットして、ドライヤーなどで乾燥したあとに展開させます。場合によっては小さいスケールで分液してみても良いでしょう。やり方は小さな試験管に水層を入れて抽出したい溶媒を加えてパスツールピペットなどで溶媒を激しく出し入れします。その後、静置し、有機層のTLCをとって見ましょう。まだ残っている場合はTLCにスポットが現れるはずです。この方法は反応進行を確かめるときや、分液の条件を確かめるときにも使えます。水層をとっておく器具がないときは試薬が入った瓶を洗ってとっておいてそこに入れておくと蓋も締められるしコンパクトでよいです。
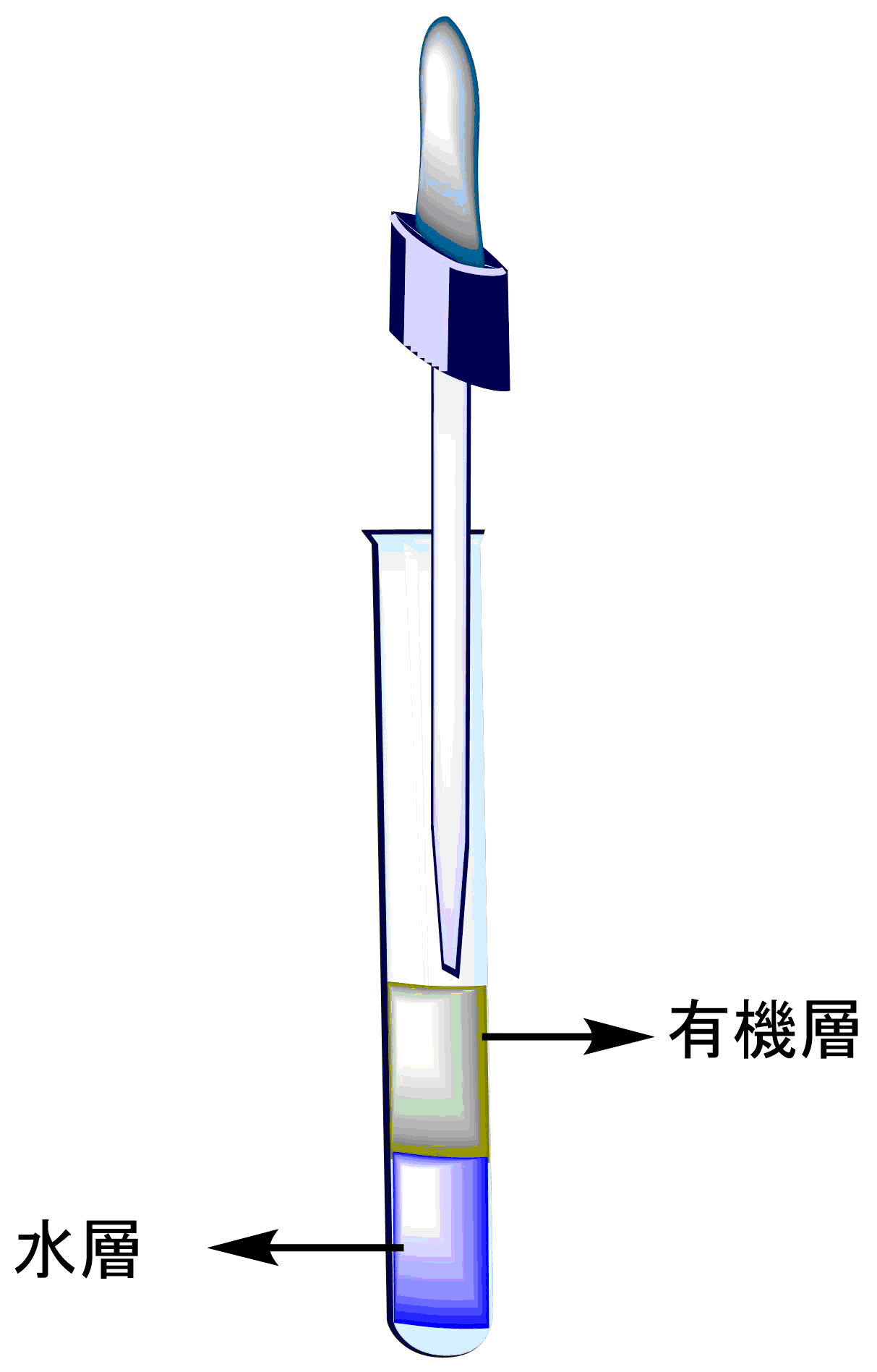
有機層が下か上か
有機層に比重の重い溶質が溶けているとき、水層に食塩や臭化カリウムなどが大量に溶けているとき、上下が反対になることがあります。そういうときは、水あるいは有機溶媒を加えて判断しましょう。それでも判断しにくいときは、TLCを打ってみるとわかります。キャピラリーの上端を指で抑えながら分液ロートに突っ込めば、下層だけをとることも可能です。TLC上で乾くのが遅ければ水、早ければ有機層です。分かりにくいときはどちらの層もやって比較します。
飽和食塩水を使うのはなぜ?
飽和食塩水は有機層から水分を抜き出すのに使います。原理は野菜を塩漬けにすると水分がでてシナシナになるのと同じです。飽和食塩水で最後に分液することによって有機層の水分を結構へらす事ができます。有機層が少し濁っている風に見える時、水が有機層に溶けているせいかもしれません。飽和食塩水で分液すると澄明になるかもしれないです。
極性の高い有機物は飽和食塩水を使うことによって、水層に溶け出す量を減らすことが出来ます。水層に塩を加えて水への溶解度を落として有機層に抽出しやすくすることを塩析と言ったりします。塩析に用いる塩水は塩化ナトリウムでも硫酸ナトリウム、臭化カリウムなど反応しないものだったら何でも良いです。
有機溶媒から脱水するのにも飽和食塩水は使います。有機層が濁っているとき、水が有機層に溶けてしまっているからかもしれません。食塩水を加えて振ることで、澄明になるかもしれません。飽和食塩水で分液するのとしないのでは結構違います。
塩化アンモニウムを使うのはなぜ?
塩化アンモニウムは弱酸性で、塩基性を中和するのに使います。大量の強塩基を中和する時はアンモニアが発生して臭くなることがあるので注意します。金属水素化物やグリニャール試薬などの分液でよく使用します。銅はアンモニアと錯体を作りやすいので、銅塩の除去に塩化アンモニウム水溶液を使うことも多いです。
境界面が分からない
化合物が着色しているときは分かり難いです。特に濃い色のときは全く分からないときもあります。有機溶媒や水を足してみる、光に透かしてみてみて境界面を確認します。分液ロートを横に傾けてみると見えやすいときがあります。氷とかを入れると境界がわかることもありますがたいていそういうときはよくわからないと思います。どうしても見えない場合はコックを開けて下層を少しずつ流してみます。コックに近いほど境界面が見やすいです。それでも分からない場合は全部出して、その一部を分液ロートにもどして有機溶媒と水を多めに加えて分割して分液します。
水溶性極性溶媒を除去したい
DMSOやDMFなどの極性溶媒は水に溶けやすいので、有機溶媒と分液することによって水層溶かして水層を捨てれば除去することが可能です。(でもなるべく飛ばしたほうが良いと思います)
スケールが大きいときは、水や有機溶媒を多めに使います。有機溶媒に除去したい極性溶媒が来ないようにヘキサンなどの非極性溶媒を添加することがありますが、極性溶媒を用いるときは化合物の極性が高い事が多く、化合物が有機溶媒に溶けにくくなることが多いので注意が必要です。最初のうちは飽和食塩水で分液するのも一つの手です。
高極性の化合物が抽出できない
高極性の化合物は高極性の溶媒で抽出します。ブタノール、プロパノール/ジクロロメタン、Me-THF, THF/飽和食塩水、アセトン/飽和食塩水、ヘキサン/メタノール, ヘキサン/アセトニトリルなどの方法があります。アルコールを加える場合は体積比10%くらいまでなら大丈夫です。THFやアセトンを有機溶媒として用いるときは予め飽和食塩水でふってから使用したほうが良いです。THFが飽和食塩水から水を奪うと塩が析出するためで、分液内で固体が出てくると邪魔なので最初にやっておきます。
またどうしても水溶性が高すぎるときは、水層をとるというのも手です。水層を飛ばすのは簡単ではありませんが、可能です。
エマルションになったときに
エマルションは二層に分かれるはずが、あわあわができて二層に別れなくなった状態です。これでは分液が出来ないので下に示す方法を試してなんとか二層にします。
- 放置する
- ろ過する(綿栓、ろ紙、セライト)
- 有機溶媒、水を足す
- 渦を作るように分液ロートを揺らす
- 飽和食塩水などの塩水を加える
- 超音波洗浄機にかける
- 遠心分離する
少しほっておいて状況が改善するのならば、時間をおいてから分液するのも手ですが、時間がかかることが多いので、溶媒を足したり、ロートを揺らす、飽和食塩水を加えるなどの方法を手早く試すのが時短になります。
それでもだめそうならろ過をしたほうが良いでしょう。エマルションの原因は多くの場合不溶性の微粒子が存在しているせいなのでこれをろ過により取り除きます。セライトは多くの場合有効ですが、その粒子が目的物だった場合は回収率が著しく落ちる場合があります。
極性が高いとか、溶解性が悪いことが予め分かっている場合は、極性の高い抽出溶媒(ブタノール、プロパノール/ジクロロメタン、酢酸エチル/メタノール等々)に切り替えましょう。有機溶媒にアルコールを加えてやると溶解性が上がって解消されることもあります。
リパーゼなどの酵素を使った反応後も酵素のカスがエマルションの原因になることがあります。原因が明確な場合はセライトを使用しましょう。 超音波洗浄機がある場合は密栓せずに、中身が溢れないように注意しながら超音波にかけます。泡が弾けてエマルションがかいしょうされることがおおいです。また、有機化学で利用可能な大きい遠心分離機がある場合は遠心分離によって二層にすることもできます。温めたりすると溶解度が上がってエマルションが解消されることもあります。いろんな方法を試してみましょう。
有機溶媒を使う量はどれくらい?
決まりはないです。水層の1/4-1/2くらいでしょうか?あまり有機層が少なすぎると層が別れづらくなるのである程度はいれます。
使用する分液ロートの大きさは?
分液ロートは大きめのものを使ったほうがよいです。あとから追加して容量が大きくなることが多いからです。半分を超えない位の量にとどめておいたほうが良いでしょう。いっぱいいっぱいになると効率よく撹拌できなくなります。
どのくらい振るのか?
最初は上下反転させるくらいで脱気(コックを開けて内圧を下げる)して様子をみます。そのご、少しずつ振る強さを強くしたほうが良いです。エマルションの危険がありそうなときは特に様子を見ましょう。そのような心配がないのであればできるだけ激しく回数は100回くらい振ります。極性の高い化合物は回収率が低く、多くの割合水層にいってしまいます。
上の栓から溶媒が漏れてくる
食塩水を使用したときなどによく起こります。原因はスリとスリの間に物体があってきっちり栓がされてないことです。キムワイプなどでしっかりと拭く。塩化ナトリウムのときは水で栓、スリを洗うと良いです。目で見て粉がついていればしっかりハマりません。
回収率が悪い
水層に目的物が溶けているのが原因です。考えられる原因としては、しっかりと振れていない。目的物が抽出溶媒に溶けにくい→溶媒を変える。 極性が高そうな化合物なら、極性の高い抽出溶媒に切り替える。ジクロロメタンだけで抽出してたならメタノールやエタノール、プロパノールなどを10%くらいまでを目安に加えて抽出してみる。TLCを打って抽出できているかを確認して試行錯誤します。
水層に塩化ナトリウムなどの塩を溶かして塩析を利用して有機層に抽出しやすくする方法もあります。
場合によっては水層をエバポして極性溶媒(アルコールやアセトニトリル、アセトン等)で残渣から抽出する方法もあります。
有機溶媒は何を使うべき?
基本は酢酸エチルかジクロロメタンをつかう。極性が高いならアルコールを加えるか、ブタノールなどで抽出する。
エバポの楽さを考えるとエーテルは飛ぶのが速くて楽ですが、吹き出したり、引火しやすく、臭いも強いので積極的には利用しにくい溶媒です。まずは、化合物が溶解しやすい溶媒を選択しましょう。
水層に溶けた有機化合物を抽出してくる場合は、ジクロロメタンなど、比重の大きい重い溶媒を使うと、有機溶媒が下に来るので、操作が楽になります。有機溶媒が上にくると水層を出してから有機溶媒を出して、水層を分液ロートに戻す作業が必要になるからです。
参考動画・参考サイト
京都大学の教養科目基礎科学実験の分液漏斗の操作に関する動画です。
下の動画は3分程度で短くコンパクトなので、初めてやる方はご覧になってください。失敗例についても見られるので、おすすめです。
[blogcard url=”http://yuuki-gousei.com/2016/04/02/%E5%88%86%E6%B6%B2%E3%81%AE%E6%96%B9%E6%B3%95/”]
[blogcard url=”https://wikiwiki.jp/bake-tech/%E5%88%86%E6%B6%B2%E3%83%BB%E6%8A%BD%E5%87%BA”]
[blogcard url=”http://kohka.ch.t.kanazawa-u.ac.jp/lab7/kougi/seminar_2006/18-2-03.pdf”]
[blogcard url=”http://www.chem.zenkyo.h.kyoto-u.ac.jp/operation/Operation_Guide_WMV/operation_2/frame/frame_09_wmv.html”]
[blogcard url=”http://www.yakugaku-tik.com/home/organic-chemistry/3-1-gai-shuo/3-1-3-guan-neng-jiwo-li-yongshita-fen-li-jing-zhi”]