目次
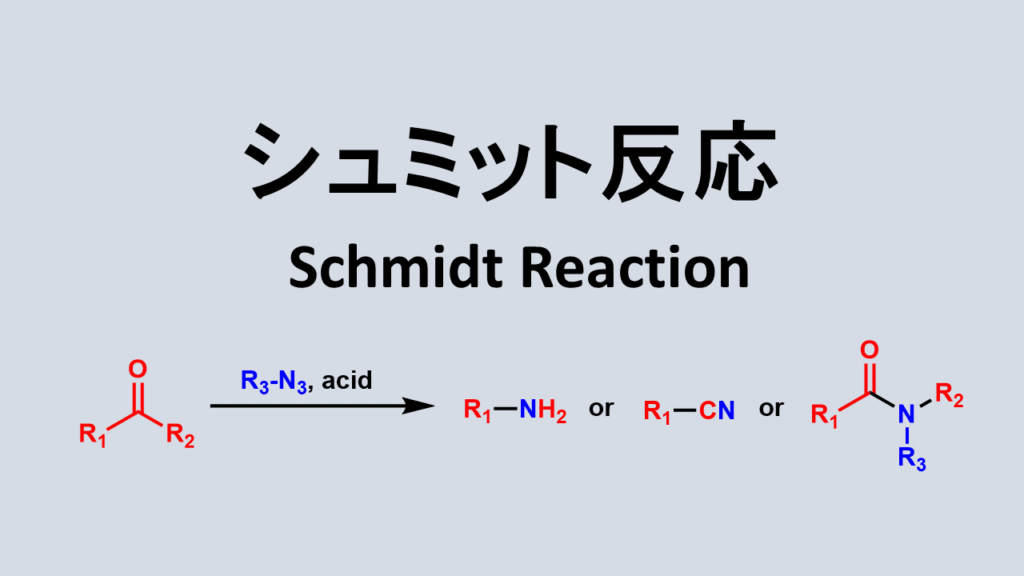
シュミット反応について
シュミット反応はカルボニル化合物やカルボン酸とアジ化水素との反応のことです。アルキル基が窒素上に転位するためシュミット転位とも呼ばれます。
シュミット反応の概要 from wiki PD
シュミット反応はカルボン酸をアミンに変換するのに重宝されます。
シュミット反応はアジ化水素のカルボニルへの求核付加により反応が進行します。そのため、求電子剤をカルボン酸以外のものを使用すれば生成物もアミン以外のものも得られます。
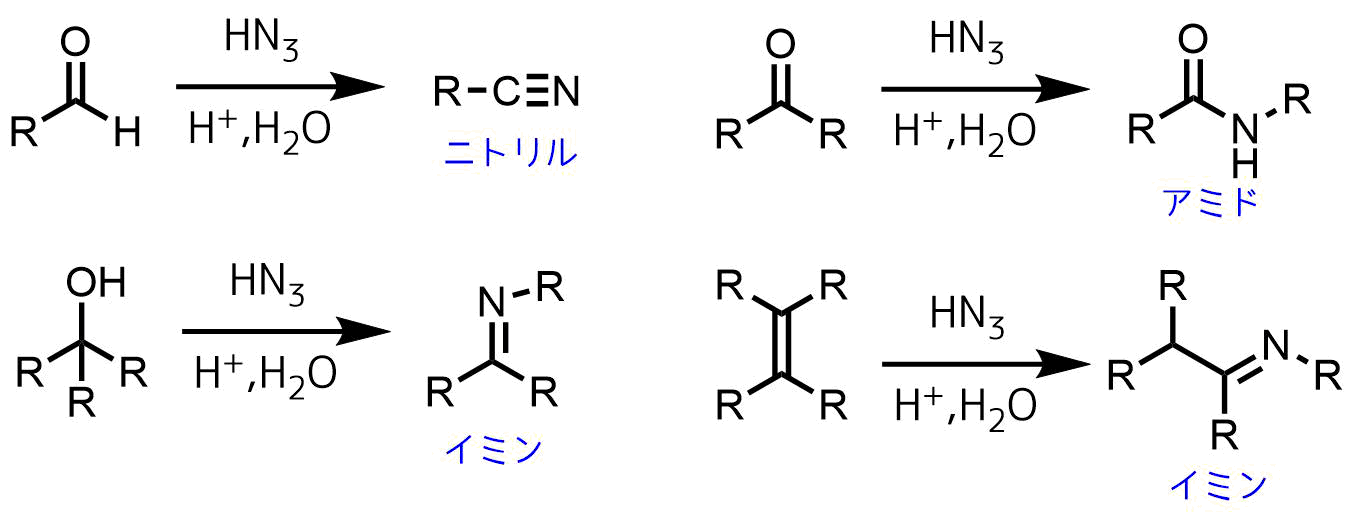
シュミット反応の適用例
- アルデヒドを原料とすると脱水が進行してニトリルが生成します
- ケトンではアミドが得られます
- 第三級アルコールは酸性条件下脱水により生じるカルボカチオン種に対してアジ化水素が攻撃してシュミット転位を起こしてイミンが生成します
- アルケンも酸性条件下で生じたカルボカチオンとの反応によりイミンが生成します
Schmidt反応の特徴や条件
シュミット反応は特にカルボン酸からアミンを合成する方法として重要です。また、アルデヒドから1ステップでニトリルを合成することも可能です。反応剤であるアジ化ナトリウムやアジ化水素は猛毒で爆発性を有する点で代替品であるDPPAを用いることも可能です。
酸としては硫酸が一般的に用いられますが、他のプロトン酸を用いることも可能です。
シュミット反応は脂肪族カルボン酸では進行しやすいです。芳香族カルボン酸の場合は電子求引基を持つ電子不足なカルボン酸では反応が進行しにくい(カルボン酸の酸性度が上がるため)です。
濃硫酸やトリフルオロメタンスルホン酸などを用いるので酸に不安定な化合物は向いていません。酸によってカルボカチオンを生成しやすい化合物(第三級アルコールやアルケン)は用いることができません。そのためα、β-不飽和カルボン酸は向いていません。比較的簡単な化合物向きの反応です。
シュミット反応のメカニズム
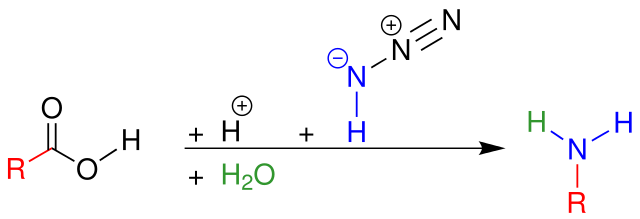
シュミット反応の代表例はカルボン酸との反応です。
カルボン酸は硫酸などの強酸によりプロトン化され、脱水して生じたアシリウムイオンに対してアジ化水素が求核攻撃してアシルアジドが生じます。アシルアジドが生じる点においてはクルチウス転位に類似しています。アシルアジドは脱窒素とともにアルキル基が窒素上に転位してイソシアネート中間体が生成します。イソシアネートに対して水が付加して生じたカルバメートが酸により脱炭酸を起こしてアミンが生成します。
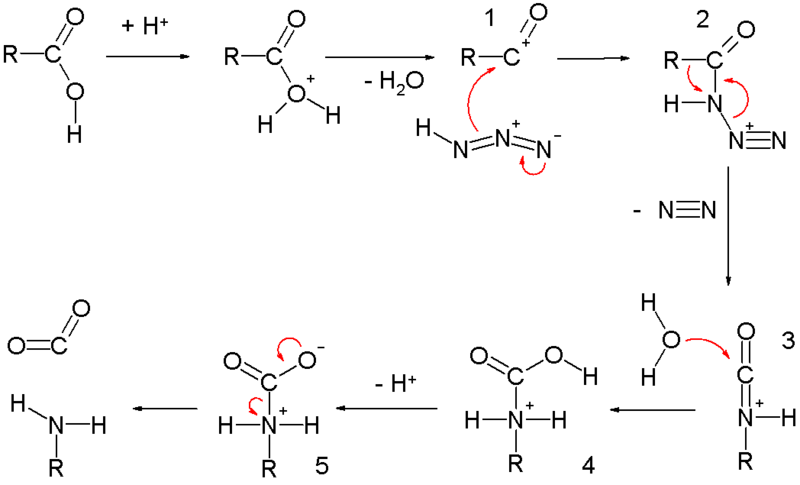
シュミット反応の機構 by English Wikipedia user V8rik CC3.0
ケトンが原料の場合は反応機構がカルボン酸とは異なります。
具体的にはアシルアジドが中間体として登場しません。アジドの付加体から脱水が起こるか、窒素の脱離が起きるかで推定機構のpathwayが違います。脱水の機構は濃硫酸などの非水系の酸を用いた場合に進行するルートだと考えられます。
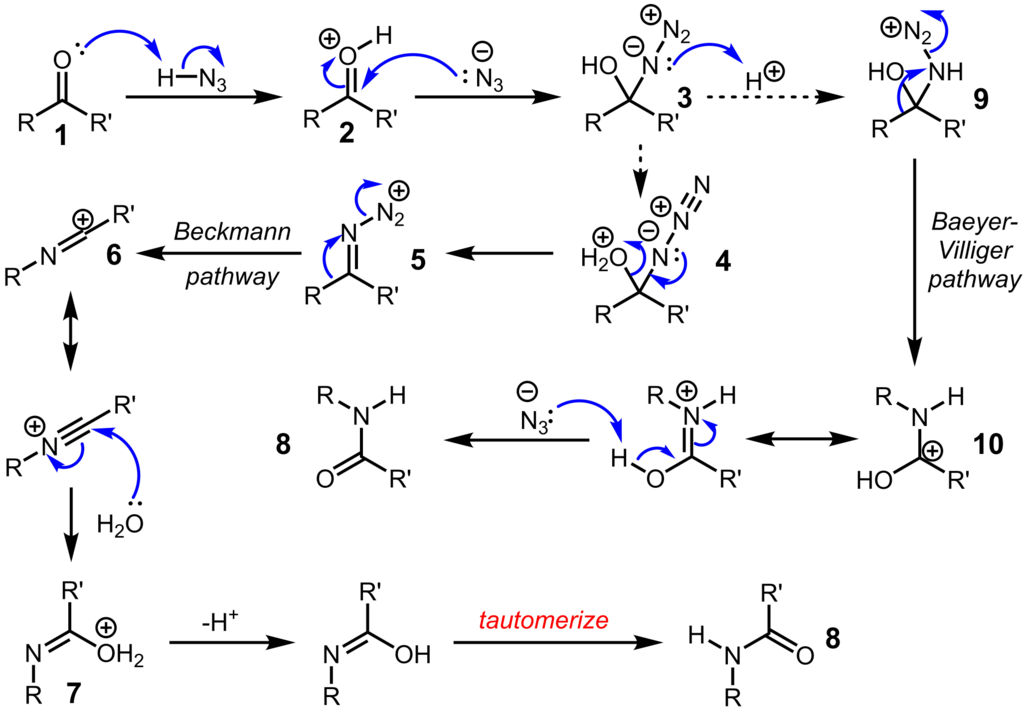
by English Wikipedia user Alsosaid1987 CC 4.0
非対称ケトンの場合はどちらのアルキル基が転位するか?という問題が生じます。芳香族とアルキルのケトンの場合は芳香環側が転位を起こします。また、環状ケトンの場合は環拡大したラクタムを与えます。
アルデヒドの場合はケトンと同様の経路をたどってホルムアミドを生成する場合もありますが、水素が脱離してニトリルが生成します。ニトリル合成を目的とした場合はホルムアミドが主要な副生成物です。
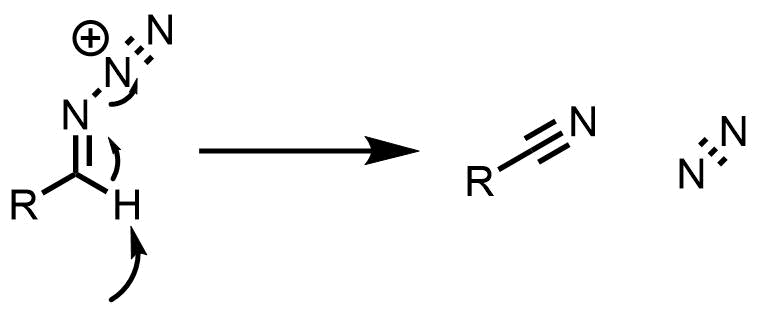
アルデヒドにおけるシュミット反応
アルデヒドから効率的にニトリルを得たい場合は酸としてトリフルオロメタンスルホン酸を用いると良好な結果が得られることが報告されています。
Rokade, Balaji V., and Kandikere Ramaiah Prabhu. “Chemoselective Schmidt reaction mediated by triflic acid: selective synthesis of nitriles from aldehydes.” The Journal of organic chemistry 77.12 (2012): 5364-5370.