目次
オッペナウアー酸化とは?
オッペナウアー酸化は第二級アルコールをケトンに酸化させる反応です。
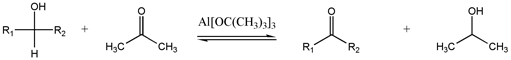
オッペナウアー酸化の概要 from wikipedia PD
オッペナウアー酸化はアルミニウムイソプロポキシド触媒下、ケトンを過剰量用いることで、第二級アルコールの水素をケトンに移ることによって酸化が行われます。
見ての通り、オッペナウアー酸化は平衡反応であり、通常ケトンはアセトンを溶媒量用いることで平衡を右側に偏らせます。
オッペナウアー酸化の逆反応は、Meerwein-Ponndorf-Verley(MVP)還元です。
第二級アルコールの選択的酸化反応として重要です。
金属アルコキシドを用いた酸化反応はもともと1925年のMeerweinによる報告に始まるカルボニル化合物の還元反応(MPV還元)の発見が始まりです。この反応が可逆的であることから、逆反応を利用したOppenauerが1937年にアルミニウムイソプロポキシド触媒下アセトン過剰量で第二級アルコールを酸化できること(Oppenauer反応)を報告しました。
Oppenauer酸化の特徴
オッペナウアー酸化の特徴は
- 第二級アルコール選択的(第一級アルコールが酸化されないわけではない)
- 塩基性条件下でアルコールの酸化が進行
- 温和な酸化反応(エステル、アルケン、スルフィドやアミンは許容)
- 可逆反応でケトンを過剰量必要
欠点としては
- 可逆反応でケトンを過剰量必要
- ジオールは分子内環化を起こす
- アルドール縮合が競合
第一級アルコールは第二級アルコールと比べて反応が遅いですが、酸化が進行することがあります。特に、第一級アルコールから生じたアルデヒドがα水素を持つ場合は、アルコキシドによってエノールが発生し、それらがアルドール縮合を起こします。
アルコールの酸化反応としては他にもたくさんあるので単純な酸化では他の酸化反応を利用しても良いかもしれません。ステロイドの3位アルコールを酸化するのに利用されています。
JOCからケトンとしてアセトンではなく1,1,1トリフルオロアセトンを利用したより効率的な方法が報告されています。フッ素により求電子性が増したケトンは水素受容能が高いです。
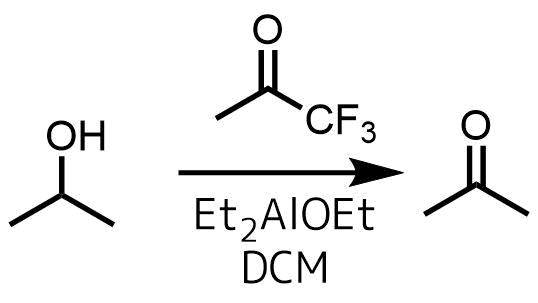
新しいオッペナウアー酸化
Mello, Rossella, et al. “Oppenauer oxidation of secondary alcohols with 1, 1, 1-trifluoroacetone as hydride acceptor.” The Journal of organic chemistry 72.24 (2007): 9376-9378.
反応機構
反応機構の図を下に示しています。向かって右側から左側への反応がオッペナウアー酸化です。可逆反応であり、左側から右側への反応がMPV還元です。
反応の開始はアルミニウムイソプロポキシドのアルミニウム原子へのアルコールの攻撃で始まります。イソプロパノールの脱離が起こり、ケトンがアルミニウムに配位します。六員環繊維状態を経てアルコールの水素がケトンに移動し、酸化反応が達成されます。

MPV還元とオッペナウアー酸化の機構 from wikipedia PD


お手数をお掛けしますが、御教授いただければ幸いです。Oppenauer酸化でステロールの酸化反応を行いますと、5位の二重結合の移動を伴い、共役エノンが主生成物になるようです。5位の二重結合の移動を抑制する方法、あるいはその他(Cr系以外)の酸化方法があれば御教授ください。
ご覧いただきありがとうございます。
コレステロールを酸化するとおっしゃる通り共役エノンが生成するようです。
クロム系以外の酸化剤で選択性の高い酸化剤としてはデスマーチン酸化が使えそうな気がします。
デスマーチン試薬は購入すると比較的高価なため、大スケールに適用する場合は自前で調整すると安価です。
論文は下記を参考にしてみてください。
Meyer, Stephanie D., and Stuart L. Schreiber. “Acceleration of the Dess-Martin oxidation by water.” The Journal of Organic Chemistry 59.24 (1994): 7549-7552.