ウォルフ・キシュナー還元について
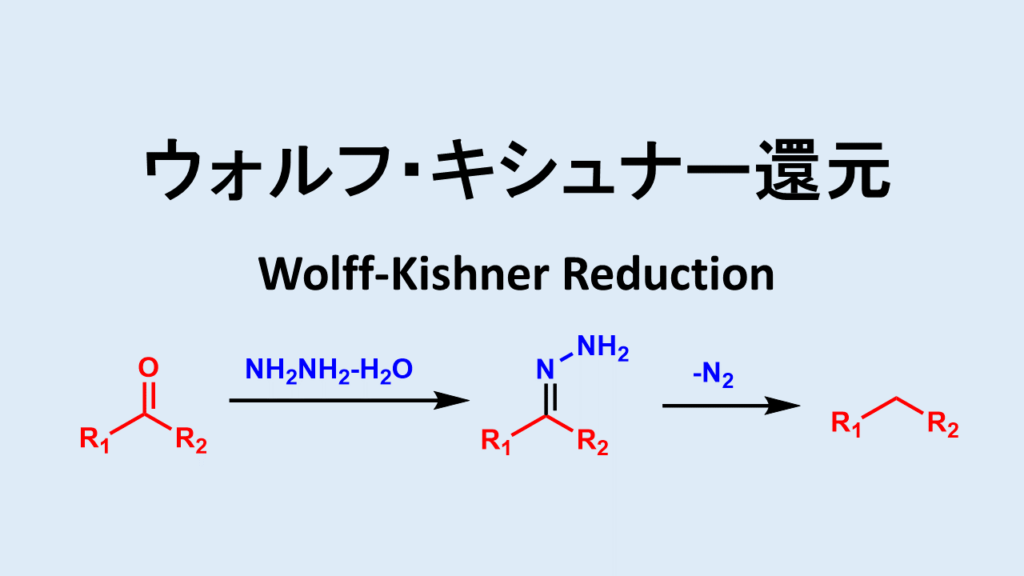
ウォルフキシュナー還元(Wolff-Kishner還元)はケトンやアルデヒドをメチレンに還元する方法です。
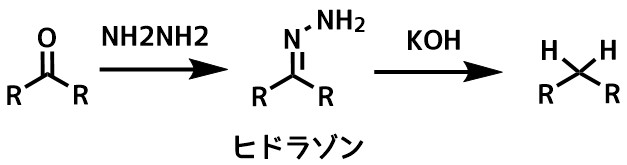
ウォルフキシュナー還元の概要- アルデヒドおよびケトンから対応するヒドラソンまたはセミカルバゾンを経由し、塩基性条件で脱酸素して炭化水素へ変換する
同じくメチレンに還元する代表的な反応であるクレメンゼン還元は強酸性条件下で行うのに対してウォルフキシュナー還元は塩基性条件です。
ウォルフキシュナー還元の初期の報告では加圧・加熱・強塩基性条件で約3日の反応が必要という欠点がありました。
現在では様々な改良法が報告されていて、それほど過激な条件でなくても進行させる方法が開発されています。
ウォルフ・キシュナー還元の特徴
ウォルフキシュナーの還元の特徴は
- 塩基性条件
- 高温条件が必要
などがあります。そのため、エステル、ラクトン、アミドおよびラクタムは加水分解されます。
塩基に敏感な基質はヒドラゾンをあらかじめ調製し、低い温度で塩基を加え、続いて反応混合物を還流することで良好な収率が得られます。
立体障害のあるカルボニル化合物はより高温条件あるいは無水ヒドラジンの使用が有用です。
過激な条件で適応範囲が狭いと思われがちですが、熱的あるいは塩基性加水分解条件に強い基質であれば、比較的収率良く目的の還元体を得ることができます。
実際に各種ステロイド、アルカロイドなどで利用されています。
より温和なウォルフ・キシュナー還元の改良法たち
KishnerとWolffらによって報告したオリジナル法は使い勝手が悪く実験室のスケールでは使われないと思います。様々な改良法が報告されています。
Kishnerによるオリジナル法
1911年に報告されたKishner法はヒドラジンを使った方法で高温・気密条件が必要でした。
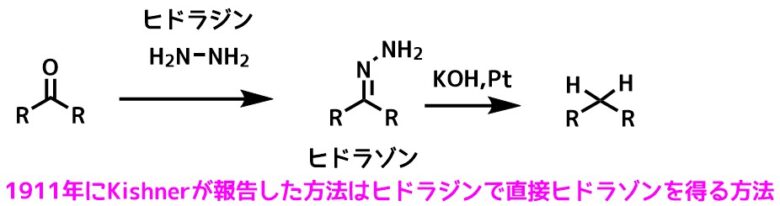
Kishner法 Kishner, NJ. Russ. Chem. Soc. 1911, 43, 582– 595
Wolffによるオリジナル法
1912年にWolffはセミカルバジドを使ってセミカルバゾンを作りメチレンへと還元する方法を報告した。
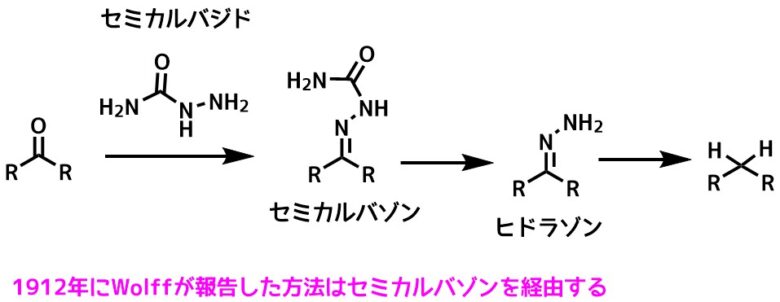
セミカルバゾンを経由したウォルフキッシュナー還元Wolff, L. Methode zum Ersatz des Sauerstoffatoms der Ketone und Aldehyde durch Wasserstoff Ann. Chem. 1912, 394, 86– 108
WolffとKishnerの方法をあわせてウォルフキッシュナー還元と呼んでいます。高温が必要であるが、溶媒にエタノールなどの溶媒を使用しているため密栓加圧条件が必要だった点を後述するHuang Minlonが改良した。
Huang Minlonらによる改良法
1946年にHuang Minlonらによって報告された改良法はジエチレングリコールなどの高沸点溶媒とKOH・ヒドラジン水和物を利用する方法で、封管せずに常圧200℃で還元できます。この方法は簡便で溶解性の低いポリマー基質や立体障害の大きいものに適用できる方法です。
改良法ではカルボニル化合物を diethylene (I) または triethylene glycol (II) 中 85% N2H4.H2O と 3 当量の NaOH または KOH を加えて1時間撹拌、過剰な水とヒドラジン水和物を留去した後、温度を180℃~200℃に上昇させて3~4時間加熱還流します。
Huang-Minlon A Simple Modification to the Wolff-Kishner Reduction J. Am. Chem. Soc. 1946, 68 (12)
欠点としてはジエチレングリコールを利用していることで化合物の抽出が困難になることです。トリエタノールアミンを溶媒として使用する方法は塩酸で水溶液中に落とすことができるので有用です(Gardnerらによる変法)。
Bartonらによる改良法
1955年Bartonらによる改良法の利点は立体障害の大きいケトン類の還元が可能な点です。ジエチレングリコールを溶媒とし、無水ヒドラジン、ナトリウムを塩基として利用します。

Image is quated by Wikipedia Eng.C kleinlein [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)] Huang Minlonrらの方法では上記の反応は達成されなかった。 Cramらによる改良法 1962年Cramらによる改良法は事前に調製したヒドラゾンをtBuOK中のDMSO溶液に滴下する方法で、室温で還元可能なことが利点です。室温条件で反応するため、アミドなどは耐えます。 この方法ではゆっくりと添加しないと副反応が起きてアジンが生成しやすくなります。 非プロトン性極性溶媒であるDMSOによるアニオンの安定化能とtBuOKの塩基性の強さが室温での反応を可能にしていると考えられます。 Cram, D. J.; Sahyun, M. R. V. (1962). “Room Temperature Wolff-Kishner Reduction and Cope Elimination Reactions”. Journal of the American Chemical Society. 84 (9): 1734. この方法の欠点はヒドラゾンを作って置く必要がある点と8時間以上かけてゆっくりと滴下する必要がある点です。(ヒドラゾンの反応性も向上しており、窒素求核攻撃による副反応が起きやすいから) 1963年に溶媒をトルエンとして還流するHanbestによる改良法はヒドラゾンの事前調製が必要ですが、長時間かけて滴下する必要はないです。 αβ不飽和カルボニルなどで起こる副反応などは起こりにくいです。 ヒドラゾンをトルエン中でカリウムt-ブトキシドと混ぜ、還流(約110℃)します。 Grundon, M. F.; Henbest, H. B.; Scott, M. D. (1963). “344. The reactions of hydrazones and related compounds with strong bases. Part I. A modified Wolff?Kishner procedure”. Journal of the Chemical Society (Resumed): 1855–1858 Caglioti反応とも言われるトシルヒドラジンを利用した方法は、カルボニルとの反応により生成したトシルヒドラゾンをヒドリド還元剤によって還元してメチレンを得る方法です。 トシルヒドラゾンはNaBH4、NaBH3CNやトリアセトキシ水素化ホウ素ナトリウムなどのイミン還元などに用いられるような弱いヒドリド還元剤でも利用できます。 ヒドラジンで起こる窒素求核攻撃による副反応は起こらず、温和な条件で進行する点が利点であり、ヒドリド還元剤も弱めのものを利用することで、ニトリルやアミドはもちろん、エステルが存在してもOKです。ニトロやアリールクロライドなども耐えます。ベンジル基、Boc基、TBS基は影響をうけません。 Caglioti, L.; Magi, M. (1963). “The reaction of tosylhydrazones with lithium aluminium hydride”. Tetrahedron. 19 (7): 1127 αβ不飽和カルボニルはアルケンが影響を受ける場合があります(二重結合が移動する)。 ウォルフ・キシュナー還元の副反応は条件が過激なことから起こりやすいといえます。 などが副反応として挙げられます。 アルコールへの還元は反応の遅い場合に起こりやすいです。 Kishner-Leonard脱離はカルボニルのα位に脱離可能な基(アミノ基、アルコキシ基、アシル、スルフェニル基)がある場合に起こります。Hanbestらの改良法が有用。 ある種の芳香族カルボニル化合物(例、ベンゾフェノン、ベンズアルデヒド)は還元に強塩基の使用が必要でなく、過剰のヒドラジン水和物と熱すると還元されます。 塩基性(求核攻撃)に強い官能基は耐えます。条件にもよりますが などは反応に耐えます。 ヒドラジンの使用は望まない副反応を起こす可能性があります。 その点でWolffが報告したセミカルバジドを利用した方法は有毒、危険、高反応性のヒドラジンの使用を避けられます。 ヒドラジンによる副反応は などがあります。 アジンの形成は水や高濃度で促進されると言われています。 ヒドラゾンの窒素が求核性を保持しており、ケトンに再攻撃してアジンが生成するHanbestによる改良法
Cagliotiによる改良法
ウォルフ・キシュナー還元の副反応
ヒドラジン由来の副反応の回避
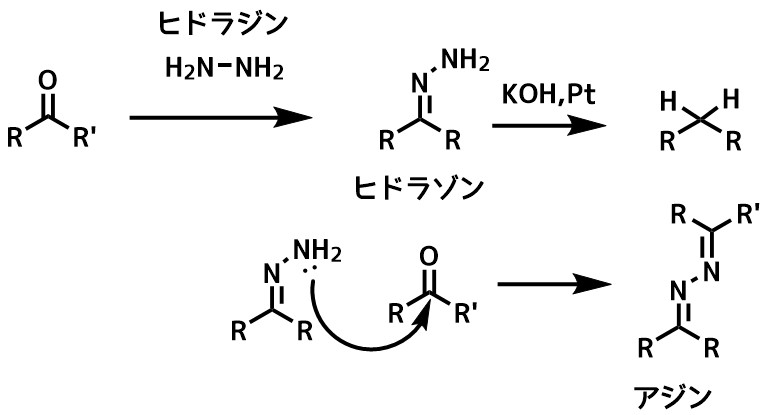
また、αβ不飽和カルボニル化合物ではピラゾリンが生成します。
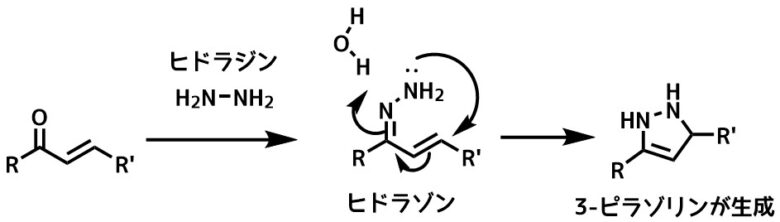
ピラゾリンの生成 – ヒドラゾンの窒素がβ位に攻撃して分子内環化してピラゾリンが生成する
これらの副反応を防ぐ方法としては、ヒドラジンではなくセミカルバゾンを使用したり、トシルヒドラジンなどを使う方法があります。
反応機構
不可逆的な窒素の脱離は反応全体の推進力です。
反応はカルボニルへのヒドラジンの求核攻撃と塩基によるヒドラゾンアニオンの生成が起こり、窒素の脱離を伴って生成したカルボアニオンがプロトン補足してメチレンに還元されます。
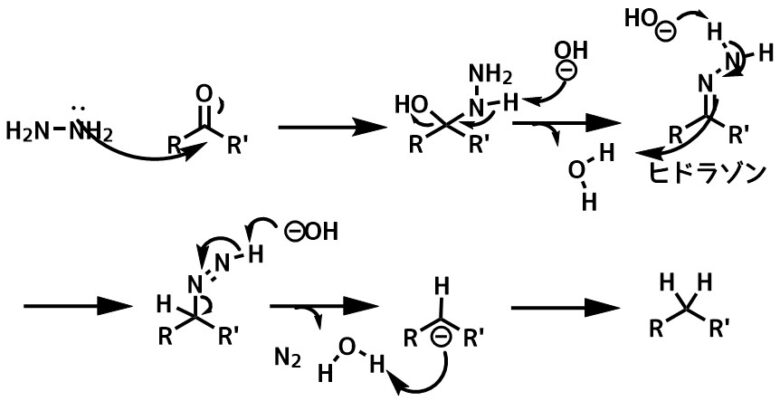
ウォルフキッシュナー還元の反応機構
反応機構の推定で重要な点はヒドラゾンの脱プロトン化と炭素のプロトンの補足がどの段階で起こっているか?です。
提案されている推定の反応機構は以下のようになっています。律速段階は炭素のプロトンの補足であり、ヒドラゾンの二番目の水素の引き抜きと協奏的に起こっていると考えられています。
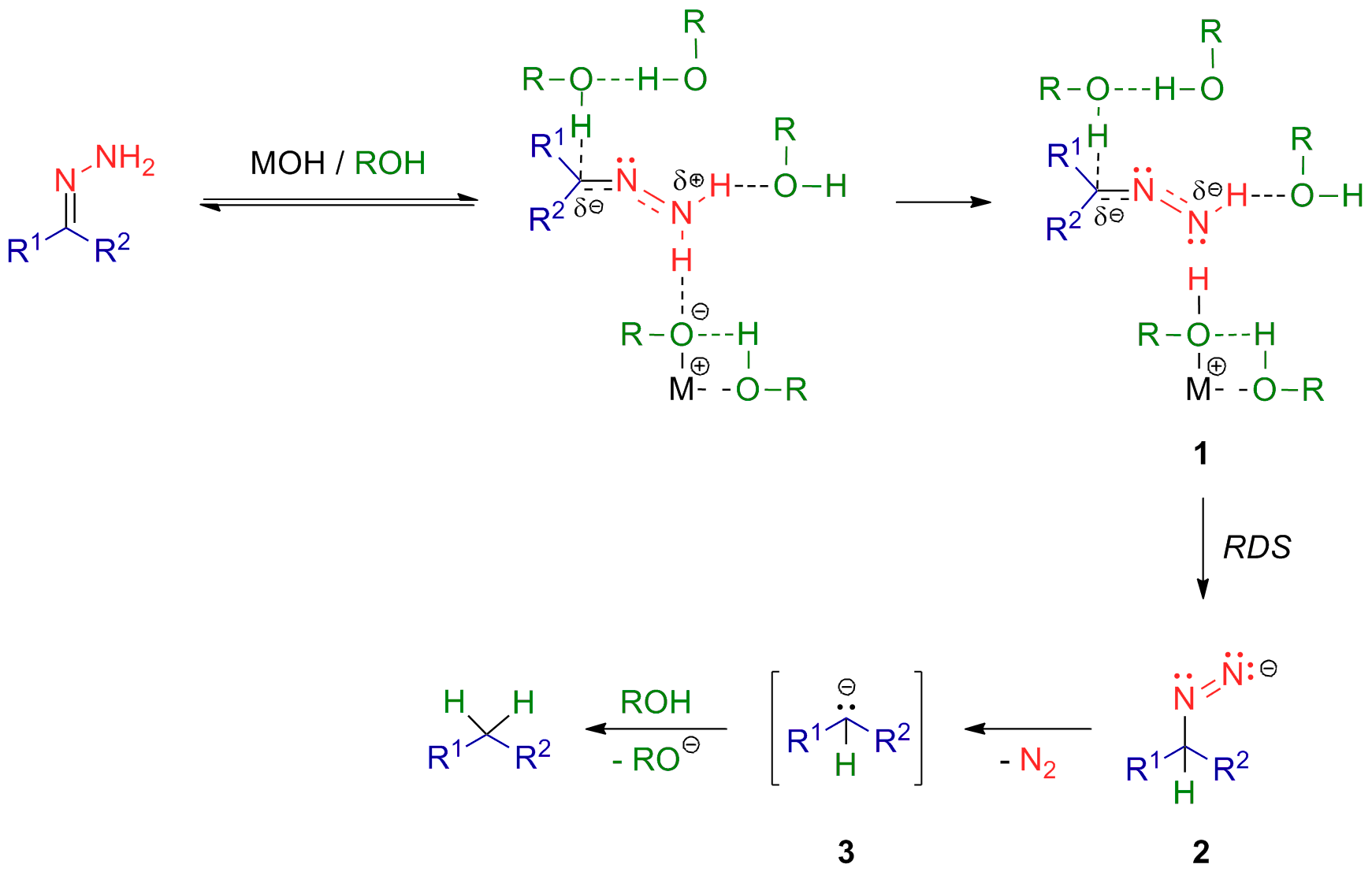
Image is quated by Wikipedia Eng.C kleinlein [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)] RDSは反応律速段階
近年の報告
MyersらによるN,N-ジTBSヒドラジンを使った方法。温和で室温下反応を行うことができる。
M. E. Furrow, A. G. Myers, J. Am. Chem. Soc., 2004, 126, 5436-5445.
C.D.Smithらによる報告でメチルヒドラジノカルボキシレートを利用した方法。より安全性が高く代替法として有用。ヒドラゾンの還元には4eqKOHとトリエチレングリコール中140℃、4時間の反応が必要
P. B. Cranwell, A. T. Russell, C. D. Smith, Synlett, 2016, 27, 131-135.
他のメチレンへの還元法
クレメンゼン還元
ヒドリド還元
シラン還元
接触還元
ケトン→チオアセタール→ラネーニッケルによる脱硫