目次
ウォルフ転位について
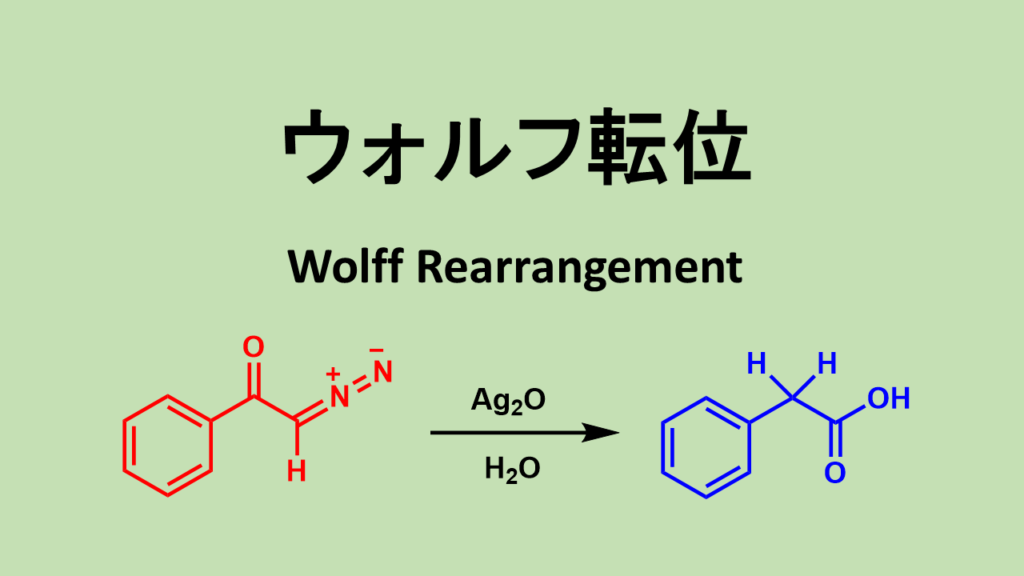
ウォルフ転位(ウルフ転位)α-ジアゾケトンからケテンを生成する反応です。
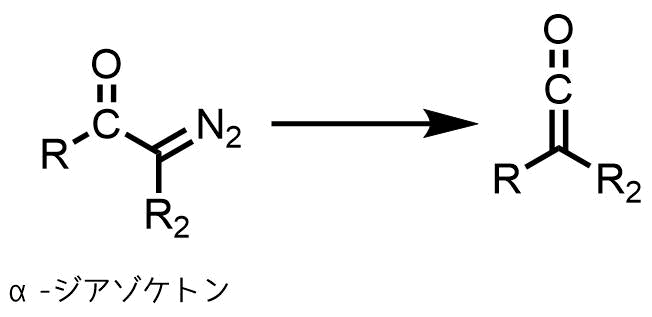
ウルフ転位の反応概要
ケテンは反応性の高い中間体であり、求核種(水、アルコール、アミン)と反応してカルボン酸誘導体を与えます。
| 原料 | 試薬 | 中間体 | 生成物 |
| αジアゾケトン | Δ, hν, Ag(I) | ケテン | ケテン(エステル、カルボン酸、アミド) |
ウルフ転位は有名な転位反応であり、カルボン酸増炭反応(Arndt-Eistert synthesis)への利用が代表例です。
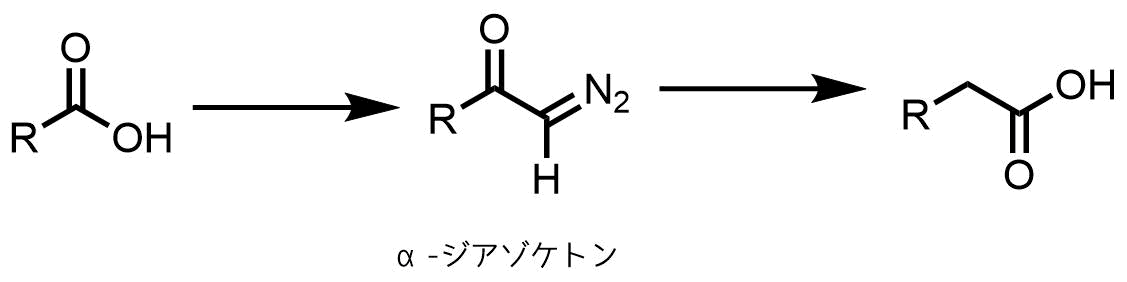
Arndt-Eistert synthesisの概要
また、付加環化によりシクロブタノン合成が可能です。求電子性の高いケテンはアルケンと[2+2]付加環化反応を起こしてシクロブタノンを生成します。
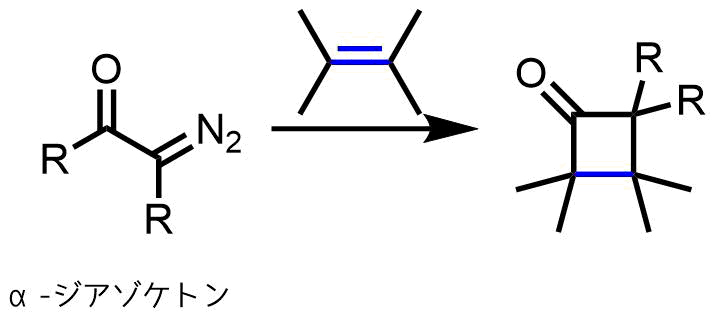
Wolff転位を利用したシクロブタノン合成
1902年にL.Wolffによって発見されました。Wollffはα-ジアゾケトンの研究をしていた過程で、酸化銀、水との反応からカルボン酸が生成することを発見し、さらにアンモニアで処理するとアミドが生成することを見出しました。この反応はジアゾケトンから生じるケテンが中間体であることが明らかになりました。
Wolff, L. (1902). “Ueber Diazoanhydride”. Justus Liebigs Ann. Chem. 325 (2): 129–195.
α-ジアゾケトンの合成法
Wolff転位の合成上の欠点のひとつとしてαジアゾケトンの合成のしにくさがあります。
アーントアイシュタート合成法
Wolff転位により生成したケテンを酸化銀存在下水と反応させてカルボン酸を合成するArndt-Eistert反応では、カルボン酸から誘導した酸塩化物とジアゾメタンとの反応によりジアゾケトンを合成します。
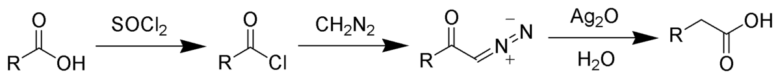
Arndt-Eistert_Synthesis_Scheme from wiki PD
ジアゾメタンは爆発性や毒性が高いため合成上問題があります。この合成法は、より安全性の高い代替品であるTMSN2の登場によって実用性が向上しました。TMSジアゾメタンは少々高価ですが安全性が高くファーストチョイスです。ジアゾメタンは安全に気を配れば反応性も高く、利用できないこともありませんが、時々事故が起こるため使用しないほうが無難です。
Dakin-West反応を経由
Dakin-West反応は塩基性条件下でαアミノ酸と酸無水物との反応により生じたN-アシルアミノケトンを生成する反応です。
このN-アシルアミノケトンを酸条件下、三酸化二窒素で処理してニトロソ化した後、ナトリウムメトキシドと反応させるとαジアゾケトンが生成します。
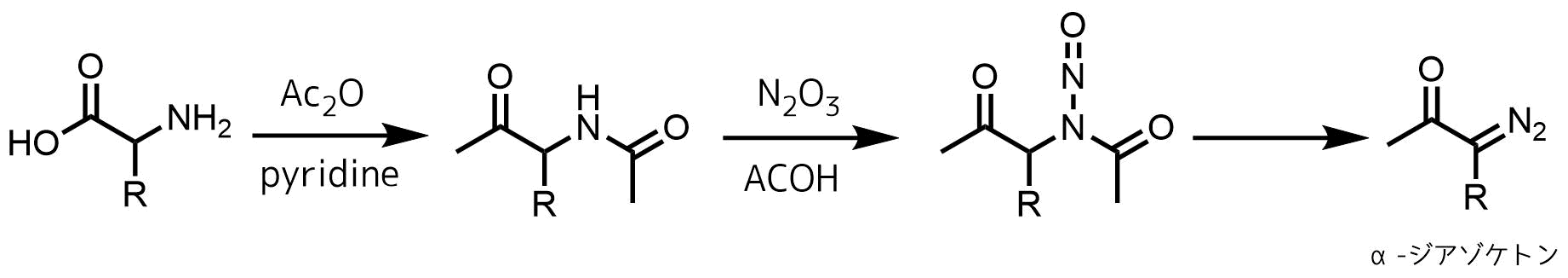
ジアゾケトン合成from Dakin-West
ジアゾ転移
塩基の存在中で有機アジド(例トシルアジド)から活性メチレン基をもつ基質(例、β-ケトエステルまたはβーケトニトリル)へのジアゾ基を転位させる手法もあります(Regitzジアゾ移動)。
簡単なジアゾモノケトンは、ケトンからClaisen反応によるα位へのホルミル基の導入、ついで生じたαホルミル誘導体をトシルアジドと第三級アミンで処理することで合成できます(脱ホルミルジアゾ移動)。α-ケトオキシムのクロラミンによる酸化や水酸化物イオンによるトシルヒドラゾンの分解でも合成できます。
ウォルフ転位の特徴
ジアゾケトンを転位させるためには熱、光、あるいは遷移金属触媒(Ag(I))が必要です。
ジアゾケトン自体も反応性が高く、分解する可能性があります。副反応として、ジアゾ基への直接的置換反応が起こる可能性があります。
副反応を防ぐという観点からも、基本的には銀などの遷移金属触媒下で反応を行う条件のほうが温和であるため好まれます。
基質が光反応性が高くなければ、光反応も有用です。