目次
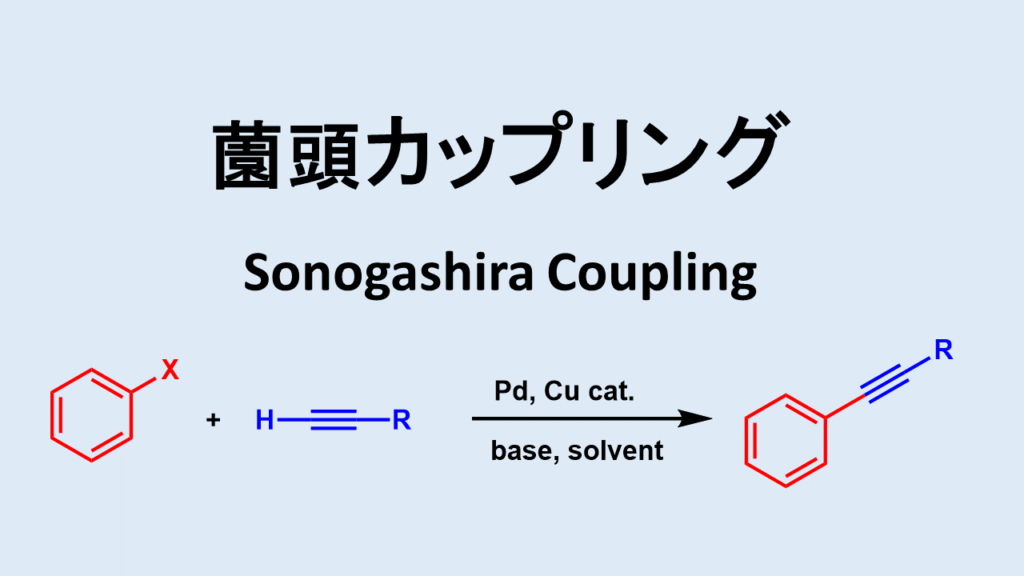
薗頭カップリングについて
薗頭カップリング反応は芳香族アセチレン化合物を合成する方法として有名な人名反応です。

薗頭カップリングはハロゲン化アリール(Cl~I)とTMSアセチレンなどの末端アルキンを原料としてパラジウム触媒、銅触媒、塩基条件下で反応させます。TMSアセチレンを用いた場合はアセチレンのTMS保護体が得られるのでTMSを脱保護すれば末端アルキンが得られます。
他にもアルキンを導入する反応としてカルボニル化合物を出発原料とした
- コーリー・フックス アルキン合成
- セイファース・ギルバート アルキン合成
- 大平-ベストマン アルキン合成
などがあります。
薗頭カップリング反応は有機金属触媒を使用しますが、原料であるハロゲン化アリールの入手性が高く、合成も比較的容易で汎用性の高い反応であることからよく利用されています。
ハロゲン化アリールを原料として金属触媒を用いて芳香族アセチレンを合成する手法の原型はCastro – Stephens 反応です。この反応は1963年にカリフォルニア大学リバーサイド校のカストロらによって報告されました。銅アセチリドとハロゲン化アリールとを窒素雰囲気下ピリジン溶媒下で反応させることにより、ジアリールアセチレンやベンゾフランなどの複素環合成に応用しています。欠点としては銅アセチリドの調製が面倒で激しい条件が必要な点が課題でした。
Stephens, R. D., and C. E. Castro. “The substitution of aryl iodides with cuprous acetylides. A synthesis of tolanes and heterocyclics1.” The Journal of organic chemistry 28.12 (1963): 3313-3315.
Sonogashira, Kenkichi, Yasuo Tohda, and Nobue Hagihara. “A convenient synthesis of acetylenes: catalytic substitutions of acetylenic hydrogen with bromoalkenes, iodoarenes and bromopyridines.” Tetrahedron letters 16.50 (1975): 4467-4470.
薗頭カップリングの特徴
アルキンは付加反応により様々な官能基に変換したり、複素環化合物を合成するのに有用です。アルキンとアジドとの反応によりトリアゾールを合成するアジド-アルキン環化反応は水中でも選択的に進行することから生化学の分野でも応用されています。
効率的なアルキン合成法が求められていますね
薗頭カップリング反応はアルキン合成法として実用的で強力な方法です。
薗頭カップリング反応の特徴は
- 共触媒(銅触媒とパラジウム触媒)を用いることにより室温下でも反応
- 官能基許容性が高い
- ブロモピリジンなどのヘテロ環にも利用できる
- 大スケール可能
などがあります。
一方で欠点としては
- 末端アルキンを合成するのに利用するTMSアセチレンが高価
- アミンが過剰量必要で副反応や精製が面倒
- 有機金属触媒が必要
などがあります。
薗頭カップリング反応の条件
温度
薗頭カップリング反応は室温でも進行し、反応が進行しない場合は温度を上げていきます。基質にもよりますが、私は40~80℃くらいで実施することが多かったです。
銅触媒
銅塩はCuIを用いることが多いです。CuBrが使われることもあるようです。
溶媒
溶媒としてはDMFやTHFなどがよく使われていますが、一般的に使われる溶媒(ジオキサン、アセトニトリル、)はだいたい使えると思います。脱水などはあまり気にしなくても良く、酸素についてもそこまで気を使わなくてもよいですが、進行しにくい場合もあるので脱気したほうが無難です。
パラジウム触媒
パラジウム触媒は薗頭らの初期の報告で用いられていたPd(PP3)4やPdCl2(PPh3)2がよく使わていますが、PdCl2(PPh3)2のほうが安定であり、薗頭カップリング反応では頻繁に利用されていると思います。リガンドはFuリガンドのようなかさ高いリガンド(+Pd(PhCN)2Cl2)を用いる方法が有用であるという報告もされています。
Hundertmark, Thomas, et al. “Pd (PhCN) 2Cl2/P (t-Bu) 3: a versatile catalyst for Sonogashira reactions of aryl bromides at room temperature.” Organic letters 2.12 (2000): 1729-1731.
パラジウム炭素を用いる方法も有効であることが報告されています。
Seki, Masahiko. “Practical synthesis of multifunctional compounds through Pd/C-catalyzed coupling reactions.” Journal of Synthetic Organic Chemistry, Japan 64.8 (2006): 853-866.
アミン
アミンとして初期ではジエチルアミンが用いられていましたが、トリエチルアミンがよく用いられています。ほかにもDIEPAもよく利用されています。アミンの量は適当で溶媒量使うことも多いです。
アルキンについて
末端アルキンを合成するときに利用するTMSアセチレンは高価ですが、安価な2-Methyl-3-butyn-2-olを代替として用いることができます。
Novák, Zoltán, Péter Nemes, and András Kotschy. “Tandem Sonogashira coupling: An efficient tool for the synthesis of diarylalkynes.” Organic letters 6.26 (2004): 4917-4920.
反応機構
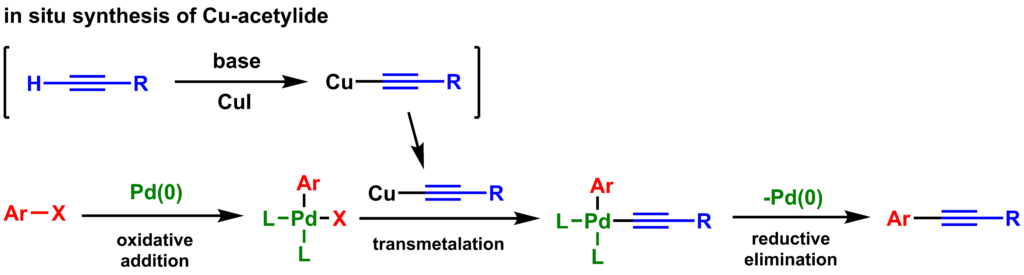
末端アルキンが銅触媒と反応して系中で発生し、それがトランスメタル化によりパラジウム上に導入されてカップリング反応が進行すると予想されています。
Chinchilla, Rafael, and Carmen Nájera. “Recent advances in Sonogashira reactions.” Chemical Society Reviews 40.10 (2011): 5084-5121.
実験手順
窒素雰囲気化、トリエチルアミン(3.1mL, 22.2 mmol)とアセトニトリル(50 mL)にアルキン(2.6 g, 7.5 mol)、ヨウ化アリール(3.5 g, 7.4mmol)、PdCl2(PPh3)2 (61.6 mg, 0.088 mmol)およびヨウ化銅(I) (16.8 mg, 0.088 mmol)を加えて、25℃で12時間拡販する。反応混合物をろ過、減圧濃縮し、フラッシュクロマトグラフィー(石油エーテル-酢酸エチル 10:1)で精製して白色個体の2置換アルキンを得た。 – C.C.Li, etal, J. Org. Chem., 68, 8500-8504 (2003).
ヨウ化アリールが最も反応させやすく室温で反応が進行しますが、臭化アリールではかなり反応性が落ちるため加熱条件が必要になる場合が多いです。

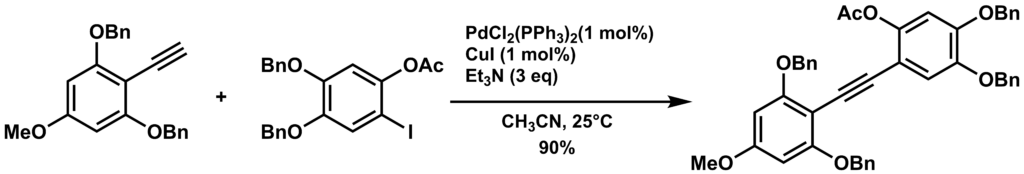
人名反応の本の文章そのままですが、大丈夫ですか?
ご指摘ありがとうございます。問題があるので修正します。