炭酸ナトリウム (Na2CO3)はそこそこ強い塩基性を示す無機塩基として、工業や食品添加物、有機合成などに利用されています。水酸化物系の塩基よりも塩基性が低いため安全性が高く扱いやすいです。
炭酸ナトリウムとは?
炭酸ナトリウム (Na2CO3)はナトリウムの炭酸塩です。塩基性は高めでpKbが3.67です。
水酸化ナトリウムは空気中の二酸化炭素と反応して炭酸ナトリウムに変化します。
2NaOH + CO2 → Na2CO3 + H2O
また、炭酸水素ナトリウムを加熱すると二酸化炭素と水と炭酸ナトリウムに変化します。
2NaHCO3 → Na2CO3 + CO2 + H2O
工業的な製造方法は、ソルベー法が有名です。1861年にベルギーの科学者アーネスト・ソルベーによって開発された方法で、塩化ナトリウム、アンモニア、二酸化炭素、水を使って炭酸水素ナトリウムと塩化アンモニウムに変換し、次に炭酸水素ナトリウムを加熱して炭酸ナトリウムを得ます。
NaCl + NH3 + CO2 +H2O→NaHCO3 + NH4Cl
ソルベー法の特徴はアンモニアをリサイクルするところです。
2NH4Cl + CaO → 2NH3 + CaCl2 +H2O
炭酸ナトリウムのプロパティ
- 分子量: 105.9888 (無水物)
- 化学式: Na2CO3
- 融点 : 851℃
- 密度 : 2.54
- 溶解度 : 水への溶解度22g /100 mL (20℃)、グリセリンにも溶解
炭酸ナトリウムの反応
炭酸ナトリウムは有機合成反応においては、弱めの無機塩基として利用されます。フェノール、アミンのアルキル化などに利用されます。脂肪族アルコールのアルキル化にも利用されますが、より強い塩基である水素化ナトリウムを利用されることが多いです。
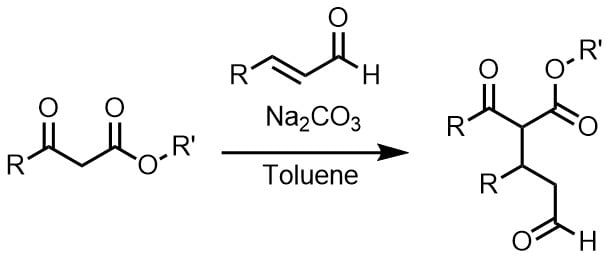
エステルの加水分解
炭酸ナトリウムはエステルの加水分解によく利用されます。エステルと炭酸ナトリウム、対応するアルコール中で室温あるいは加熱して反応を行います。
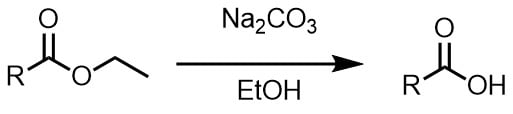
β-ケトエステルの加水分解、脱炭酸
βケトエステルは炭酸ナトリウム水溶液中で反応させることによって、エステルの加水分解、続く脱炭酸によって長鎖のケトンを合成できます。脱炭酸が進行しにくいときはエステルの加水分解後、酸性条件で加熱して脱炭酸を行います。
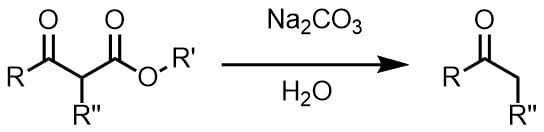
ジケトンとマイケル付加反応
炭酸ナトリウム存在下でジケトンとα,β-不飽和アルデヒドを混合させるとでマイケル付加反応を起こします(クネーフェナーゲル縮合)。あまり強い塩基を利用すると分解する恐れがあります。