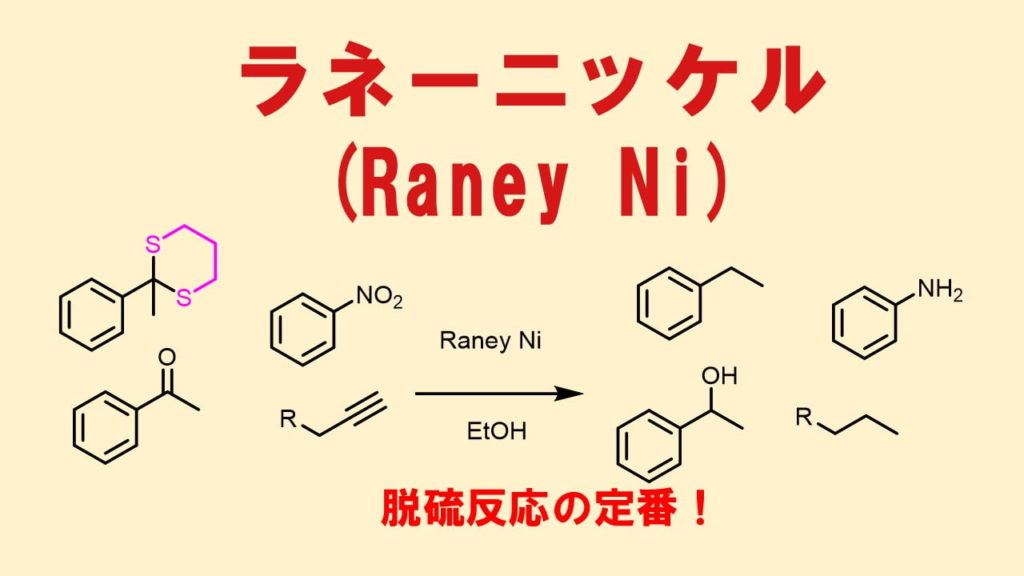
ラネーニッケルは還元に使う触媒
Pd/Cと同様にラネーニッケルは接触還元に用いる触媒で、ニッケルとアルミニウムの合金です。1926年に Murray Raneyによって植物油を水素化するための触媒として開発されました(マーガリン製造)。アルミニウムを塩基に溶かすことによって、スポンジ状のニッケルができます。表面積が広くなったニッケルは触媒活性が高くなっていて、還元する力が強いです。
一般にニッケルや白金は化合物を表面に吸着しやすくこれが触媒活性に関わっているとされています。このような金属を用いた還元触媒は他にPt/C、Pd/Cなどがあります。
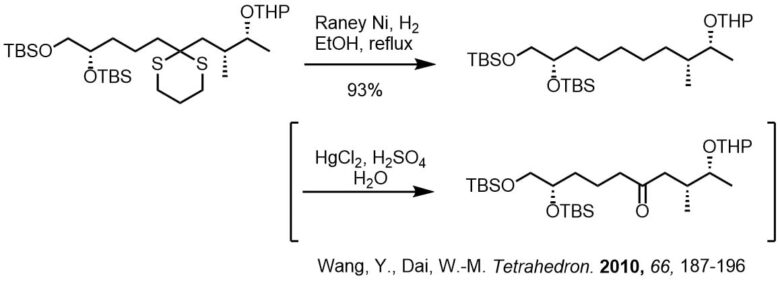
ジチオアセタールはラネーニッケルで還元することによって、アルカンに変換できます。これは脱硫と呼ばれ、よく利用されます。
ラネーニッケルを使った反応
使用時は水酸化ナトリウム水溶液などのアルカリ溶液でアルミニウムを溶解させてスポンジ状のニッケルの状態にします。活性化したニッケルは反応性が高く、空気中で発火することがあるので注意します。活性化方については後述しますが、活性化したラネーニッケルを使用しなくても、塩基に強い化合物であれば、10%NaOH水溶液にラネーニッケルを加えて反応できます。
ラネーニッケルによる還元の選択性
ラネーニッケルが還元できる官能基
- 炭化水素:アルキン、アルケン、芳香環(ヘテロ環を含む)
- カルボニル誘導体:ケトン(アルコール、アルカン)、オキシム(アミン)、ヒドラゾン(アミン)、ニトリル(アミン、アルデヒド)、酸ハロゲン化物、アルデヒド
- ニトロ(アミン)、ニトロソ(アミン)、ヒドロキシルアミン(アミン)
- ヒドラジン(アミン)、アゾ(アミン)
- 硫黄系:スルフィド、ジスルフィド、スルホン
- ハロゲン化アルカン:F,Cl,Br,I(アルカン)
- アリールエーテル、ベンジルアルコール、ジアルキルアニリン、アリールハライドなどの官能基は落ちて水素化される可能性があります。
水素雰囲気下ではアルケン、アルキンやニトロ基、シアノ基を還元します。
ラネーニッケルはエステルやカルボン酸は還元しないです(LAHは還元する)。
フラン環は還元されるので使えません。ピリジンや芳香環は高圧で水素を添加しなければ還元されません。
ラネーニッケルをよく用いる反応は1)脱硫と2)芳香族の水素化などです。シアノ基やニトロ基や多重結合の還元なども可能ですが、代替の還元法がより使われています(多重結合の還元:Pd/C等、ニトロ基の還元(Fe,Sn)。
炭素多重結合の還元
ラネーニッケルは安価で、水素置換せずとも反応が進行する例も多いですが、活性化の作業や発火の危険性など取扱に難があり、使用できる溶媒も制限されるので、多重結合の還元はPd/Cなどを利用したほうがよいかもしれません。
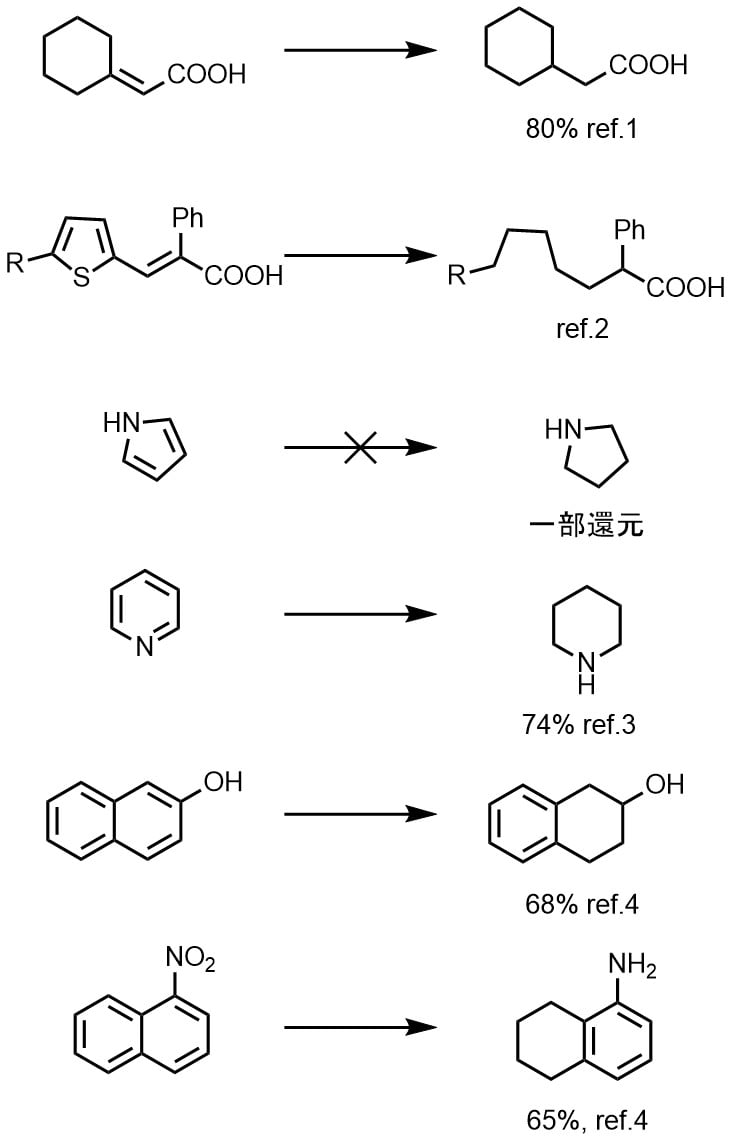
ナフタレン類の還元は片方の芳香環が還元されてテトラリンが生成します。ピリジン類は容易に還元されてピペリジンを与えますが、ピロールはラネーニッケルの還元に抵抗します。チオフェンは還元・脱硫されてアルカンを与えます。
ラネーニッケルによるケトン・アルデヒドの還元
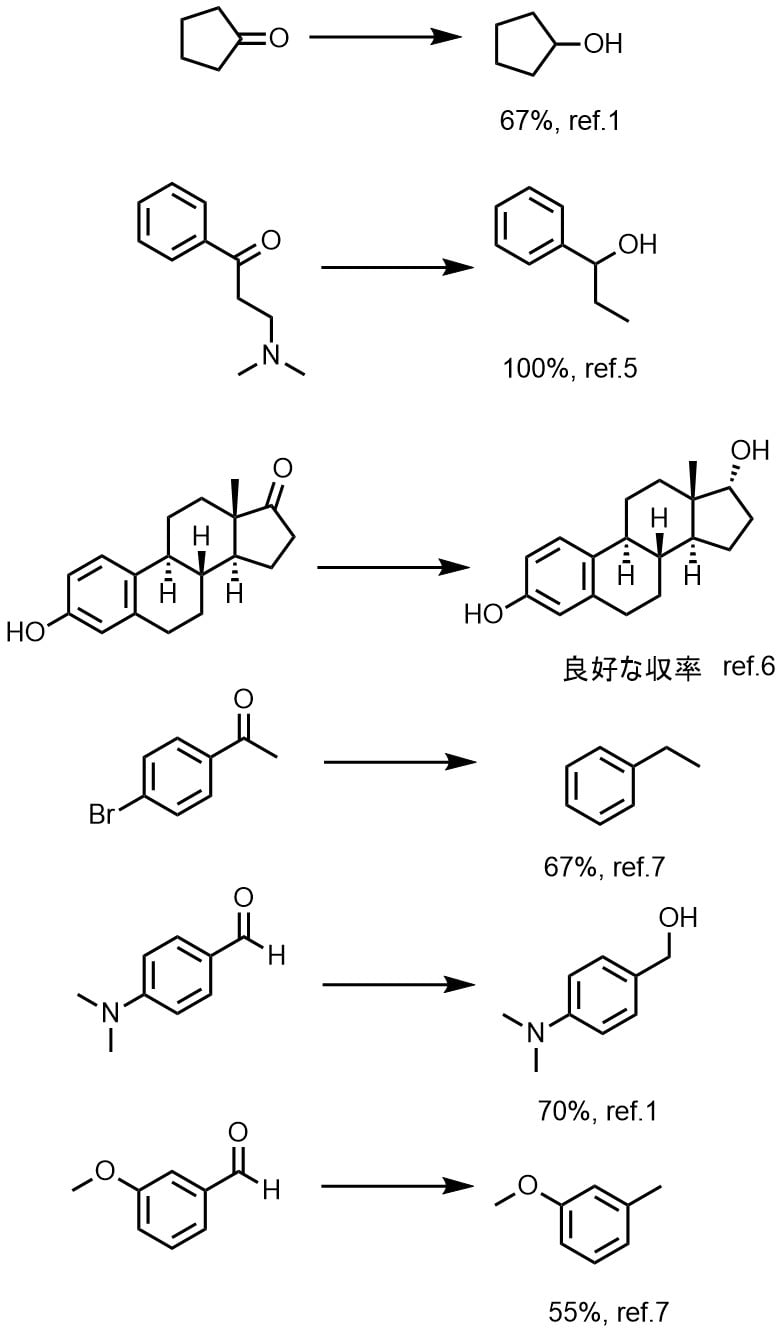
ケトンの還元は中程度の収率で進行します。反応条件によってアルカンまで還元されます。ニトロ基、シアノ基やオキシムなども同様に還元されます。ハロゲン化アリールやアリールエーテル、ジメチルアミノ基などは還元されることがあるので注意します。
ラネーニッケルによる脱硫反応
ラネーニッケルによる反応といえば、脱硫反応が有名です。チオールからスルフィド、スルホンなども還元されて脱硫されます。チオフェンなどのヘテロ環も還元・脱硫されてアルカンを与えます。
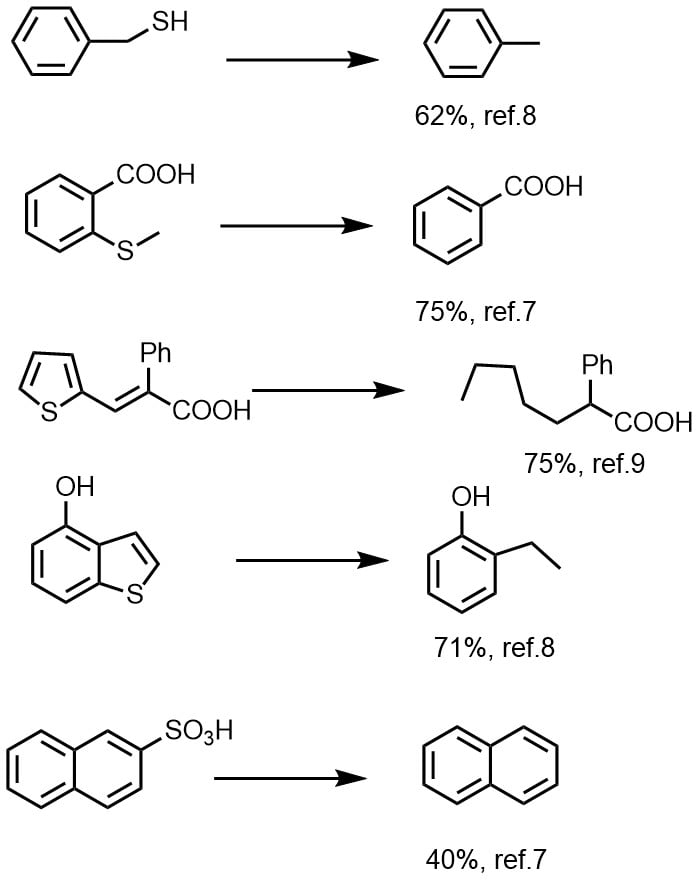
ケトンのジチオアセタールはラネーニッケルにより処理することにより、脱硫されてアルカンを与えます。ジチオアセタールの還元はラネーニッケルW2とアルコール(エタノール、メタノール)、アセトン等を溶媒として加熱還流して反応させることが多いです。
ラネーニッケルの触媒毒
ラネーニッケルはパラジウムなどの他の金属と同様に触媒毒により被毒されます。ラネーニッケルを被毒するものとして、リン、硫黄、4置換ケイ素、ハロゲン化合物、ハロゲン化物イオンなどがあります1)。
1)J.N.Pattison, E.F.Degering, J.Am. Chem. Soc., 73, 1951, 611
ラネーニッケルの調製方法
ラネーニッケルは市販品が売っているので合金を作る必要はありません。塩基性に耐える基質であれば10%程度の水酸化ナトリウム水溶液を溶媒として、ラネーニッケルと基質を加えるだけで反応できます。塩基に弱い化合物など、活性化状態のラネーニッケルを用意したい場合は活性化を行います。ラネーニッケルは処理方法の違いによって活性の異なるグレード品(W1-W7)ができます。ラネーニッケルの活性の高さは基本的に数字が大きいほど高いがW8は活性が低く、W6が最も活性が高いです。W6は白金触媒と同等の活性を持つため注意します。活性が高いため爆発的に反応が進行したり、過剰還元などの副反応が起こることがあります。また、調整したラネーニッケルは徐々に活性を失うので調製したらすぐに使用したほうがよいです。
W1 – ラネーニッケルの調製
水酸化ナトリウム水溶液(水酸化ナトリウム30gを水120 mL)を氷浴して、ラネーニッケル30gを撹拌しながらすこしずつ加えます。その後110℃で4時間、その後19%水酸化ナトリウム水溶液40mLを加えて3時間110℃撹拌して水素の発生がやんだら室温に冷却し、水を加えて300 mLにメスアップして撹拌後 放置して上澄みをデカンテーションで捨てた後、再度同量の水を加えて同じ操作を合計6回繰り返す。沈殿をブフナー漏斗で吸引ろ過する(注意:水が完全に無くなって、ラネーニッケルが露出しないようにする!)。洗浄液が中性になるまで洗浄したら、95%エタノールで150 mLで3回洗浄後、得られた固体をエタノール中で保存する。
参考)Covert, Lloyd W., and Homer Adkins. “Nickel by the Raney Process as a Catalyst of Hydrogenation.” J. Am. Chem. Soc., 54.10 (1932): 4116-4117.
W2-ラネーニッケルの調製
水酸化ナトリウム水溶液(水酸化ナトリウム190g、水1.5L)を氷浴で冷却後、ラネーニッケルを150g撹拌しながら少しずつ加える。液温は25℃を超えないように加える。ラネーニッケルを加え終わったら、室温まで昇温し、水素の発泡が穏やかになったら加熱していき発泡が収まるまで十数時間放置する(水が蒸発して少なくなっていったら水を加えて露出しないように心がける)。反応後、室温まで冷却、デカンテーションで上澄みを除き、水1Lを加えて撹拌後再度デカンテーションで上澄みを除く作業をもう一度繰り返して得られた固体を別容器に移して、水酸化ナトリウム水溶液(NaOH25g、水250mL)を加えて、よくかき混ぜた後、再度上清を捨てる。その後水を加えて撹拌して上澄みを捨てる作業を洗浄液が中性になるまで繰り返す。エタノール100mLで3回洗浄し、得られた固体は無水エタノール中で保存する。
W3-ラネーニッケルの調製
ラネーニッケル1gに対してNaOH水溶液10mLを食塩氷浴(-20℃)で冷却し、ラネーニッケルを少しずつ加えた後、50℃、50分間反応させて調整します。室温まで冷却後、上澄みを除去、水で中性になるまで洗浄後、エタノールで置換して、エタノール中に保存します。
その他のラネーニッケルの調整方法は文献を参照してください。
http://orgsyn.org/demo.aspx?prep=cv3p0176
ラネーニッケル調整法の違い
Type NaOH/Al(molar) NaOHaq conc.(wt%) Temp.(timie:h) 水洗浄の仕方 w1 1.35 17 115-115, (4) デカントで中性に w2 1.71 20 75-80, (8-12) でかんとで中性に w3 1.73 20 50(0.83) ろ過して中性 w4 1.73 20 50(0.83) ろ過して中性 w5 1.80 21 50(0.83) ろ過して中性 w6 1.80 21 50(0.83) ろ過して中性後H2置換 w7 1.80 21 50(0.83) エタノールで洗浄 Encyclopedia of reagents for organic synthesis: 11. (2009). Chichester: Wiley. p.8541
ラネーニッケルのクエンチ方法!
ラネーニッケルによる反応後は磁石にくっつくので、フラスコ内に貼り付けた状態で反応溶液を分離した後、残ったラネーニッケルに塩酸を加えると水素を出しながら溶解し、クエンチすることができます。ラネーニッケルの洗浄後にラネーニッケルを乾さないように気をつけ、すぐに処理するするようにしましょう。希塩酸の他に希硫酸や希硝酸なども使えます。
ラネーニッケルの利点や欠点は?
ラネーニッケルは古くから使用されている還元剤の一つです。利点として
- 多くの官能基を還元
- 低コスト
- 水素添加しなくても進行する反応もある
- 芳香環(ヘテロ環)を還元できる
- 脱硫反応の強力な選択肢
- 立体選択性が他の還元とは異なる
があります。一方で欠点は、
- 活性のばらつき出やすい
- 発火の危険性がある
- 還元の選択性が低い
- 使用できる溶媒が限定される(アルコールや水)
- 二段階の還元は過剰還元が起こりやすい
などの欠点あがります。脱硫反応においてはよく利用されている印象があります。
 こめやん
こめやん
ラネーニッケルの発火はなぜ起こる?
ラネーニッケルは乾燥状態で空気触れるようになると自然発火します。そのため、空気に触れないように溶媒中(ヘキサンやジオキサン、エタノールや水)などに保存します。安価な点が利点でコスト面ではラネーニッケルは良い選択肢ですが、危険性もあがるので大スケールでは他の還元法を使用したほうが良い場合もあります。
ラネーニッケルが水素を添加しなくても還元性を示す理由
ラネーニッケルを調製するときに、アルカリで溶解させたアルミニウムから発生した水素がニッケルに吸着しているからです。反応によっては水素を添加させて反応することもあります。
参考文献
ref.1) John. T. K.: Krishna Rao, G. S. Indian J. Chem. 1979. 1b) Cook, P. L. J. Org. Chem. 1962, 27, 3873-3875.
ref.2) Yang, S. C., et al., Lab. Anim. Sci. 1988,38, 563-567.
ref.3) Lunn, G.; Sansone, E. B. J. Org. Chem. 1986,51, 513-517.
ref.4)Papa, D. et al., J. org. chem., 1949, 14, 366-374.
ref.5) Tyman, J. H. P. J. AppE. Chem. 1970,20, 179-182.
ref.6) Whitman, B.; Wintersteiner, 0.;Schwenk, E. J. Biol.Chem., 1937, 118, 789-795.
ref.7) Schwenk. E., et al., . J. Org. Chem. 1944, 9, 1-8:
ref.8) Papa, D.; Schwenk, E.; Ginsberg, H. F. J. Org. Chem. 1949, 14, 723-731.
ref.9)Buu-Hoi. N. P.: Sv. M. Compt. Rend. 1956, 242, 2011-2013.
ref10) Larry, K. Keefer, Chem. Rev. 1989, 89, 459-502
ラネーニッケルの脱硫反応) Rentner, Jana, et al. “Recent advances and applications of reductive desulfurization in organic synthesis.” Tetrahedron 70 (2014): 8983-9027.
ネットde科学のツイッターではサイトの更新情報を配信しています!是非フォローFollow @netdekagaku