ジエチル亜鉛などの有機亜鉛化合物は金属ー炭素結合を持つ化合物の最初の報告例であり、1849年にエドワード・フランクランドにより合成されました。
古くから知られる有機亜鉛化合物はグリニャール試薬や有機リチウム化合物などの有機金属化合物と比べて反応性が劣っており、見放されがちでしたがその特徴である「穏やかな反応性」が着目され、特徴を活かした高選択的な合成方法の探索が注目されています。
Lennartson, A. Zinc of unsuspected worth. Nature Chem 6, 166 (2014) doi:10.1038/nchem.1848
本記事では有機亜鉛化合物の合成方法や反応、特徴などをまとめてきます。
有機亜鉛化合物とは?
有機亜鉛化合物は最も古くから知られる有機金属化合物であり、有機亜鉛化合物を用いた反応はたくさん知られています。
例えば、
- ジエチル亜鉛のカルボニルに対する求核付加
- 亜鉛エノラートを利用したレフォルマトスキー反応
- 有機亜鉛カルベンを利用したシクロプロパン合成法のシモンズ・スミス反応
- グリニャール試薬の亜鉛版と称されるバルビエ反応
- 有機亜鉛化合物と有機ハロゲン化物とのクロスカップリング反応である根岸カップリング
などが挙げられます。しかしながら、亜鉛の反応性の低さと有機亜鉛化合物の不安定性・調整方法の少なさから、あまり利用されません。
実際に教科書を始めとして、学生実習や研究においてもグリニャール試薬や有機リチウム試薬等の有機金属化合物と比べて目にする機会は少ないと思います。
しかし近年は反応すれば良いのではなく、「反応の選択性」が重要視されています。特定の官能基のみに反応する「官能基選択性」、特定の立体異性体を得る「ジアステレオ選択性」「エナンチオ選択性」などが求められています。
「有機亜鉛化合物の反応性の低さ」は言い換えれば「穏やかな反応性」と言えますから、求電子種に対して何でも攻撃しまくる有機リチウム試薬よりも、一部の化合物のみと反応する有機亜鉛化合物のほうが選択性の面で優れていると考えられます。
また、反応性が低いということはそれだけ多くの官能基が存在していても有機亜鉛試薬を調整できます。
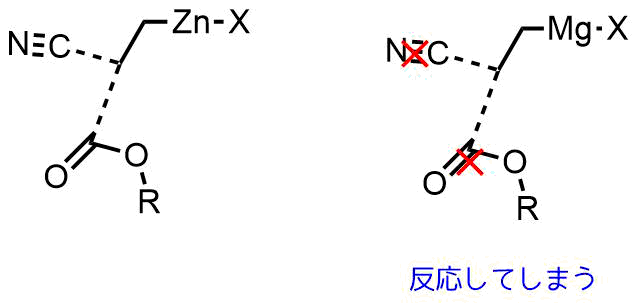
亜鉛試薬の安定性例
有機亜鉛試薬の安定性を示す例としては、「酸塩化物」を用いたケトン合成があります。
有機亜鉛化合物は反応性が低いのでケトンとは反応しにくく、反応性の高い「酸塩化物」と反応します。したがって、有機亜鉛化合物を用いると選択的にケトンを得ることができます(有機リチウム試薬ではさらに攻撃して第三級アルコールになってしまう)。
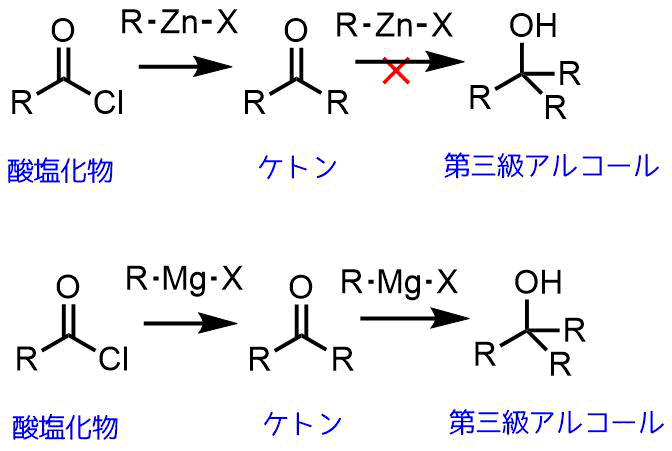
有機亜鉛試薬と酸塩化物との反応の利点
有機亜鉛化合物はケトン、エステル、アミド、二トリル、アミンなどの他のカルボン酸誘導体とは反応しにくいです。アルデヒドでさえも室温では反応しにくいです。
有機亜鉛化合物には主に
- 有機ハロゲン化亜鉛 (RZnX)
- ジアルキル亜鉛 (R-Zn-R)
があげられます。
有機亜鉛化合物の特徴
有機亜鉛化合物の反応性の低さは何に由来するのでしょうか?
そもそも有機金属化合物の反応性が高いのは、電気陽性の金属原子と中性の炭素原子との結合の分極・弱さが由来しています。
炭素の電気陰性度は2.55です。比較的安定な水素との結合は電気陰性度の差が0.35と小さくほとんど分極していません。
一方でアルカリ金属のLiは電気陽性が0.98と高く、炭素との電気陰性度の差は1.57もあります。これほど差があることから、炭素-リチウム結合は炭素側に電子が大きく偏っている(分極している)ため、かなりイオン性であり、結合も弱く切れやすくなっています。有機リチウム化合物は最も反応性の高い有機金属試薬の一つです。グリニャール試薬はMg炭素結合をもっていてこれもかなり分極しています。これを見ると亜鉛は1.65と二者と比べて電気陽性は小さく、炭素ー亜鉛結合間の分極が小さいことも予想できます。亜鉛と炭素は共有結合性が強い、安定な結合を持っています。だから反応性が低いと思われます。

注意:結合の弱さ、反応性の高さは電気陰性度だけでなく、原子半径なども関わってきます。ヨウ素と塩素をみるとヨウ素のほうが電気陰性度の差は小さいですが、結合の切れやすさ、反応性はヨウ化アルキルのほうが断然高いです。
参考 電気陰性度 - Wikipedia各原子の電気陰性度表
有機亜鉛試薬の調製法(Rieke zinc)
有機亜鉛試薬の調製には亜鉛源として金属亜鉛粉末を試薬として利用することがあります。亜鉛粉末の表面酸化膜を除くために希塩酸や希硫酸で皮膜除去したり、TMSClの添加、ヨウ素の添加などの活性化方法があります。
最も活性が高い金属亜鉛としてはRieke亜鉛があります。
Rieke亜鉛は不活性雰囲気下、塩化亜鉛をTHFやDMEなどのエーテル溶液中2当量の金属リチウムと2当量のナフタレンを加えて塩化亜鉛を還元して得た亜鉛です。
Rieke亜鉛は活性が高く有機亜鉛試薬の調製に向いています。
この調製法で得られた亜鉛は副生する塩化リチウムとナフタレンをTHFで洗浄することで簡単に除くことができます。
また、Rieke亜鉛はArdrichなどから販売されているので購入することもできます。Rieke亜鉛を使わないと臭化アルキルや芳香族ブロミドから有機亜鉛試薬の調製は難しいです(ヨードアルキルは市販亜鉛粉末で比較的簡単に調製可能)。
Rieke 亜鉛の調整法 – 改良版
Rieke亜鉛は調製法によって反応性にばらつきがあるなど職人技的なところがありました。ナフタレンを加える方法はリチウム表面を亜鉛が被覆するのを防ぐためですが、実はそれ以外にもナフタレンに含まれる不純物のベンゾチオフェンが重要な役割を果たすことを発見しています。
改良Rieke亜鉛の調製法:シュレンク管にZnClを塩化チオニルを少量しめるくらい加えてバーナーで加熱してZnClを溶解後、アルゴンを流しながら室温まで冷却して乾燥ZnClを調製し、この乾燥ZnCl(1.1eq)に脱水THF(25 mL)を溶解し、別容器に Li(2.2eq), ナフタレン(2.25 eq), ベンゾチオフェン(0.04eq)、脱水THF(25mL)を加えて2時間攪拌した。ZnCl溶液をカニュレを使って10~15分かけて滴下して1時間攪拌、生成した亜鉛は沈殿するので上清を捨ててそのまま反応に利用できます。不純物が気になる場合はAr雰囲気下で脱水THFで洗浄しても良いと思います。
シュレンク管がない場合は通常のナスフラスコでも問題なくできると思います。実際に普通のRieke亜鉛の調製法も原典?はシュレンク管でやっていますが、フラスコでもできました。
改良Rieke亜鉛調製法の詳細は以下の論文に書いてあります。
Kudret, Suleyman, et al. “An efficient and reliable procedure for the preparation of highly reactive rieke zinc.” Advanced Synthesis & Catalysis 355.2‐3 (2013): 569-575.
有機亜鉛ハロゲン化物 (RZnX)の調製
有機亜鉛ハロゲン化物はグリニャール試薬の亜鉛版とも言える試薬です。
調製方法自体は比較的簡単で、有機ハロゲン化物と活性亜鉛をTHFなどの溶媒中で撹拌することによって調製可能です。
調製しやすいものはヨードアルキルで臭化アルキルや塩化アルキルはRieke亜鉛などを使わないと難しいです。KIなどを加えて系中でヨードアルキルに変換する方法も利用されます。
またアルケニル、アリル、アリールハロゲン化物の変換はアルキルハライドと比べて難しいです。基本的にヨウ素化物を用います。
活性亜鉛を脂肪族やベンジルハライドには(1~1.5eq)、芳香族ハライドには(1~3eq)ほ℃用います。溶媒にはTHFを用いてベンジルハライドでは0℃に保った状態で有機ハロゲン化物を滴下して加えて0℃で3時間ほど撹拌して調製します。溶媒は使わないこともあります。脂肪族は室温、芳香族は還流して調製します。
有機亜鉛化合物の反応
酸塩化物との反応
酸塩化物に対してハロゲン化アルキル亜鉛(RZnX)を作用させるとケトンを合成できます。これは有機亜鉛化合物の反応性が低いことからケトンへの求核付加反応が起こらないからです。実際に有機亜鉛化合物はアルデヒドに対しても室温では反応しないことがしられています。
こうした有機亜鉛化合物の反応性の低さは選択性に重要なものの、反応が長時間になる、収率が低下するなどの問題があります。
有機亜鉛化合物の反応性を向上させるためにCuIを加える方法(CuCN・LiBrを低温下加えることも)が有用です。銅塩を加える方法は系中で有機銅試薬を発生させていると考えられます(有機銅試薬のほうが反応性が高い)。
ジアルキル亜鉛も塩化アルミニウムなどのルイス酸を用いることでケトン合成に利用可能です。

反応例1
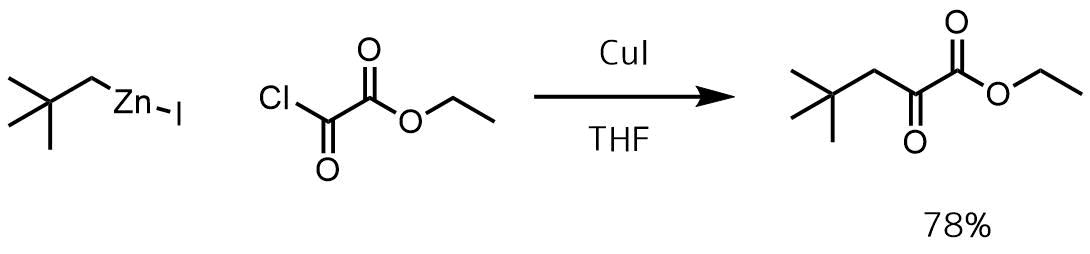
Zhou, Yuefen et al WO.2008082725, 10 Jul 2008
N2雰囲気下-20°CでTHF(15mL)CuI(2.29g、12mmol)の懸濁液に、有機亜鉛試薬(0.5M in THF、24mL、12mmol)をゆっくり加えました。混合物を-20℃で10分間、0℃で20分間撹拌した。-20℃に冷却し、酸塩化物(1.12mL、10mmol)を加えた。反応混合物を1時間かけて25℃に温めた。反応後、飽和NH4Cl水溶液でクエンチして精製処理を行い目的物を78%で得た。
有機亜鉛化合物を経由した場合、ギルマン試薬(R-Li, R-MgBr)よりも嵩高い第二級や第三級アルキルを酸塩化物に導入しやすいです。
ヨウ化銅を使った反応例です。有機亜鉛試薬はヨウ素体とRinke亜鉛から調製した溶液を使います。CuCN·2LiClを用いる例も多いです。シアン化銅は1eq, LiClは2eq加えます。芳香族亜鉛化合物の場合にCuCNを用いる例が多い気がします。
αβ不飽和カルボニルとの反応
有機亜鉛化合物はHSAB則でいうソフトな求核剤であることからαβ不飽和カルボニルに対しては1,4付加反応が選択的に進行すると考えられます。
そのままでは反応性が低いためシアン化銅(CuCN・LiBr)を加えて反応させることが多いようです。

レフォルマトスキー反応 Reformatsky reaction
αハロエステルと亜鉛により発生させた亜鉛エノラートとアルデヒド・ケトンとの反応によりヒドロキシエステルを得る反応です。アルドール縮合と同じく脱水によりαβ不飽和エステルを合成可能です。
亜鉛エノラートの有用性は傘高いケトンなどに対しても反応しやすい点があげられます。副反応も少ないのが特徴です。
反応例1
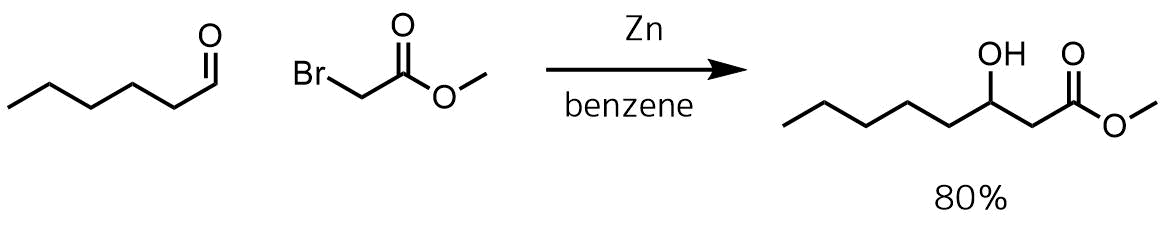
Radivojevic, Jelena et al Applied Microbiology and Biotechnology, 100(1), 161-172; 2016
10mlの脱水ベンゼンと活性化亜鉛粉末(2.28g、35mmol)の懸濁液を10分間加熱還流し、60mlのベンゼンに溶解したn-ヘキサナール(4ml、33mmol)とメチルブロモアセテート(5.54ml、35mmol)の混合物を1時間かけてゆっくりと加えた。 2時間後、反応混合物を0℃に冷却して1 M HClを加えて反応混合物を酸性にし、抽出して精製処理を行い目的物を80%で得た。
一般的なレフォルマトスキ反応の例です。活性化亜鉛の調製が面倒なところもありますが穏やかな条件で反応できます。
シモンズ・スミス反応 simmons-Smith reaction
亜鉛カルベノイドを用いたシクロプロパン環の合成です。
根岸カップリング
根岸カップリングは有機ハロゲン化亜鉛とアリールハライドとの触媒的カップリング反応です。Pd(PPh3)4などのパラジウム触媒を使って反応させます。

Gennari, Marcello et al Journal of Physical Chemistry Letters, 5(13), 2254-2258; 2014
参考 根岸クロスカップリング: Negishi Cross Coupling | ネットde科学ネットde科学