- カルボン酸、ケトンの合成に使用
- 第一級アルコールをカルボン酸に酸化する方法として有名
- 酸に弱い基質には不向き
- クロム酸酸化の先駆け(1946年)
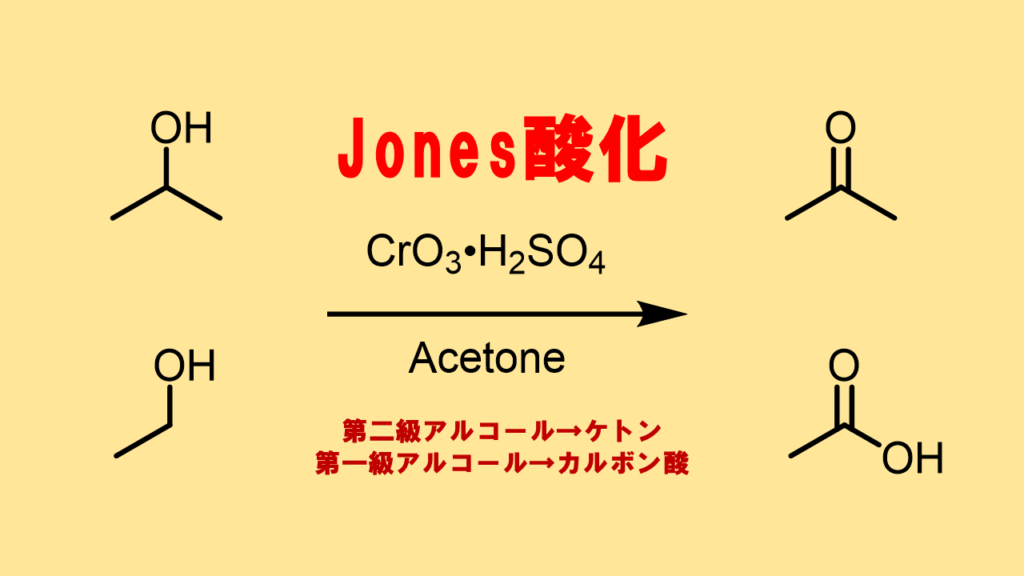
Jones酸化とは?
Jones酸化(ジョーンズ酸化)はクロムを使った酸化方法です。
ジョーンズ酸化では「第一級アルコール」を「カルボン酸」に、「第二級アルコール」をケトンに変換します。
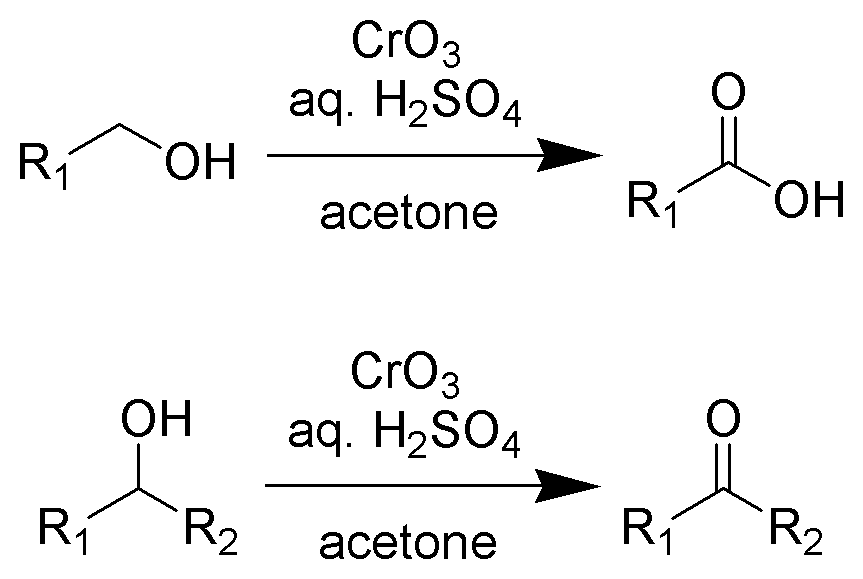
ジョーンズ酸化の概要 from wikipedia pubulic domain
ジョーンズ酸化は無水クロム酸(CrO3)の問題である
- 有機溶媒に溶けにくい
- 爆発性がある
- 過剰酸化が起こる
という問題がありました。
無水クロム酸はtert-ブチルアルコールやピリジンなどの極性の高い有機溶媒にしか溶けず、しかも有機溶媒に溶かした状態は不安定で、爆発の危険がありました。
Jonesは1946年にアセトン+硫酸水溶液中では安定なことを発見し、ジョーンズ酸化が生まれました。
アセトンは過剰酸化を防止する作用があります。
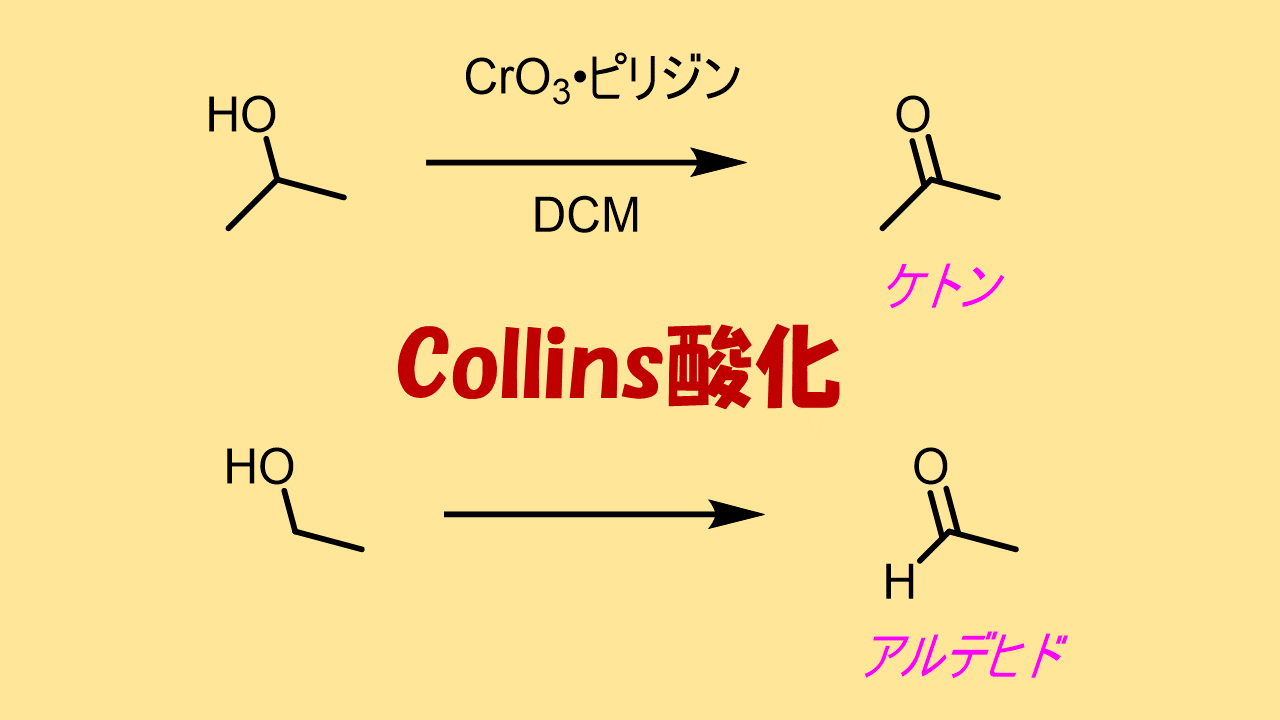
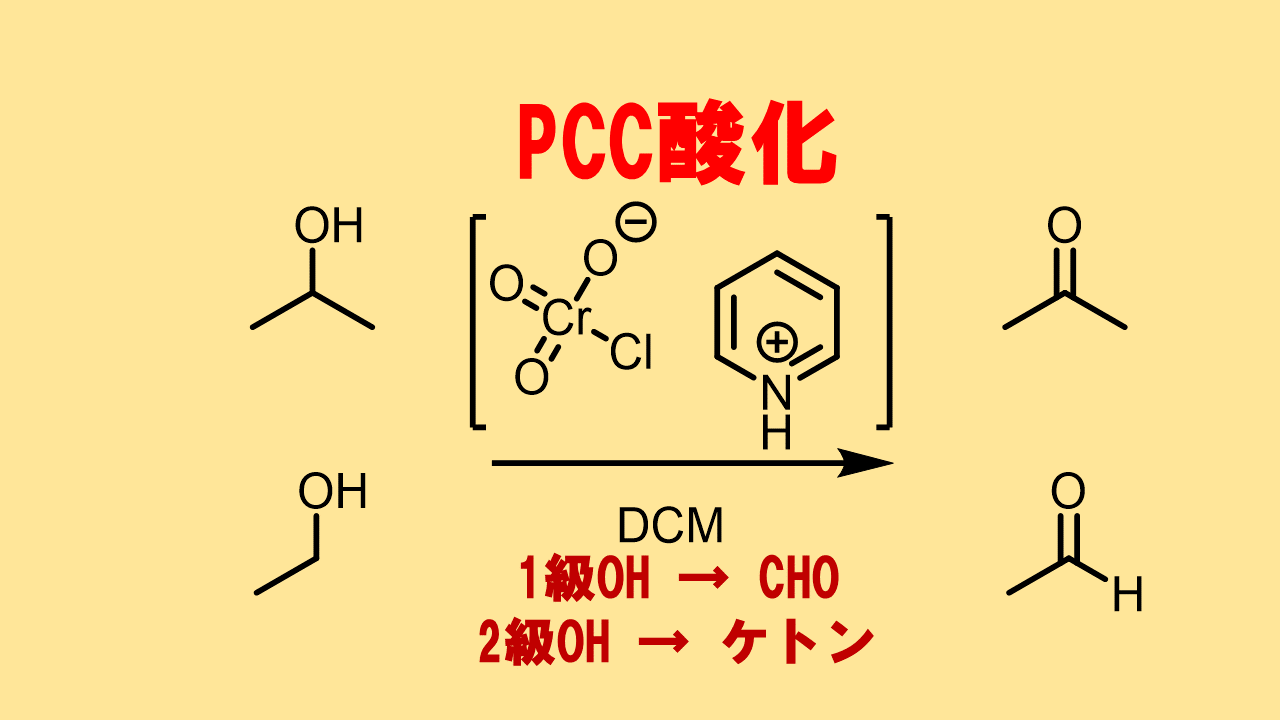
Jones酸化は無水クロム酸を用いた様々な酸化方法(sarett酸化、collins酸化、PDC酸化、PCC酸化等)が生まれる始まりといえますね。
ジョーンズ酸化の利点は
- 第一級アルコールをカルボン酸まで酸化可能であること
- 第二級アルコールのケトンへの酸化は簡便で固体廃棄物がでないので処理が楽
などが挙げられます。通常はPDCやPCC酸化の方が温和で酸性条件でないのでそちらをチョイスすることも多いです。
有機化学者Ewart Jones(1911-2002)について
ジョーンズの専門分野はステロイドやテルペン類(ビタミンA)です。特にビタミンA等の天然物が持つポリエンを重要視しており、その合成に熱心でした。ジョーンズ酸化もこの研究中に生まれたものです。
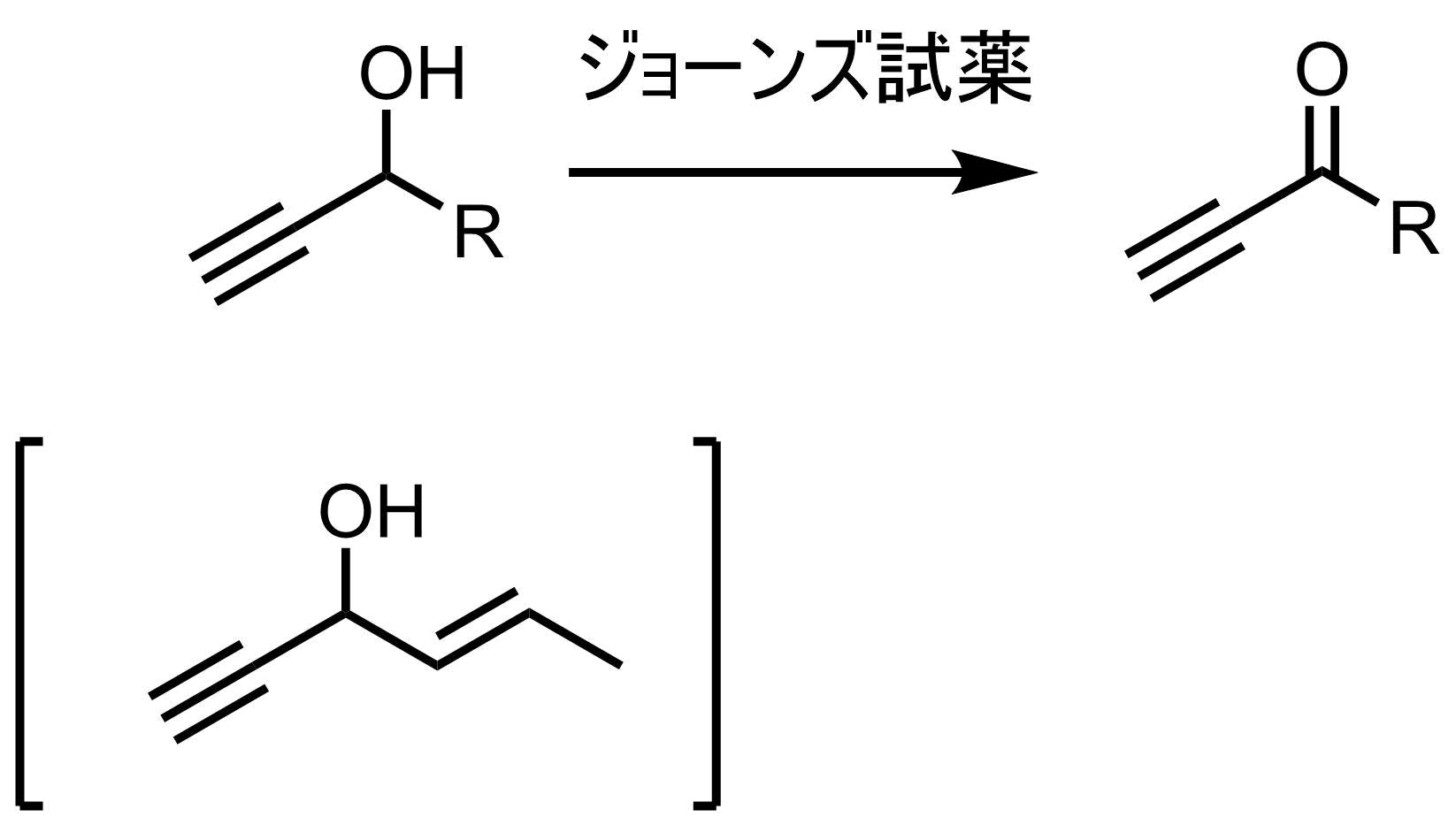
“Researches on acetylenic compounds. Part I. Bowden, K.; Heilbron, I. M.; Jones, E. R. H.; Weedon, B. C. L.; J.Chem.Soc. 1946, 39.
ジョーンズ酸化の反応機構
まず、無水クロム酸のクロムにアルコールがアタックします。
水素を奪って酸化クロム(IV)が生成するのと同時にアルデヒドが生成します。
このとき、ジョーンズ酸化では硫酸水溶液で反応を行っているので、アルデヒドが水和され、無水クロム酸と反応を起こすことによってさらに酸化されて、カルボン酸が生じます。第二級アルコールの場合は一段階で終わります。
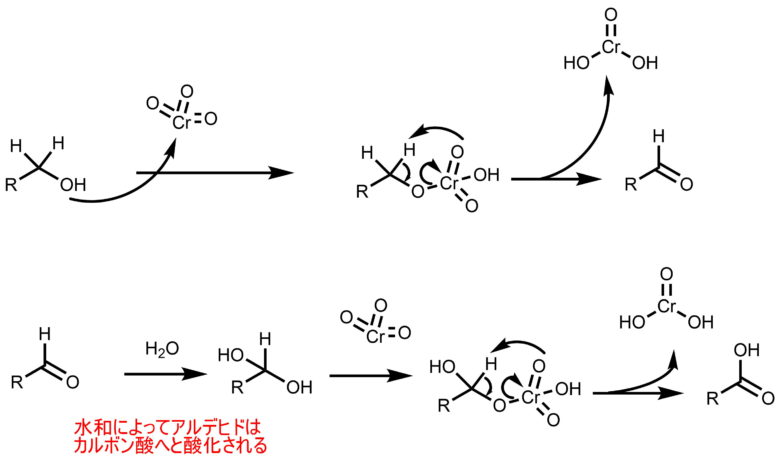
もし系中に水がなかったら?
反応機構をみると、アルデヒドの水和物(gem-ジオール)が生成することによってカルボン酸への酸化が始まるのがわかります。もしも系中に水がなければ、第一級アルコールの酸化をアルデヒドに止めることができます。こう考えて生まれたのがcollins酸化などです。
条件・操作手順
Jones試薬の作り方(爆発、有毒性に注意。ドラフトで)
0.2 g-0.4 gの無水クロム酸(CrO3[MW.100.0])を三角フラスコ等に入れ、そこに100 mL標線になるまで水を加えます。よく溶かしたら、氷浴で冷やし、撹拌しながら0.2 mL -0.4 mL の濃硫酸をピペットでとてもゆっくりと加えて、クロム酸硫酸水溶液を作ります(2-4 mol/ L)。Jones試薬は赤い溶液です。一応作り置きできます。有機物にふれると危険なので容器はきれいに洗浄したガラス容器に入れましょう。Jones試薬に使用したガラス器具は水でゆすいでその液を集めます。ゆすいだ水に冷やしながらゆっくりとイソプロパノールを加えてクエンチさせます(なければエタノールとかでもOK)。赤から緑に変色したらクエンチ終了です。(6価クロム(赤)→3価クロム(緑))。クエンチ後の三価のクロムの毒性は低いですが、重金属なので、定められた廃棄物処理法に従って廃棄してください。
硫酸の量を減らすと酸に弱い基質でも侵されにくくなる。そのかわり、酸化力も落ちる。
Jones酸化のやり方
10 – 500 mMのアルコールが入ったアセトン溶液にジョーンズ試薬を滴下して加えます(氷浴)だいたい、アルコールに対して1.1-5当量のクロム酸を目安にジョーンズ試薬を加えます。そのまま撹拌して(0℃→室温)TLCで反応をチェック(一級アルコールならRfが下がる。二級アルコールはDNP発色試薬で確かめる)反応が終了したら(反応は速く10分-1h程度で終わる長くても半日程度)、イソプロパノールを加えてクエンチします。緑に変色したら、硫酸をNaHCO3水溶液or量が多いときは発泡しないNaOHaqで中和した後、有機溶媒で抽出します。もしも極性が高くて抽出しにくい場合は酸性状態で有機溶媒で抽出します。有機層を飽和食塩水で洗浄、硫酸ナトリウムで乾燥後、お好きな方法で精製してください。
官能基許容性・選択性について
硫酸を使用することから、酸に弱い基質は向いていないとされるジョーンズ酸化ですが、以外と大丈夫なことも多いです。
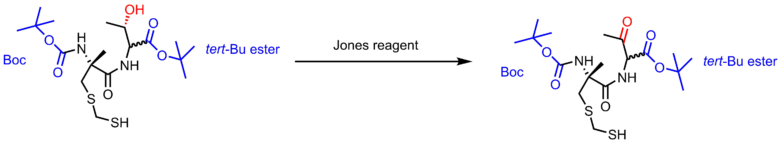
全合成で有名な福山らは(-)-tantazole Bという物質の合成で酸性に不安定なBoc基やtert-ブチルエステルを持つ化合物にJones試薬を使用して60%程度の収率でケトン体を得ています。
Fukuyama, T.; Xu, L.; J.Am.Chem.Soc. 1993, 115, 8449
Proventらの報告では1,3-ジオールの酸化はCollins酸化、PCC酸化、MnO2、TEMPO酸化、swern酸化、デスマーチン酸化でも達成できなかったが、Jones酸化ではできた模様です。
Provent, C.; Chautemps, P.; Pierre, J.-L.; Synth.Commun. 1995, 25, 1907.
Jones酸化に耐える可能性のある官能基
TBS基、MOM基、t-Bu-ester、エステル、芳香族環状アセタール(安定な)、糖のアセタール、アミド、カルバメート(Boc基)、脂肪族アミン、エポキシド、ピリジン、一部のスルフィド(スルホキシドやスルフォンに変換されるかも)
反応する危険性が高い構造
TMS基、THP基、MMt基、アルデヒド基(カルボン酸へ)、ジメチルアセタール、ラクトール(ラクトンへ)
予想される副反応
アルコールのβ位が嵩高い構造のとき、C-C結合が切れてカルボカチオンとアルデヒドが生成するルートが考えられます。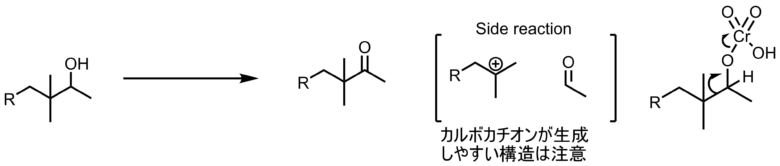
ケトンの酸化時にはαβ不飽和ケトンまで酸化される可能性もあります。
注意点
- 有機物にふれると爆発的に反応する危険がある。アルコールの溶液はアセトン以外は使用しない。ジョーンズ試薬は何事もゆっくりと加えて、冷やしておく。大量に使うときは注意
- 六価クロムは毒性が強く、環境汚染も引き起こす物質で取扱に注意する。誤飲や接触はもちろん、水道に流すなどもせず、適切な廃棄をする。
参考・文献
Researches on acetylenic compounds. Part I. Bowden, K.; Heilbron, I. M.; Jones, E. R. H.; Weedon, B. C. L.; J.Chem.Soc. 1946, 39