フリーデルクラフツ反応は芳香族化合物と求電子試薬との間で起こる化学反応です。
フリーデルクラフツ・アシル化反応はそのうち、酸塩化物を求電子試薬として芳香環をアシル化する反応です。
芳香環をアシル化することでケトンを合成することが可能です。
フリーデルクラフツ・アシル化の特徴と利点
フリーデルクラフツ反応によって芳香族ケトンの合成が可能です。
フリーデルクラフツ反応は1877年にFriedelとCraftsらによって発見されました。
フリーデルクラフツ反応は
- フリーデルクラフツ・アルキル化
- フリーデルクラフツ・アシル化
の2つに分けられます。
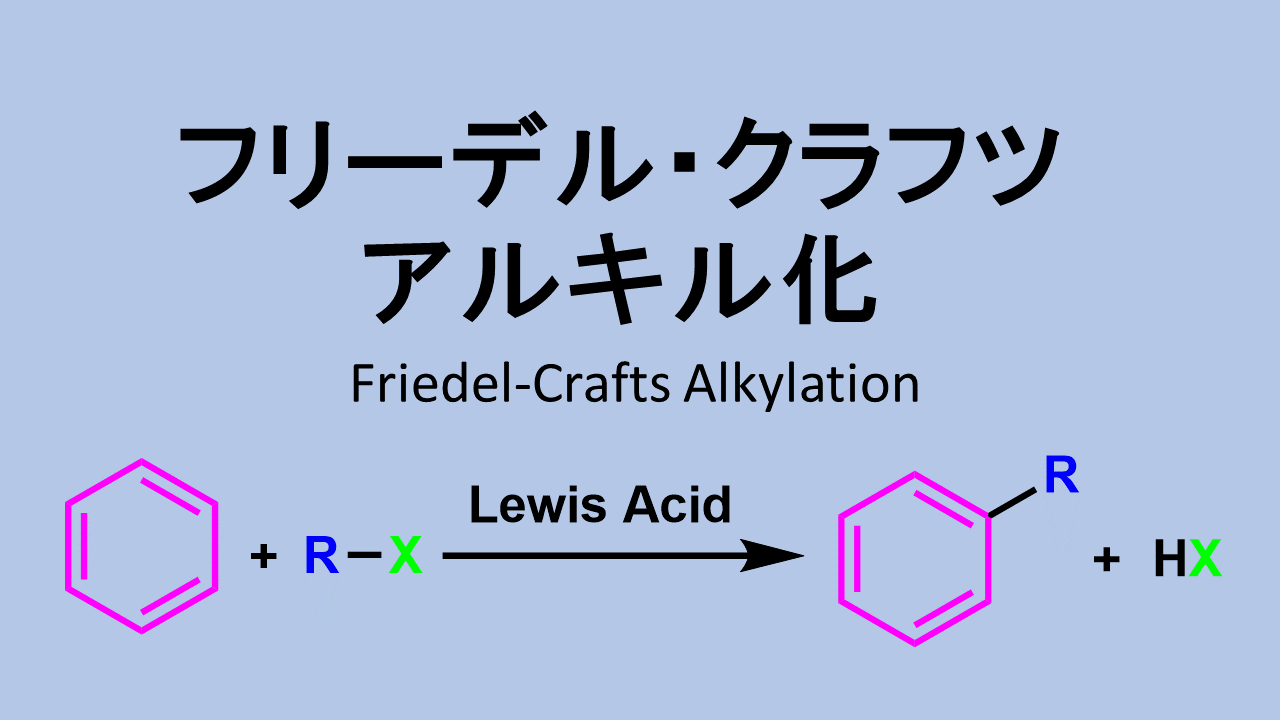 フリーデル-クラフツ アルキル化: Friedel-Crafts Alkylation
フリーデル-クラフツ アルキル化: Friedel-Crafts Alkylation
 フリーデル-クラフツ アシル化: Fridel-Crafts Acylation
フリーデル-クラフツ アシル化: Fridel-Crafts Acylation
フリーデルクラフツ・アルキル化は置換反応が連続して起こって制御が難しいので、有機合成ではフリーデルクラフツ・アシル化が良く利用されます。
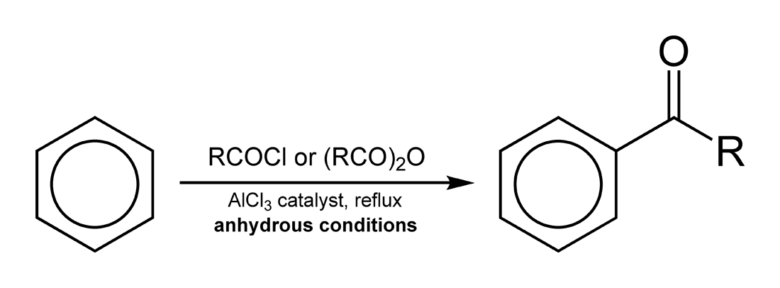
フリーデルクラフツ・アシル化反応 from wikipedia public domain
基質(芳香族化合物)
求電子置換反応は電子豊富な芳香族化合物で起こりやすく、フェノール類などは特に反応しやすいです。ハロゲン程度の電子求引基が入ってもフリーデルクラフ反応は進行しますが、ケトン、アルデヒド、カルボン酸、ニトリル、CF3、スルホニル、ニトロ基などの強い電子求引基で置換された芳香環は反応しないです。ニトロベンゼンを溶媒として利用することがあるくらいです。
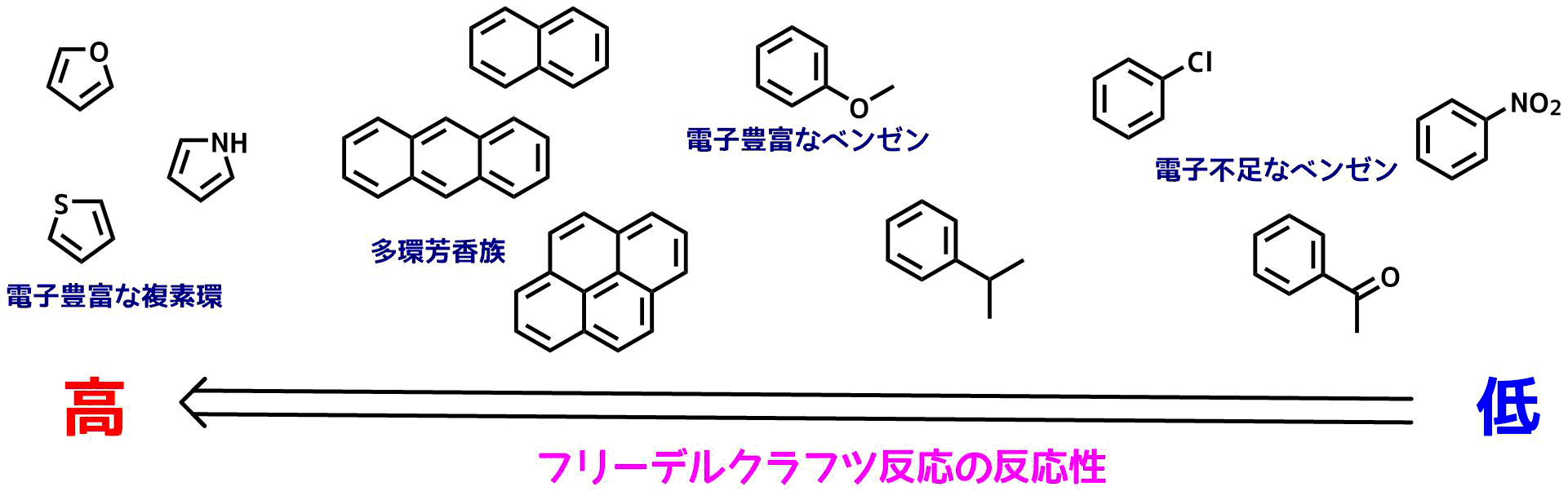
フリーデルクラフツ反応しやすい芳香環
求電子剤
求電子剤は酸塩化物もしくは酸無水物を利用します。
酸塩化物は長鎖アルカン、傘高い分岐アルカン、シクロアルカン、オレフィン、などがあると収率は低下します。
触媒
塩化アルミニウム(無水)が代表例ですが、他にもFeCl3、TiCl4, SnCl4、BF3、硫酸、リン酸などが使われます。
塩化アルミニウムを用いた時は酸ハロゲン化物の反応性はヨウ素が最も大きいですが、三フッ化ホウ素を用いた時は逆転して酸フッ化物が最も反応性が高いです。
近年希土類トリフラートなどのルイス酸に高い触媒活性があることが報告されています。
塩化アルミニウムがファーストチョイスでトリフルオロメタンスルホン酸、四塩化スズ(II)、硫酸、三塩化鉄、
溶媒
溶媒としては四塩化炭素、ジクロロメタン、ニトロメタン、クロロホルム、二硫化炭素、ニトロベンゼンあるいはニートで行うこともあります。
溶媒の種類によって位置選択性を調整できます。
二硫化炭素はかつてよく利用されていましたが、毒性があるため避けたほうが良いかもしれません。
フリーデルクラフツ・アシル化の機構
フリーデルクラフツ・アシル化はルイス酸による酸塩化物の活性化により開始します。酸塩化物に対して塩化アルミニウムが反応すると活性が高いアシリウムイオンが生成します。
求電子性の高いアシリウムイオンは芳香族化合物と求電子置換反応を起こしてアシル化が進行します。
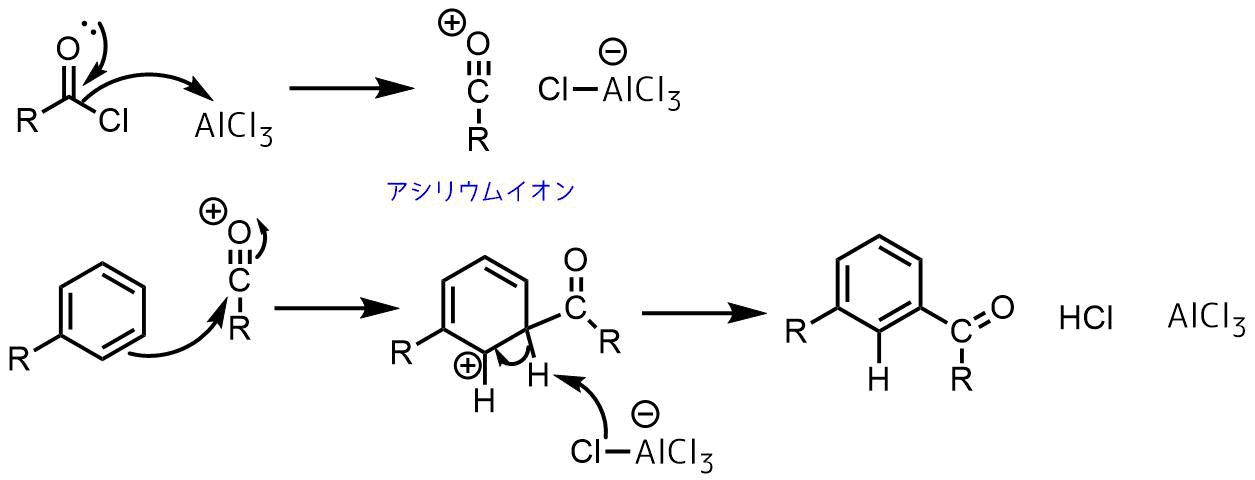
フリーデルクラフツ・アシル化の反応機構
反応条件
一般的な方法
試薬は基本的には等モル使えば良いです。
酸触媒は酸塩化物と同じモル加えます。
基質が液体なら溶媒は使用しなくても構いません。ベンゼンなどが基質の場合は溶媒量加えて反応させてもOKです。
基質、酸塩化物(求電子剤)、溶媒の反応溶液を0℃に冷却し、触媒を数分~数十分かけて少しずつ加えます。0℃~室温で撹拌、反応しにくい場合は加熱して反応させます。反応後は水または飽和炭酸水素ナトリウム溶液を加えてクエンチして抽出、再結晶やカラム精製で目的物を得ます。
酸塩化物を滴下する方法、基質を最後に加える方法(perrier法)などがある。
Perrier法ー収率向上の改良
Perrierらは塩化ベンゾイル(酸塩化物)と塩化アルミニウムを溶媒中(二硫化炭素等)で生成する錯体(PhCOCl・AlCl3)をあらかじめ調製してから、芳香族化合物を加えてフリーデルクラフツ反応を行う方法を報告しています。このPerrier法は特にアルキルベンゼンを原料としたケトン合成に有効であることが分かっています。
Mowry, D.T.,et al, JACS, 68, 1105, 1946
Perrier法はフリーデルクラフツ反応の収率向上に有効ですが、アリールハライドには向いていないようです。またアニソールなどにも向いていません。
不活性芳香環のアシル化
ニトロベンゼンのような電子不足な芳香環はフリーデルクラフツ反応のような求電子置換反応は進行しにくいですが、超酸のトリフルオロメタンスルホン酸を利用すると反応が進行します。
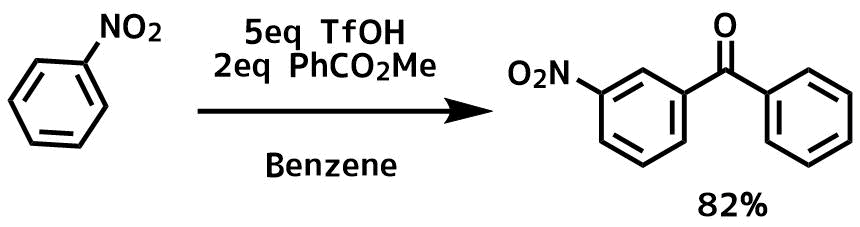
Hwang, J. P. et al Tetrahedron, 56(37), 7199-7203; 2000
また、溶媒フリーで亜鉛とマイクロウェーブを用いた条件においても不活性なニトロベンゼンのアシル化が好収率で得られています。
トリフルオロメタンスルホン酸(SbF5なども)などの超酸中ではジカチオン種という求電子性が非常に高い、反応性の高い中間体が生成することが昔から知られています。ジカチオン種は超酸のような非常に強い酸中で存在可能で、この反応でもエステルのプロトン化によってジカチオン種が生成していると考えられています。どの中間体で反応が進行しているかは不明ですが、いかに表すジカチオン種が反応に関わっていると考えられています。ちなみに安息香酸では反応がほとんど進行しなかったようです。
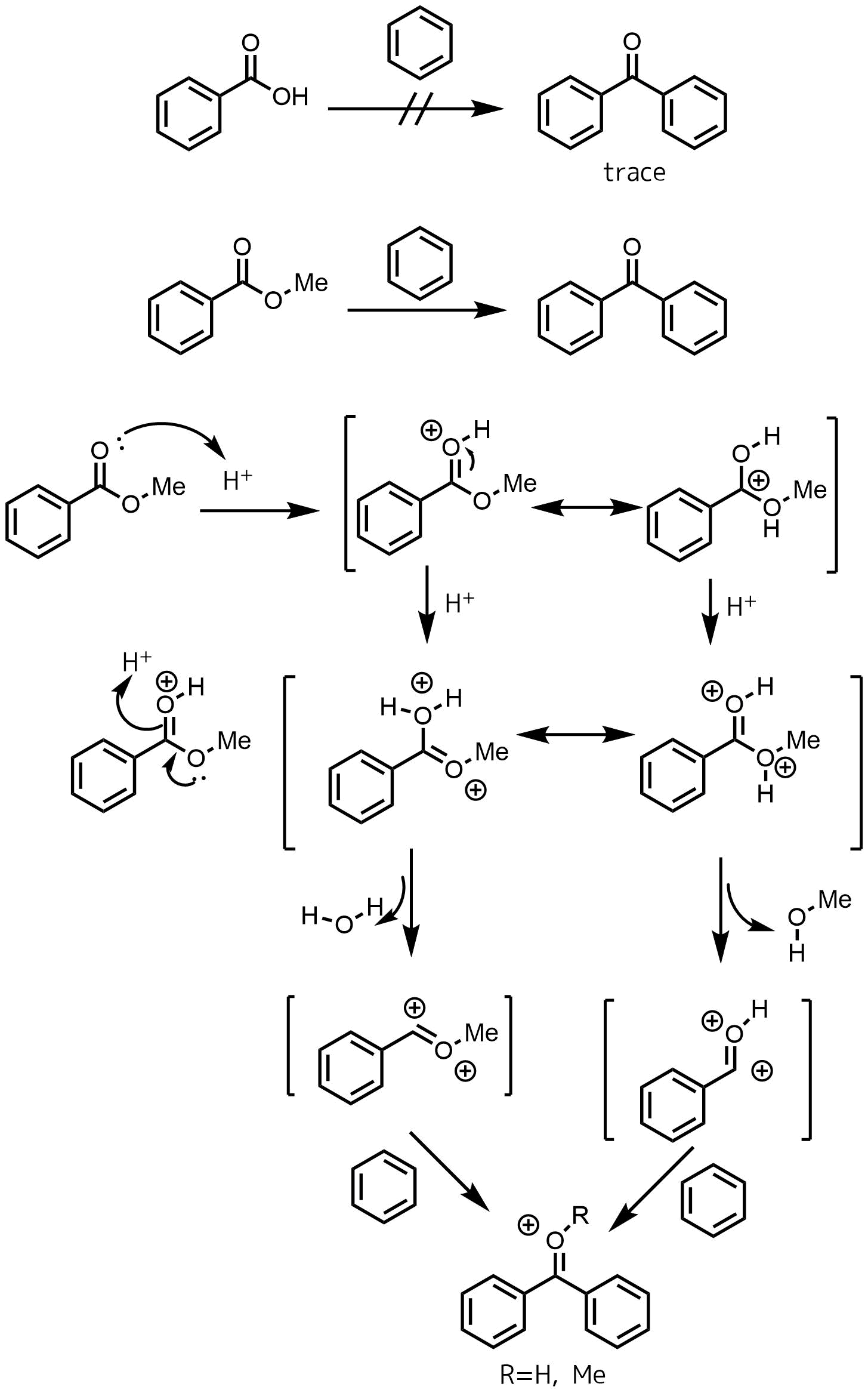
超求電子剤(ジカチオン種)の発生とフリーデルクラフツ反応
Olah, George A. “Superelectrophiles.” Across Conventional Lines: Selected Papers of George A Olah Volume 2. 2003. 815-836.
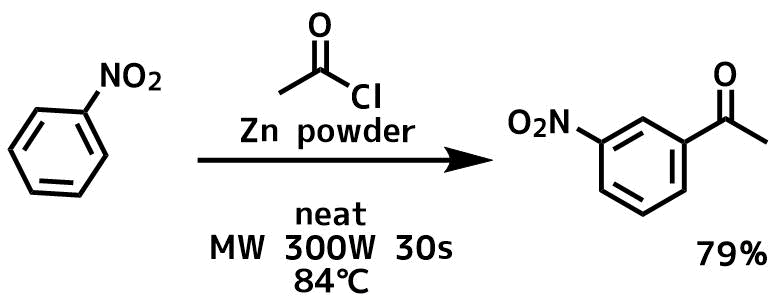
(All reagent 1eq) Paul, Satya et al Synthesis, (18), 2877-2881; 2003
ニトロ基のような不活性基ではm位がアシル化されます。これは芳香族求電子置換反応と同じですね。
位置選択性
フリーデルクラフツ・アシル化反応の置換位置は通常の芳香族求電子置換反応の配向性と類似しています。立体の空いている側に置換されることが多く、パラ位が優性です。
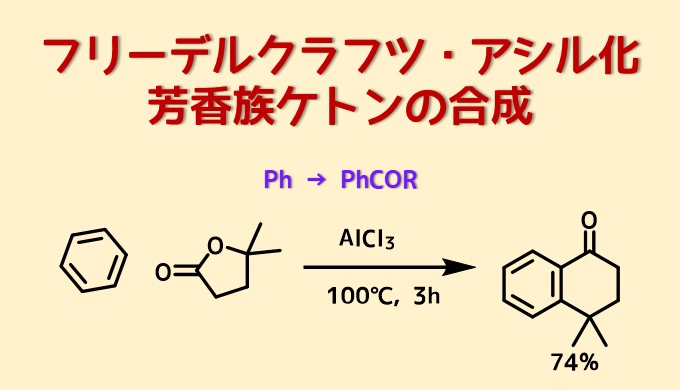
環状ケトンの合成
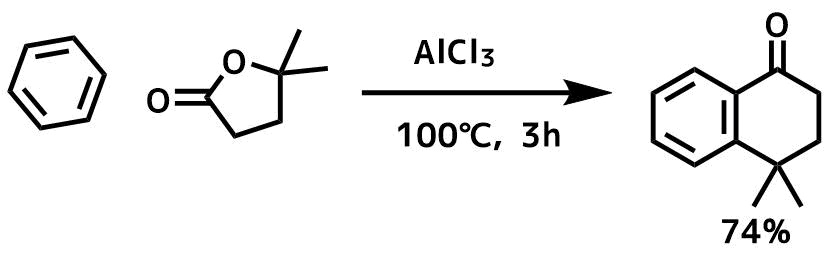
Komagawa, Hiromi et al Synlett, 27(5), 789-793; 2016
ベンゼン(63 mL)中のAlCl3(3当量、35.2 mmol、4.7 g)を溶液を5℃に冷却してラクトン(11.7 mmol)+ベンゼン(21 mL)を45分以上かけて滴下し、混合物をゆっくりと100℃まで温め、その温度で3時間撹拌した。氷冷水と10%HCl水溶液の混合物で反応停止し、Et2Oで抽出し、クルードをカラムで精製して目的物74%で得た。
ラクトンを求電子剤とすることで、カルボニルへのフリーデルクラフツ・アシル化反応に続いて、分子内フリーデルクラフツ・アルキル化が起こって環状ケトンが合成できます。
ラクトンだけでなく、ケトエステルを使えば、二段階のフリーデルクラフツ・アシル化によって環状ケトン合成が可能です。
側鎖末端に酸塩化物、カルボン酸、エステル、ケトンを有するベンゼンを分子内フリーデルクラフツアシル化することで環状ケトンを合成できる。

1,4-ジ-tert-ブチル-2,5-ジメトキシベンゼンの合成もフリーデル-クラフツ反応にあたるらしいのですがこの反応の反応機構を教えてほしいです!!
よろしくお願いします!!
このサイト非常にわかりやすくて助かっています!
ご閲覧いただきありがとうございます。
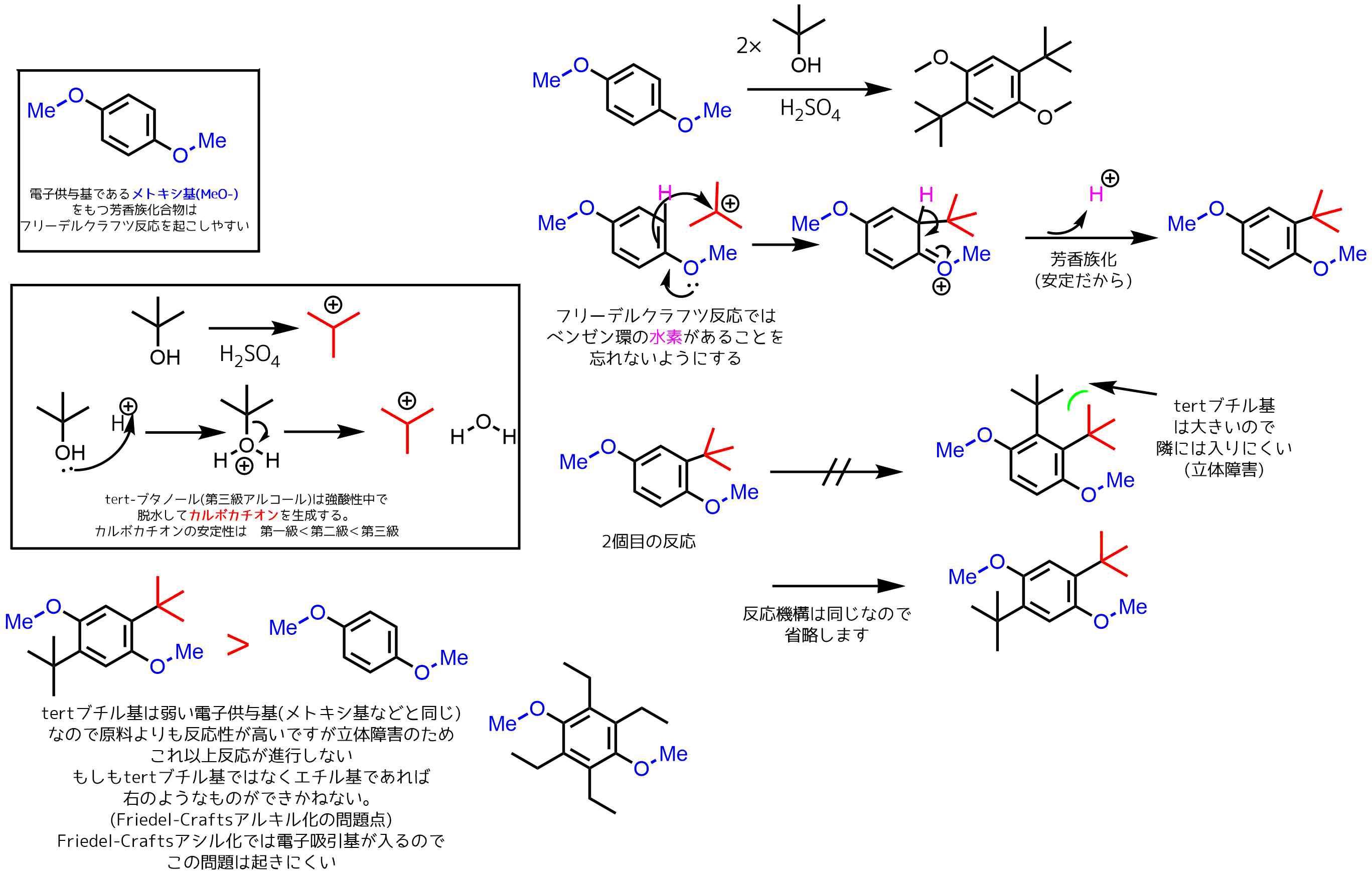
もっとわかりやすくできるように改善していくので今後ともよろしくお願いいたします。
反応の条件がわからなかったので勝手に書きました。
何かご不明な点があればお気軽にご質問ください
1番最後の反応機構が知りたい
無水フタル酸にベンゼン、塩化アルミニウム、水、濃塩酸の順で使ってo-ベンゾイル安息香酸を作る反応がフリーデルクラフツ反応にあたるそうなので、反応機構を教えてほしいです。
よろしくお願いします。
いつも勉強に使わせてもらっていますありがとうございます。
コメントいただきありがとうございます。
>> 無水フタル酸にベンゼン、塩化アルミニウム、水、濃塩酸の順で使ってo-ベンゾイル安息香酸を作る反応がフリーデルクラフツ反応にあたるそうなので、反応機構を教えてほしいです。
フリーデルクラフツ・アシル化の反応機構で記載の画像のアシルのR部分とClを無水フタル酸に置き換えていただければ良いかと思います。
最後の反応とはこちらでしょうか
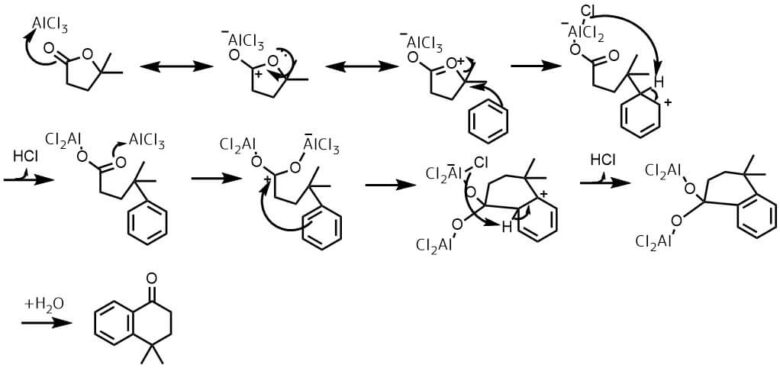
アニソールをアシル化、アルキル化する場合の反応機構を知りたいです。
コメントありがとうございます。
こちらのサイトの情報が参考になるかと思います!
https://homework.study.com/explanation/draw-the-complete-arrow-pushing-mechanisms-for-the-following-reactions-including-all-intermediates-show-resonance-structures-where-appropriate.html