βラクタム系抗生物質のまとめ
βラクタム系は代表的な抗生物質である「ペニシリン」が属するグループです。
βラクタムは特徴的な環状アミド(ラクタム)を含みます。
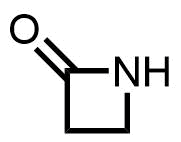
βラクタムの構造
ペニシリンの発見からβラクタムを構造中に含む抗生物質がたくさん発見されています。
βラクタム系を分類すると
- ペニシリン系(ペナム骨格)
- セフェム系
- モノバクタム系
- カルバペネム系
- 非βラクタム系
に分けられます。開発が進むにつれて抗菌スペクトルが広くなる傾向があります。
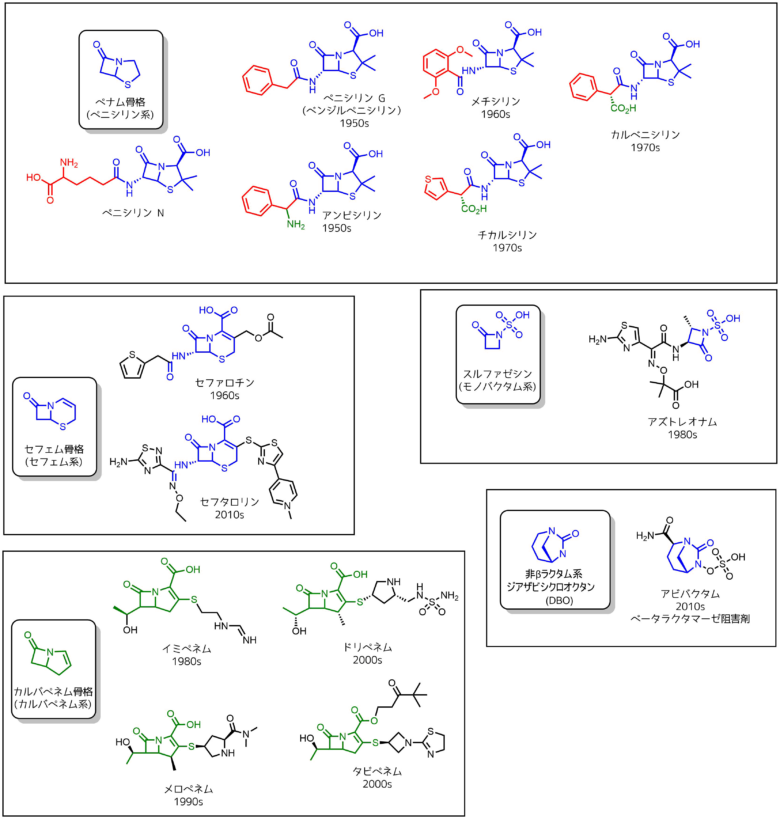
βラクタム系の構造まとめ
βラクタムとは?
ラクタムはアミドと呼ばれるグループに属する化合物です。合成繊維のナイロンや体をつくっているタンパク質などはアミドからできています。特に環状になっているものをラクタムと呼びます。有名なラクタムはナイロンの原料であるイプシロンカプロラクタムやここで紹介している抗生物質のペニシリンの構成要素であるベータラクタムがあります。ギリシア文字が意味するものは炭素の数です。特にカルボニル基C=Oの隣にある炭素をアルファ炭素と呼びそこからベータ、ガンマ…と数えていきます。
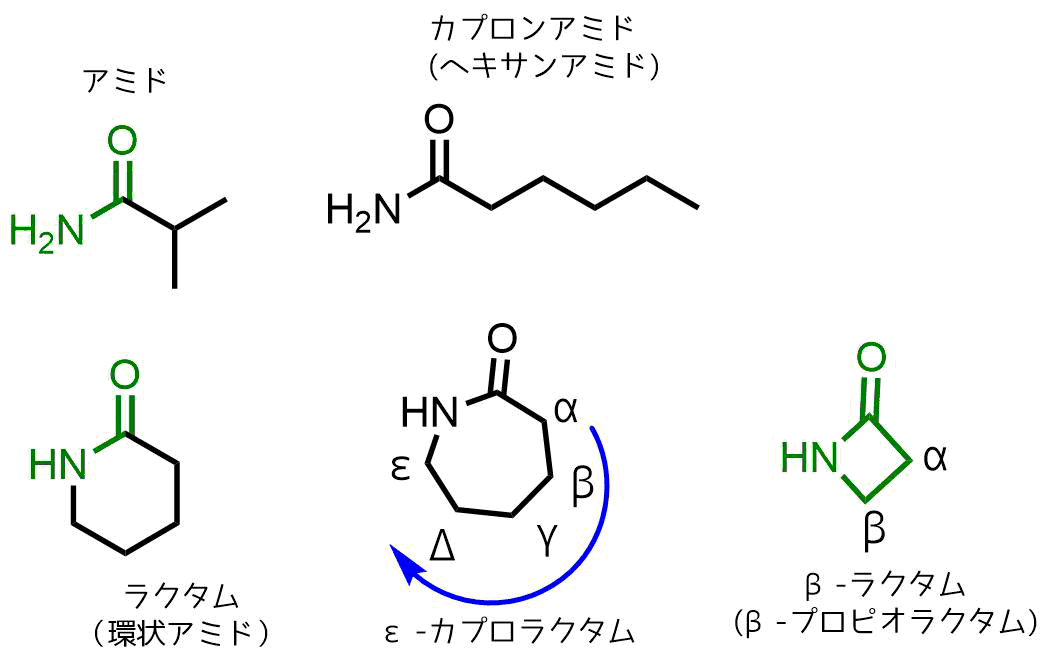
アミドとラクタム
ペニシリン系(ペナム骨格)
βラクタム系はグラム陽性菌に対する効果は高いがグラム陰性菌に対する効果は薄いです。
ペナム骨格はラクタムを持つ2員環化合物です。環の歪でラクタムの反応性が上がっています。
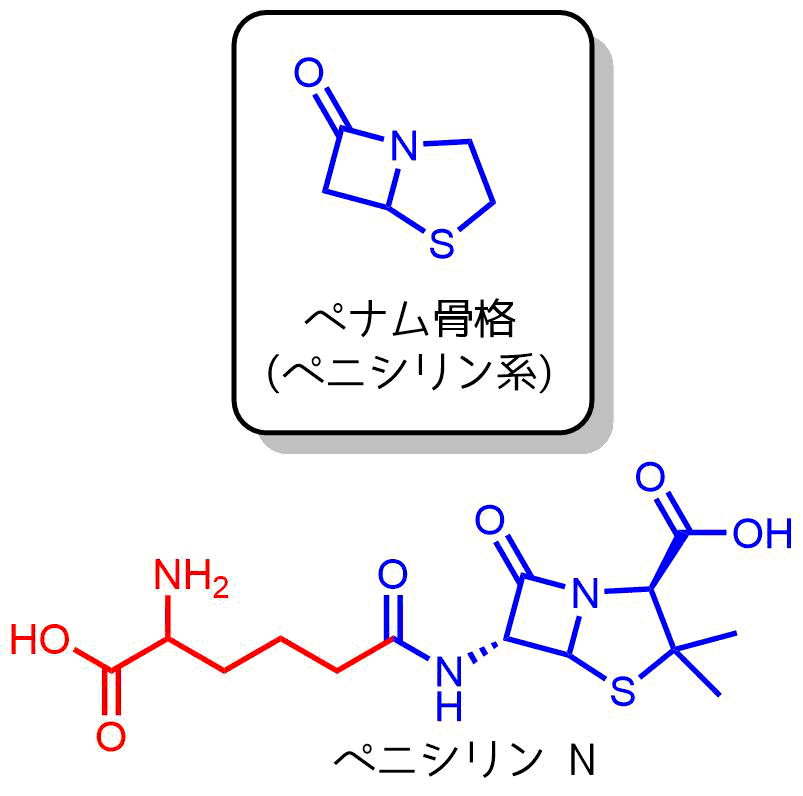
ペナム骨格
- ペニシリン系化合物のバリエーション
ペニシリン系の薬物はペナム骨格についているアミノ基からアミドを介して様々な化合物(図中の赤い部分)を結合させて様々なバリエーションが生まれています。
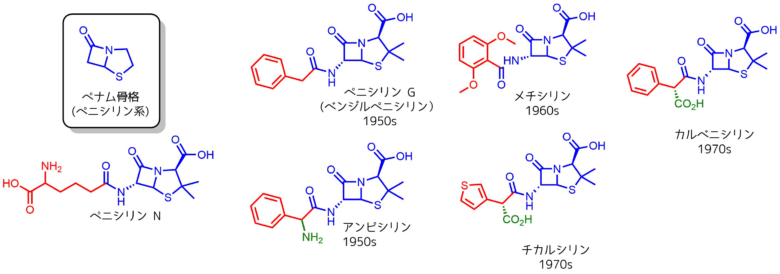
ペニシリン系
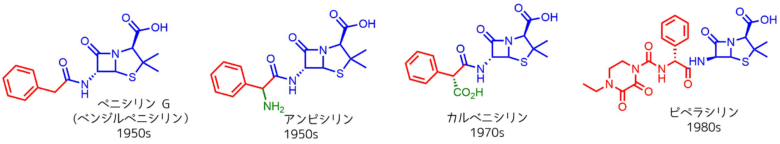
ベンジルペニシリンはベンジルを構造に含むペニシリンです。現在でも利用されており、他のペニシリン誘導体の母核になっています。
アンピシリンはベンジルペニシリンにアミノ基を結合させたもので、グラム陰性菌に対して若干有効です。アミノ基を持つとグラム陰性菌に対する効果が高まることからアミノペニシリンという括りでよばれることもあります。よく利用されているアモキシシリンはアンピシリンのベンゼン(Ph)がフェノール(ph-OH)になったものです。
カルベニシリンはアミノ基の代わりにカルボン酸が結合しており、さらにグラム陰性菌に対する有効性が向上しています。チカルシンはベンゼンの生物学的等価体であるチオフェンが導入されています。(カルベニシリンは消化管から吸収されない)
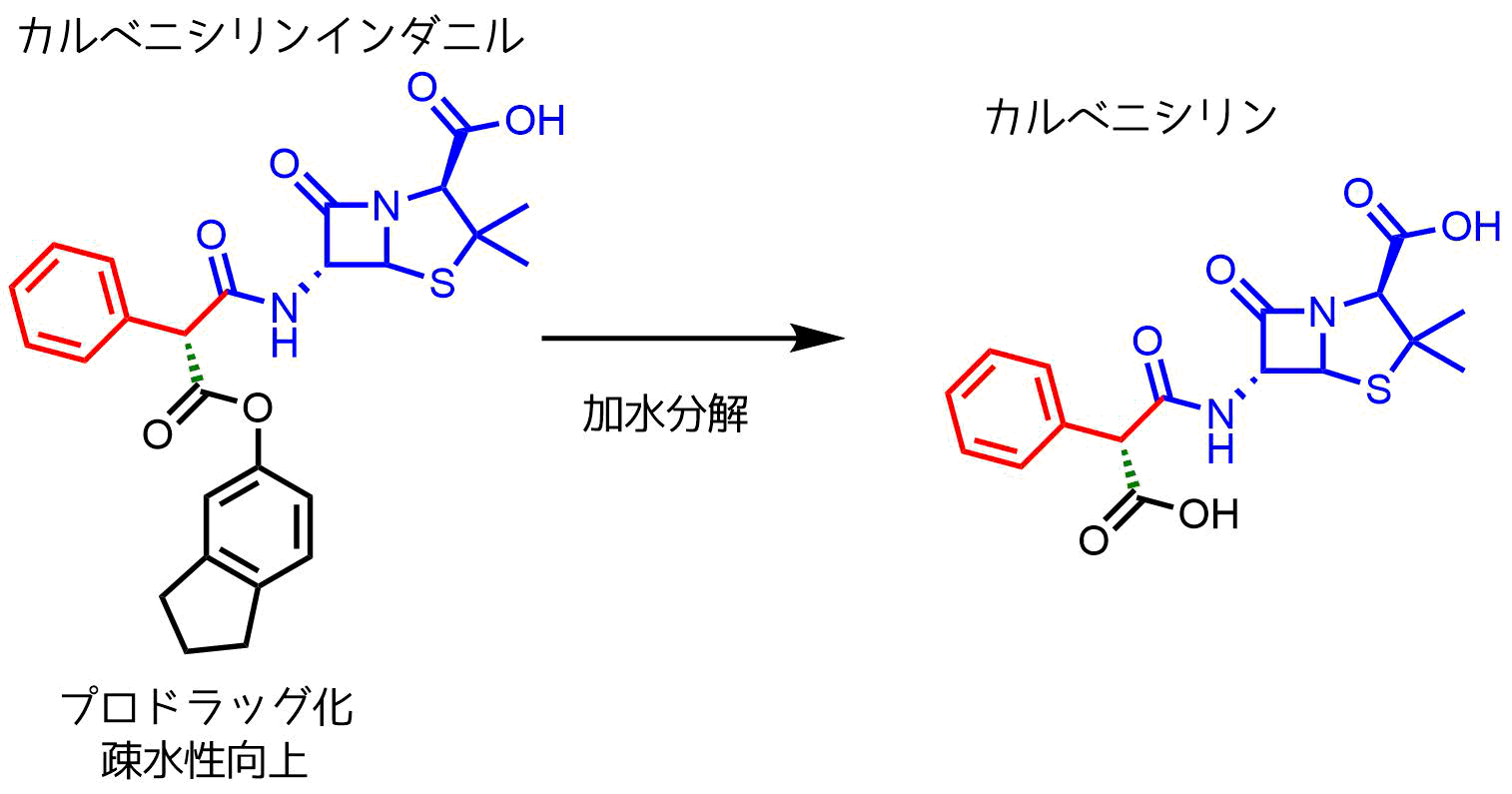
カルベニシリンインダニルはカルベニシリンのカルボン酸をエステル化してプロドラッグ化して吸収性を向上、体内ではカルベニシリンになる
Morán-Díaz, J. R., et al. “Correlation study of antibacterial activity and spectrum of Penicillins through a structure-activity relationship analysis.” Medicinal Chemistry Research 28.9 (2019): 1529-1546.
ピペラシリンはさらに極性の高いウレア構造を導入することによりグラム陰性菌への浸透効果を高められています。これは緑膿菌に有効です。グラム陰性菌に対する効果は高いもののグラム陽性菌に対する効果は低下しています。ペニシリンの中では広い抗菌スペクトルを持っています(広域ペニシリン)。
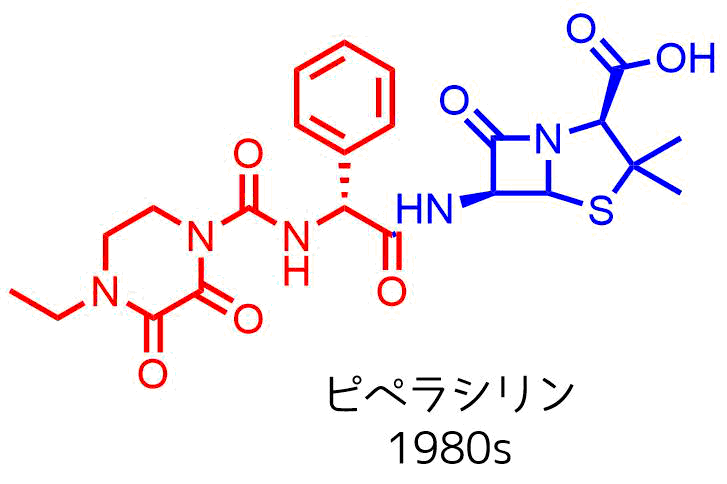
ピペラシリン
セフェム系
セフェム骨格を持つ抗生物質。第四世代まである。構造展開によりβラクタマーゼに対する安定性やグラム陰性菌に対する効果が向上するなど各世代には特徴がある。
カルバペネム系
ペニシリン系の骨格に特徴的な硫黄が炭素に置換されたカルバペネム骨格をもちます。
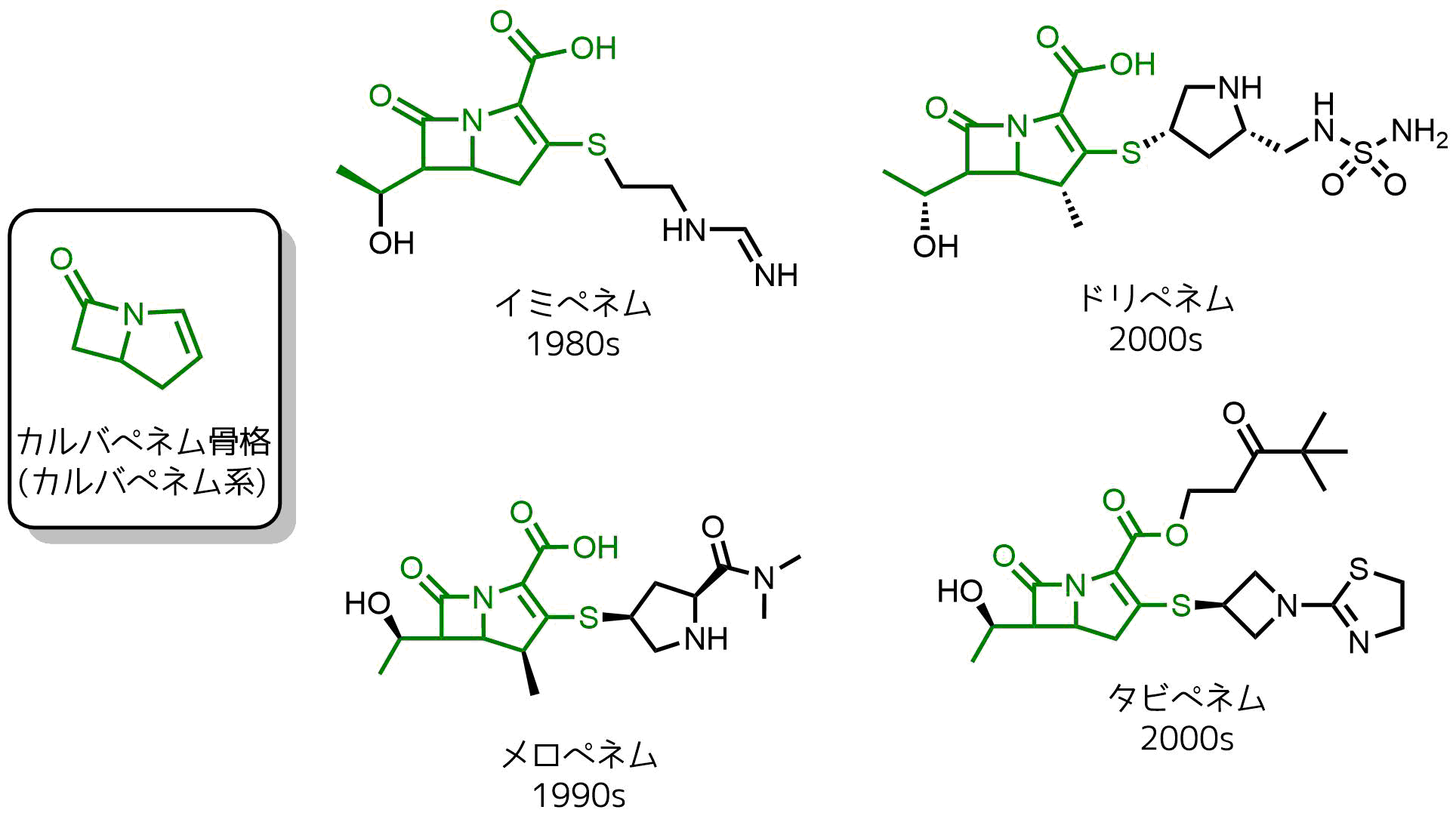
カルバペネム系
βラクタム系抗生物質の中で最も広い抗菌スペクトルを持っており、グラム陰性菌に対する効果が高いです。
カルバペネムはβラクタマーゼに対して比較的耐性があります。
カルバペネム環についている2級アルコールのヒドロキシエチル基は活性に重要であることがわかっています。
他のβラクタム系と比べてカルバペネム系はジメチル基の部分にチオエーテルを介して側鎖構造が導入されています。
カルバペネム系はグラム陰性菌の外膜を透過するのではなく外膜タンパク質(OMP)を介して細胞内に侵入して効果を発揮します。効果の高さから耐性菌が生まれないように慎重に利用されています。
モノバクタム系
作用機序
- ペニシリンは細菌の細胞壁合成を阻害→殺菌
細菌は人間の細胞とは違って細胞壁(cell wall)を持っています。
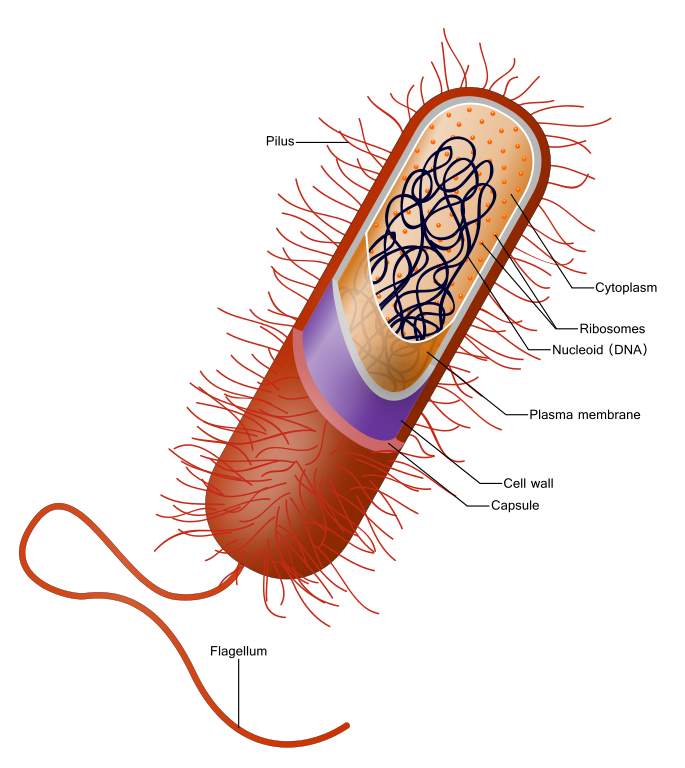
細菌の構造by Ali Zifan CC-4.0 Cell
細胞壁は細菌の成長には不可欠なものです。細胞壁が合成できないと成長や増殖ができないだけでなく、浸透圧に耐えられず細胞が破壊されてしまうため、ペニシリンは殺菌的に働きます。
- ペニシリンは細胞壁合成に関わる酵素トランスペプチダーゼを阻害する
細胞壁の構成成分であるペプチドグリカンの合成には複数の酵素が関わっています。ペプチドグリカン合成の最終段階であるペプチドグリカンの鎖を同士を架橋する酵素であるトランスペプチダーゼはD-Ala-D-Alaの構造を認識して架橋を形成します。
このアラニルアラニンの立体構造がペニシリンに似ているため、アラニルアラニンの代わりにペニシリンがトランスペプチダーゼに直接的に結合して触媒反応を阻害します。
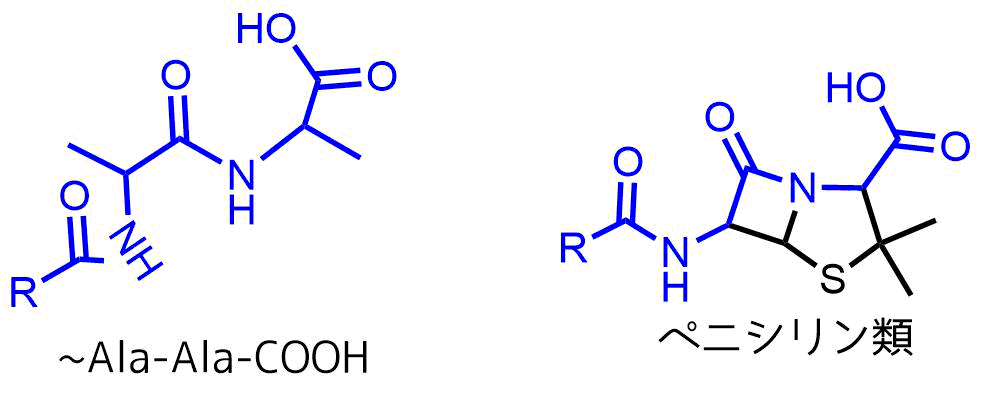
ペニシリンとアラニルアラニンの構造 似ているといえば似ている?
- βラクタム環は酵素と不可逆的に結合(くっついたら離れない)
さらにペニシリン系抗生物質の特徴的なβラクタム構造は4員環由来のひずみのために環が不安定で反応性が高いです。そのため酵素活性中心にあるセリンと反応性してラクタムが開環して共有結合を形成します。これによりペニシリンは酵素から離れなくなり、酵素の活性は失われます。
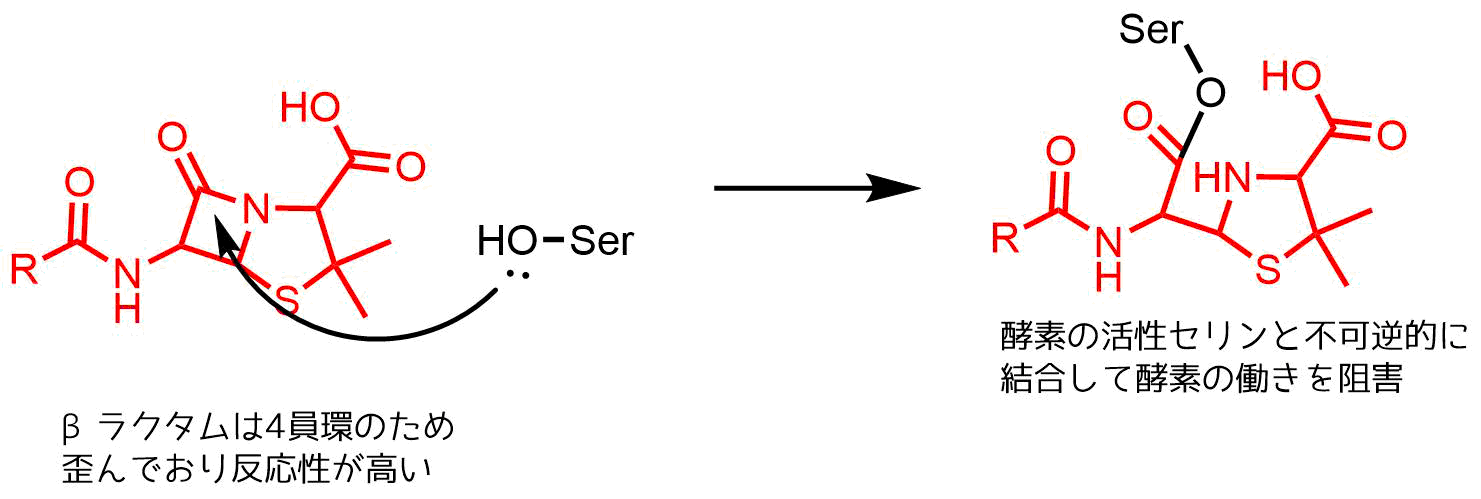
ペニシリンの作用機序 トランスぺプチダーゼの活性中心にあるセリンはひずみにより反応性が上がっているβラクタムと反応して不可逆的な結合を形成する。
βラクタマーゼによる分解
- 耐性菌が分泌する酵素・βラクタマーゼはペニシリンのラクタムを分解する
βラクタムが酵素と反応する前に別のものと反応させてしまえば抗生物質としての効果が発揮されなくなります。細菌の中にはβラクタマーゼといってβラクタムと反応して開環させる酵素を持つものがいます。これがβラクタム系に対する耐性を持った細菌です。βラクタマーゼは同じような機構でβラクタムの開環を起こさせて加水分解することにより、抗生物質としての活性をなくします。
- 細菌が分泌するβラクタマーゼをさらに阻害する薬
細菌が生産するβラクタマーゼがあると薬が効きにくくなるので、今度はβラクタマーゼを阻害する薬を抗生物質と一緒に投与すれば効き目が良くなると考えました。それがβラクタマーゼ阻害剤です。クラブラン酸は代表的なβラクタマーゼ阻害剤でペニシリンと同じくβラクタムを持ちます。クラブラン酸は抗菌作用は低いですが、βラクタマーゼによる抗生物質の分解を抑えるので効き目がよくなります。クラブラン酸カリウムとアモキシシリンの合剤であるオーグメンチンが有名です。
メチシリンは側鎖構造にジメトキシベンゼンを含み、βラクタム立体的に保護して酵素分解を阻害します。
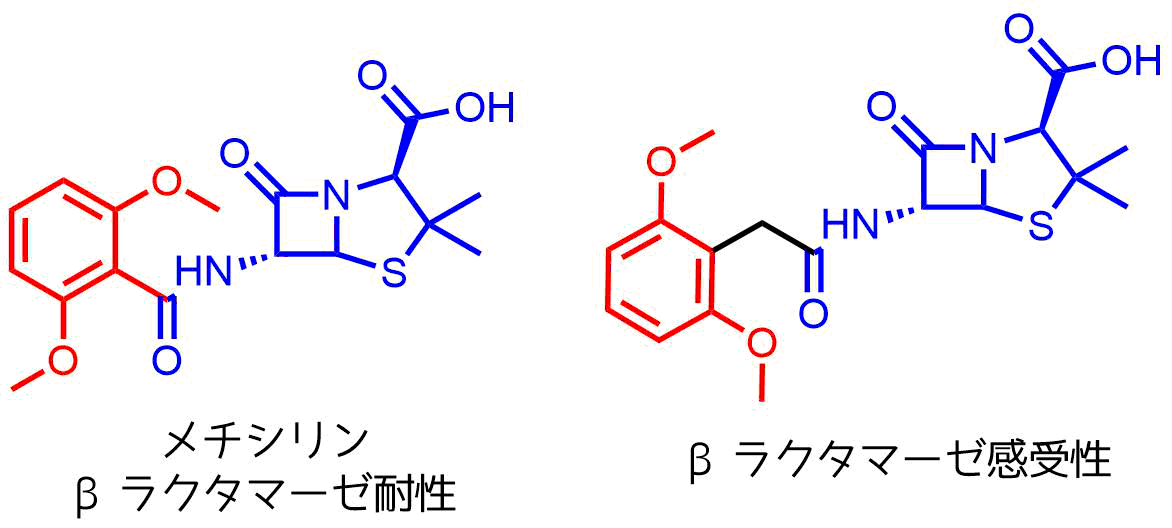
メチシリンの2つのメトキシ基は酵素がβラクタムに接近するのを阻害し、βラクタマーゼから立体的に保護する効果がある
グラム陰性菌とグラム陽性菌
細菌にはグラム陽性菌とグラム陰性菌という分類があります。これらは細胞壁の構造とその構成成分の違いによるものです。詳しくは下記リンクを参照してください
一般的にペニシリンがグラム陰性菌に対して効果が薄い理由
グラム陽性菌はペプチドグリカンという成分からなる厚くて硬い細胞壁をもちます。
このペプチドグリカン層は厚いですが、比較的多孔質(小さな穴が多い)なため、低分子化合物のペニシリンはこの膜に浸透します。なのでグラム陽性菌は低分子なペニシリンに対して感受性が高いです。
一方で、グラム陰性菌は細胞壁が薄いですが、リン脂質やリポタンパク質からなる外膜と呼ばれる膜がありこれが分子の侵入を防ぐ障壁になっています。外膜を通過するにはポーリンと呼ばれるチャネルタンパク質がありそれを介して細菌の内部に栄養素を運んでいます。このポーリンを通過できる物質は低分子で親水性の高い物質になります。
したがって、ペニシリンの化合物中に親水基を導入するとグラム陰性菌に対する効果が向上するはずです。
親水基を導入したペニシリンたち
これは予測通りで、ベンジルペニシリンに対してアミノ基、カルボキシル基、ウレアなどを導入したペニシリンは親水性があがり、グラム陰性菌に対する有効性があがっています。
参考
- Lima, Lidia Moreira, et al. “β-lactam antibiotics: An overview from a medicinal chemistry perspective.” European Journal of Medicinal Chemistry (2020): 112829.
- 宮寺哲男. “ペネム化合物の合成と抗菌活性.” 有機合成化学協会誌 41.12 (1983): 1168-1180.
- Rolinson, George N. “Forty years of beta-lactam research.” The Journal of antimicrobial chemotherapy 41.6 (1998): 589-603.
- Demain, Arnold L., and Richard P. Elander. “The β-lactam antibiotics: past, present, and future.” Antonie Van Leeuwenhoek 75.1 (1999): 5-19.