カルボン酸を作る合成方法としては「アルコールの酸化」と「エステルの加水分解」が良く利用されます。
エステルはアルコールとカルボン酸が脱水縮合してできた物質なので、逆に水を加えて分解するとアルコールとカルボン酸になります。
エステルの加水分解はよく使う反応であり、化学の基本反応でテストにもよく出てくるのでおさえましょう。
エステルの加水分解の反応機構をわかりやすく図解
エステルは水と酸または塩基条件で加水分解してカルボン酸とアルコールが生成します。
この機構はエステルを合成する「フィッシャーエステル化反応」の逆の道をたどります。
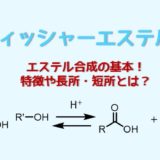
加水分解は基本的には可逆的な反応です。
しかし、「塩基加水分解」では生成したカルボン酸が塩基よって中和されて、より不活性なカルボン酸塩になるため、ほとんど不可逆的です。
そのため、合成では「塩基加水分解」を利用することが多いです。
エステルの加水分解を進行させるためには、水を多く加えるなどして反応の平衡をカルボン酸側に偏らせる必要があります。
酸加水分解の反応機構
酸加水分解は触媒として酸を利用します。
エステルの酸加水分解は以下の経路をたどって進行します。
- 電子豊富なカルボニル酸素がプロトン化される
- プロトン化により求電子性(+)が上がったカルボニル炭素に対して水が攻撃する
- 生成した四面体中間体のアルコール酸素がプロトン化されて脱離能が上がる
- 酸素の電子の押し出しによりアルコールが解離する
- 脱プロトン化
- カルボン酸とアルコールが加水分解により生成
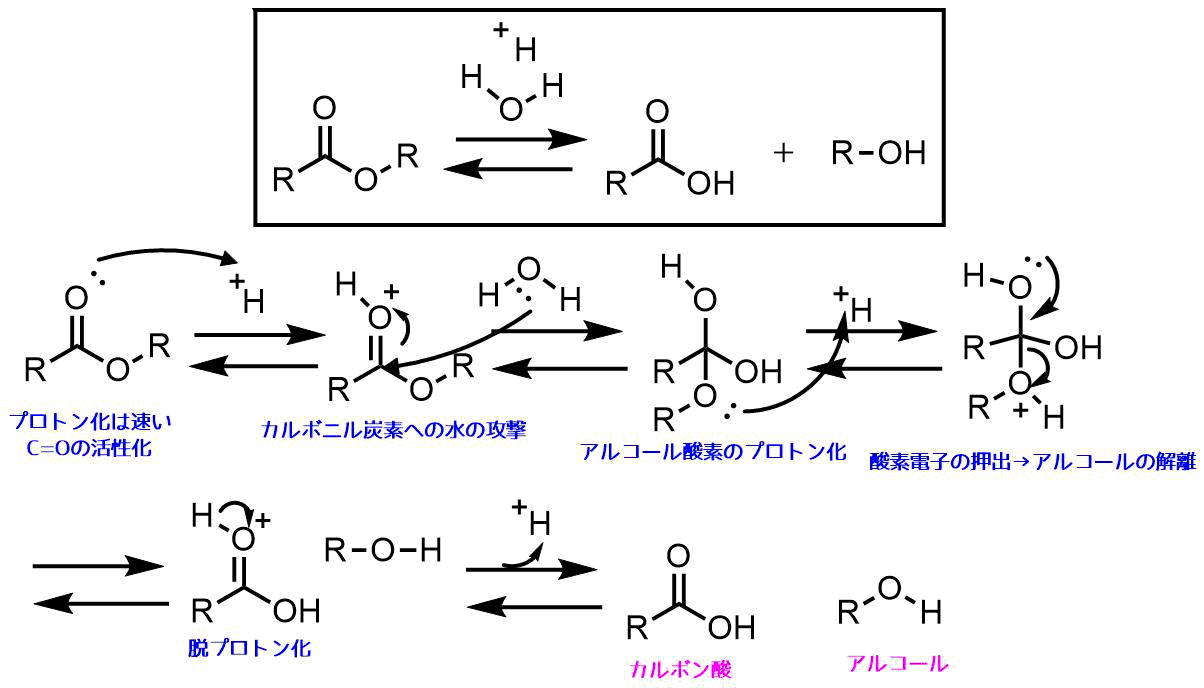
エステルの加水分解機構
酸によるエステルの加水分解は電子不足なプロトン(H+)が電子豊富な酸素に結合することが引き金になっています。
プロトンは小さいので素早く付いたり外れたりします。反応はプロトン化や分子内の電子移動が速く、分子間の反応は遅いです。
酸触媒による機構では生成したアルコールが機構2番目の水が攻撃する代わりに、アルコールが攻撃するとまたエステルができます。つまりエステル化と加水分解が同時に起こっているのです(平衡反応)。
アルカリ加水分解反応機構
塩基として水酸化ナトリウムを加えた条件での反応機構は以下のようになっています。
- 電子豊富で求核性の高い水酸化物イオンが電子不足のカルボニル炭素に対して攻撃する
- 生じた四面体中間体の酸素原子からのアニオンの押出しでアルコキシドが脱離する
- 塩基性の高いアルコキシドはカルボン酸のプロトンを奪ってアルコールとカルボン酸塩が生成する
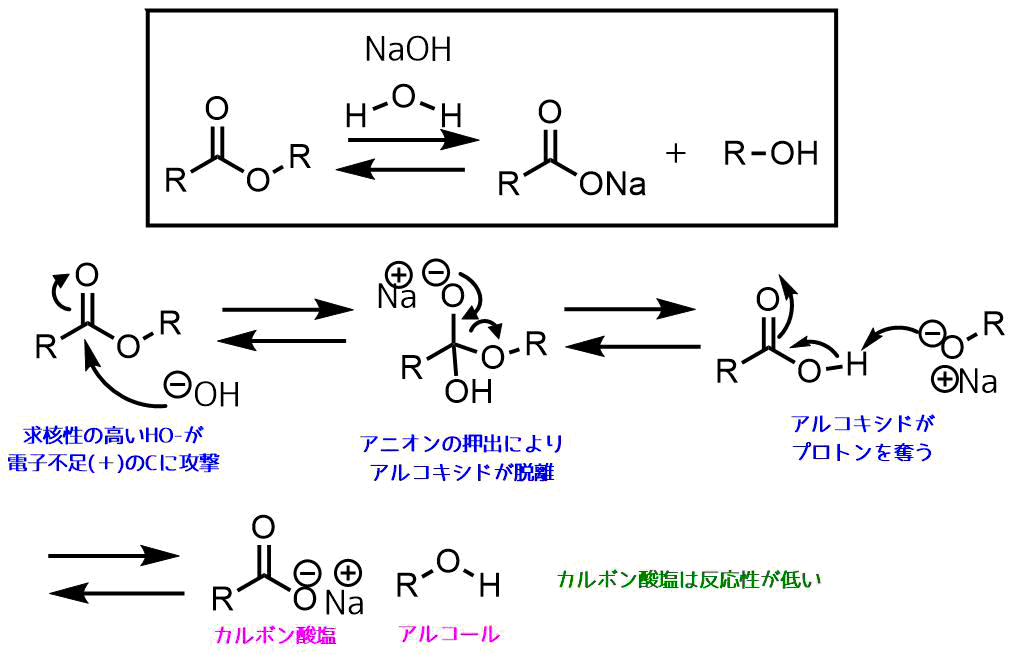
エステルのアルカリ加水分解機構
アルカリ加水分解では反応性の低い(共鳴安定化した)カルボン酸塩が生じるため、実質的に不可逆的反応となる。
そのため、エステルの加水分解はカルボン酸を得る目的ではより効率の良い「塩基条件」で実施します。
エステルの加水分解はどの条件が良い?
基本的にはほぼ不可逆的な塩基性条件!
塩基に不安定な基質の場合は酸性条件
酸にも塩基にも不安定なら後述する中性条件!
エステル加水分解の各条件の特徴と条件
エステルの加水分解は通常簡単に進行しますが、立体障害などの影響によって厳しい条件が必要な場合もあります。環状エステルのラクトンも加水分解が難しい場合も多いです。
特に合成経路の最後のほうでは様々な官能基が存在するため、これらの官能基が損なわれる恐れがあります。したがって、状況によって適切な条件を選択する必要があります。
エステルの加水分解条件には
- 塩基性
- 酸性
- 中性
の3条件があります。塩基性の条件が最も効率的な方法ですが、原料の官能基によっては塩基性では分解などの副反応が起こることがあるので、酸性条件やもっと温和な中性条件で加水分解することもあります。
酸性条件で加水分解
酸性条件の加水分解は反応機構から明らかな通り、カルボニル基の酸素がプロトン化されることによってカルボニル炭素の求電子性が上がって加水分解が促進されます。
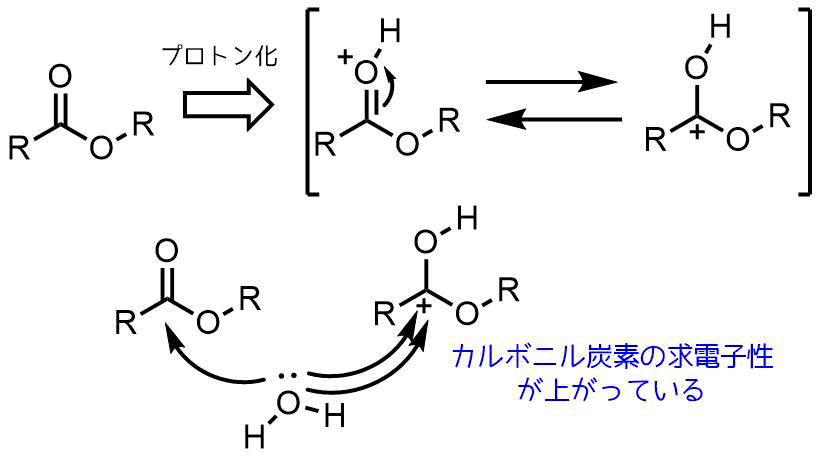
酸性条件でのカルボニル炭素の求電子性増加
酸加水分解においてはエステルの置換基による電子効果は受けにくいですが、立体の効果は受ける特徴があります。
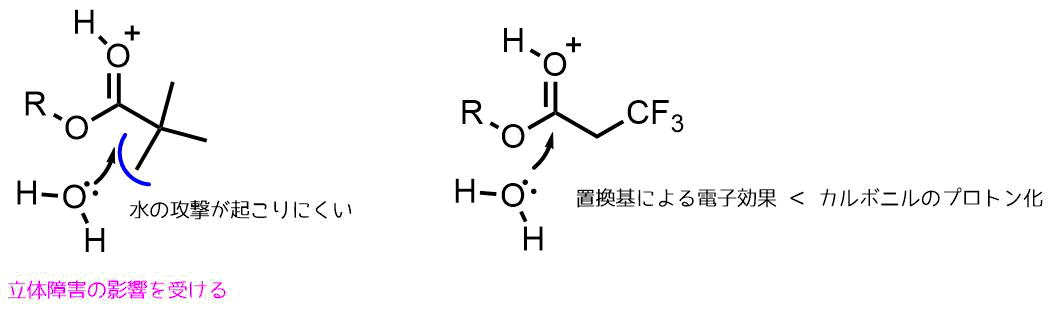
酸加水分解条件における置換基効果と立体効果
酸性条件で加水分解したほうが良いときはどんな時_
ハロゲン化アルキルなど求電子的な構造を持つ化合物では副反応が起こる可能性があるため、酸性条件で加水分解を実施します。このような脱離基がカルボニルのβ位にある場合は脱離反応が進行して不飽和エステル-カルボン酸が生成することがあります。また、α-, β-ケトエステルも塩基条件で不安定なので酸加水分解を使います。
塩基性に弱い官能塩基性に弱い官能基
またそれとは逆に酸性加水分解に適したエステルもあります。
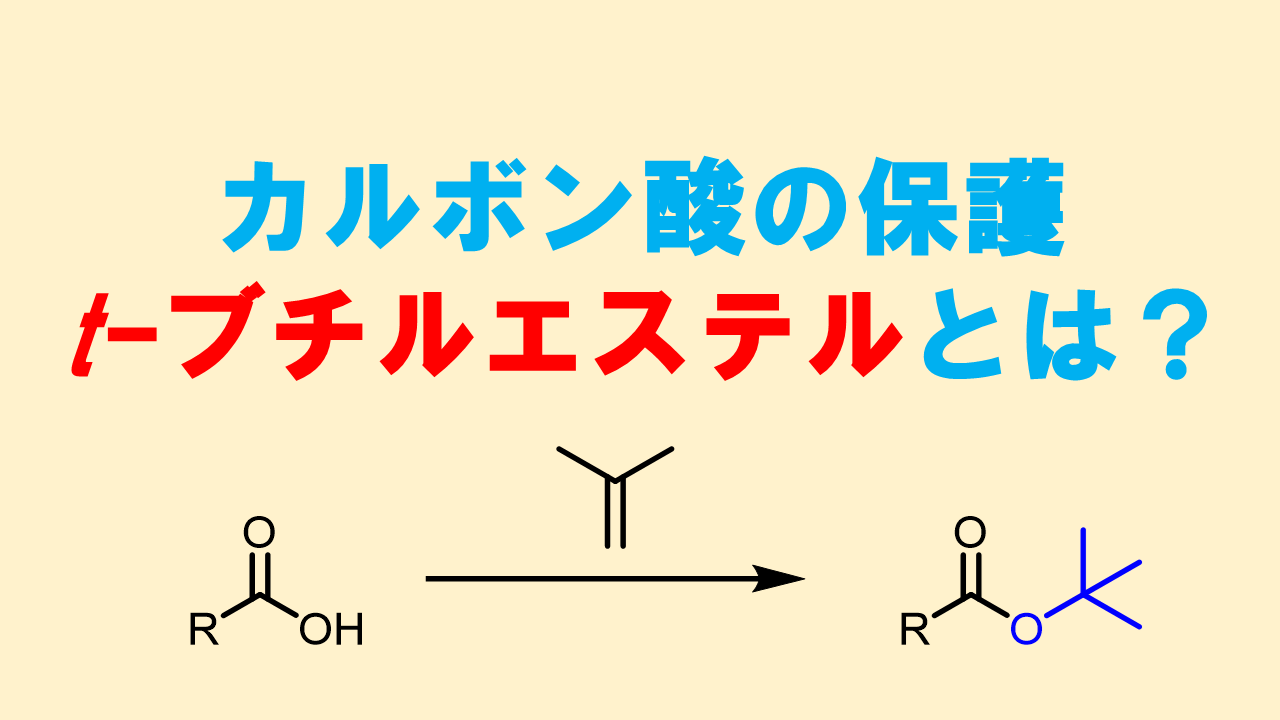
その代表例は「tert-ブチルエステル」です。
酸性条件では「カチオン種」が生成しやすい条件になっており、tertブチル基のような第三級アルキルは安定なカルボカチオンを生成してカルボン酸ができます。カルボカチオンは水と反応してtert-ブチルアルコールになります。
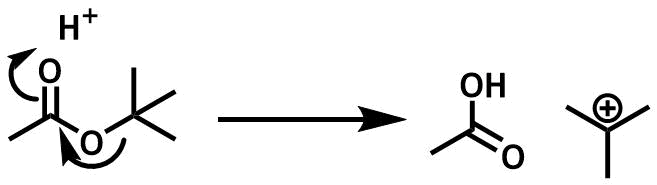
酸性に弱いエステル
反応条件
酸触媒としては硫酸や塩酸が一般的ですが、p-TSAやルイス酸(BF3、BCl3)や酢酸・ギ酸、トリフルオロ酢酸なども使えます。
ギ酸やトリフルオロ酢酸は酢酸と比べて酸性度が高く、沸点も低いので反応後の処理がしやすいです。特に生成したカルボン酸の水溶性が高い場合は、酢酸の分液による除去は難しいです。また、酢酸の沸点(118℃)が高く蒸留による除去も面倒です。
BF3などのルイス酸も効率が高く、立体障害の大きいエステルの加水分解にも有効です。
塩基加水分解
塩基加水分解はエステルの加水分解の基本です。
別の言い方をすると「けん化」とも呼ばれます。石鹸は脂肪酸エステルを塩基で加水分解してカルボン酸塩とすることで合成します。
酸条件とは違ってエステル側の反応性が上がるのではなく、塩基条件では水がイオンになることで水の反応性が上がっています。
その影響もあり、置換基による電子効果を受けて加水分解が促進されます。もちろん立体障害の影響も受けます。
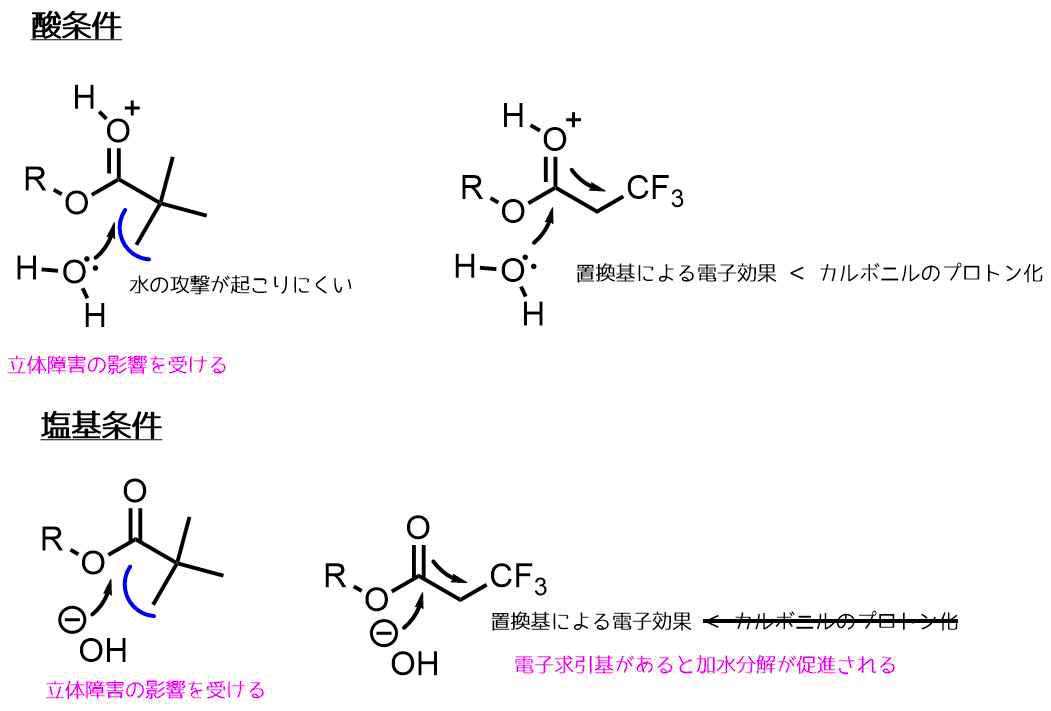
アルカリ加水分解条件における置換基効果と立体効果
反応条件
エステルの加水分解に使われる塩基は
- NaOH、KOH
- Na2CO3, K2CO3
- TEA, Imidazole, DBU
などが良く使われます。
塩基の量は過剰量で進行しますが、あまり塩基を過剰に加えたくない場合は基質1.5eq~3.0 eq加えます。
水溶性のエステルでなければ、アルコール溶液などを使います。
非プロトン性極性溶媒のDMSOはアニオンを溶媒和しにくいため塩基の反応性が向上します。加水分解が難しいエステル・ラクトンの場合はDMSOを共溶媒とすると良い結果が得られるかもしれません。特に塩基性の高いt-BuOKとDMSOの組み合わせは強力です。
塩基の反応性を上げるという観点では、クラウンエーテルも有用です。
18-クラウン-6はカリウムイオンを補足するため、水酸化カリウムや炭酸カリウムと共に用いることによって塩基の反応性を上げることができます。実際にクラウンエーテルを用いることによって立体障害の大きいメシチレンカルボン酸エステルなども加水分解できます。
 18-crown-6の構造 | 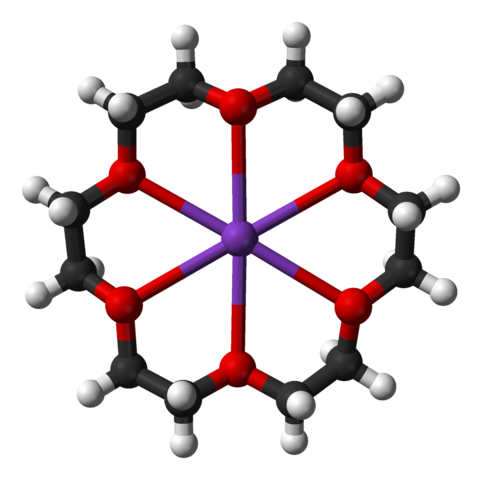 18-crown-6+カリウムイオンの構造:中央の紫はカリウムイオン |
反応例1
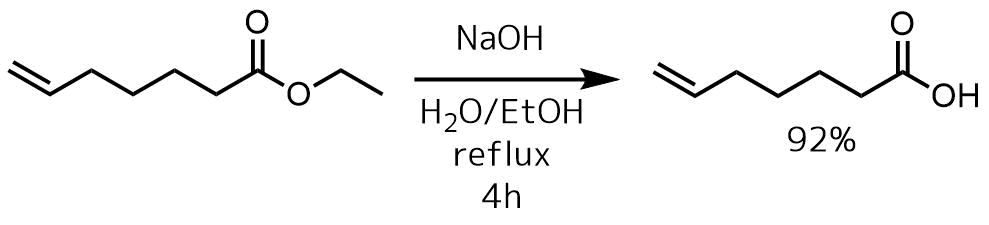
塩基エステルの加水分解例1 Sun, Lijun et al patent 2013013240, 24 Jan 2013
エステル(3g、19.2 mmol)のEtOH(100mL)中の撹拌溶液に、1N NaOH(7.6g、192.3mmol)を添加し、4時間還流した。濃縮、クルードを1N HClでpH5にして、ジクロロメタンで抽出、濃縮により目的物92%で得る。
最もスタンダードなアルカリ加水分解です。室温で進行することもありますが、還流しないと反応が進行しない場合もあります。
反応例2 LiOH, 共役エステル
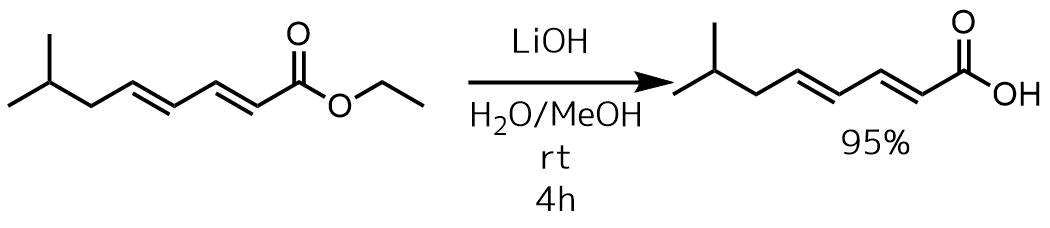
Madala, Nagaraju et al Tetrahedron Letters, 59(27), 2708-2710; 2018
LiOH・H2O (0.92 g, 21.96 mmol) をエステル(1.0 g, 5.49 mmol) MeOH/H2O (50 mL, 1:3)溶液に室温で加えて4時間攪拌した。塩酸で酸性にした後、抽出、目的物を95%の収率で得た。
水酸化リチウムは共役エステルの加水分解でよく利用されています。室温で進行することも多いですが、還流する必要がある場合もあります。
反応例3 高立体障害のエステル tBuOK

Liu, Yun-Ting et al Angewandte Chemie, International Edition, 56(41), 12708-12711; 2017
t-BuOK (2.24 g, 20 mmol) をエステル (696 mg, 2.0 mmol) in 20 mL of DMSOの溶液に加えて、反応溶液を95℃で5時間攪拌させた。反応後塩酸で酸性にして抽出、目的物を92%の収率で得た。
立体障害の大きいエステルの塩基性条件の加水分解ではtBuOK/DMSOの条件が便利です。かなり立体的に混んでいても加水分解が可能です。
他にも水を加えずにMeOH/DCM=1:9(0.3N NaOH in MeOH)のように溶媒を変えると効率的にけん化が進行することが報告されています。
Theodorou, Vassiliki, et al. “Mild alkaline hydrolysis of hindered esters in non-aqueous solution.” Organic Chemistry part vii (2018): 308-319.
中性加水分解
中性条件でのエステルの加水分解法としてよく利用されているのが、ヨウ化リチウム/ピリジンなどの方法です。
また、チオールを用いた方法もあります。チオールは反応性があるので、副反応を抑えるには上記の方法のほうが有利かもしれません。
反応例1 LiBrによるエステルの分解
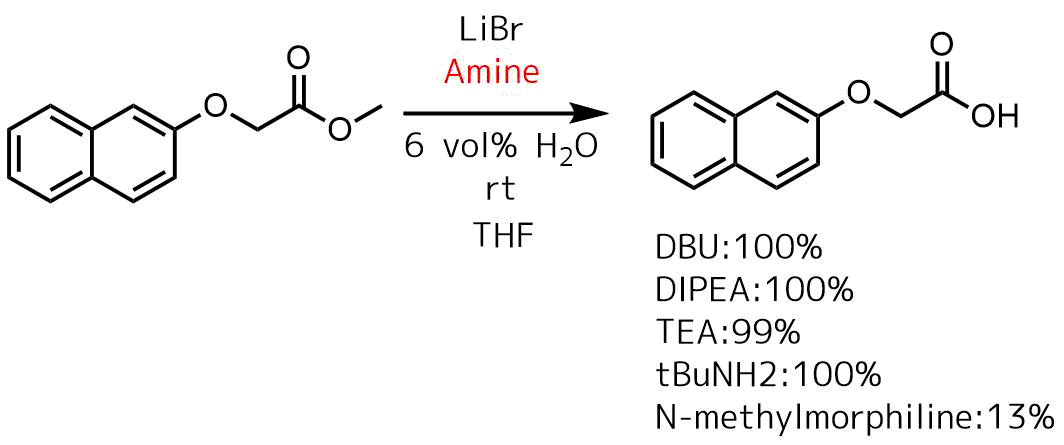
Mattsson, Sara, et al “A mild hydrolysis of esters mediated by lithium salts.” Tetrahedron letters 48.14 (2007): 2497-2499.
リチウムのハロゲン化物塩の中ではLiBrが最もエステル加水分解の効率が高かったです(LiIは検討されていない)。さらに溶媒はTHFとMeCNが良く、MeOH、DMF、DMSOはあまり収率が良くないです。
アミンは塩基性が高いほど効率が良いようです。水は少ないほうが良く、2vol%が最も収率が良かったです。
エステル(通常0.5〜1 g)を2 vol%の水を含むCH3CN(10 ml / gエステル)に溶解し、トリエチルアミン(3当量)を加えた後、LiBr(10当量)を加えた。混合物を室温で激しく撹拌する。反応時間は基質によって大きく異なり、場合によっては還流します。
LiIによる加水分解
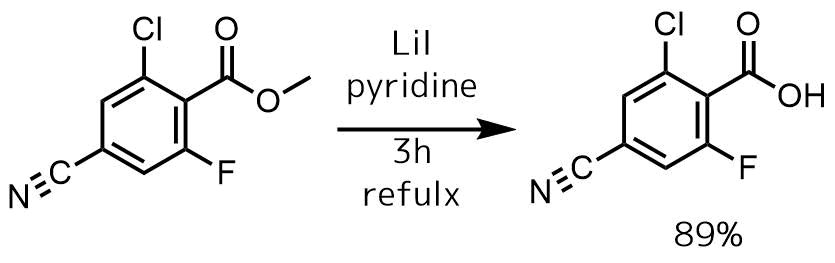
Liang, Jun et al Journal of Medicinal Chemistry, 56(11), 4521-4536; 2013
ピリジン(50 mL)中のエステル(1.953 g、9.143 mmol)の溶液に、ヨウ化リチウム(2.45 g、18.3 mmol)を加えて115℃で3時間加熱した。溶媒を減圧下で除去し、残った残渣をトルエンと2回共沸させ、続いてEtOAcで固体を懸濁させてろ過、固体を水に溶解し、1 N HClでpH 4.0に酸性化し、EtOAc(3 x 30 mL)で抽出操作後、カラムクロマトグラフィーにより精製して89%で得た。
ニトリルは塩基により加水分解される恐れがあるので、中性条件のLiIで加水分解しています。ピリジンまたはコリジンが良く利用されますが、留去が容易なピリジンがファーストチョイスだと思います。水は加えなくても進行します。
TMSIを使ったエステルの分解
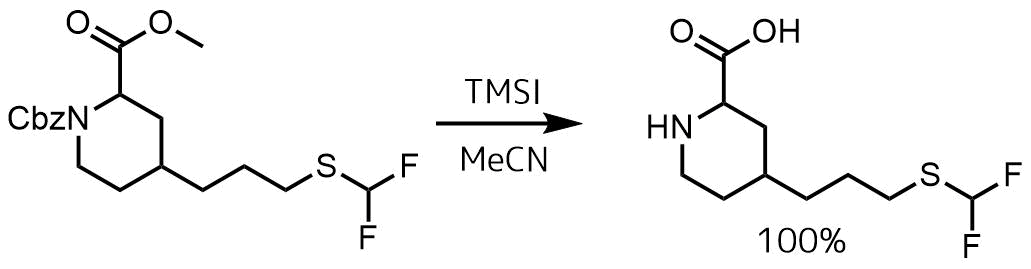
Lewis, Jason G. et al US. 20050215488, 29 Sep 2005
23℃のアセトニトリル(100 mL)エステル(750 mg、1.94 mmol、1当量)の溶液に、TMSI(0.8 mL、5.81 mmol、3当量)を加え、反応混合物を30分間撹拌した。反応混合物を濃縮して、脱保護された粗生成物(491 mg、1.94 mmol、100%)を得た。
TMSIはエステルを中性でカルボン酸に変換できる試薬です。カルバメートも分解されます。
TMSIによるエステルの変換はトリメチルシリルエステルを経由し、これが水により加水分解されることでカルボン酸になるようです。



最近仕事でエステル結合に触れており、大変参考になりました。
教えていただきたいのですが、エステルを塩基存在下で「加水分解させたくない」場合、どのようにすればよさそうでしょうか。
材料は決まっており、イソフタル酸とテレフタル酸です(アルコールは記載できませんが立体障害などはあまり考えなくていいかな、という構造をしています)。
水酸化物イオンより早くなにかがアタックすれば、、、とかでしょうか。
的外れであればすみません。
よろしくお願いいたします。
ご覧いただきありがとうございます。
具体的な条件が不明ですが、フタル酸とアルコールからなるエステルを水存在下で塩基性条件に置いた場合にエステルの加水分解を防ぐ方法という意味で回答します。
1. 水分を除去する
水を意図的に加えていない場合は水を系中から除去する方法が考えられます。
2. 酸性条件にする
エステル以外の官能基を加水分解するために塩基性条件にしている場合は、酸性条件に変更することで多少改善する可能性があります。
3. 温度を下げる
低温条件にすることで、エステルの加水分解量を低減できる可能性があります。
4. 溶媒を変更する
溶媒を変更することで低減できる可能性があります。例えば非極性溶媒のトルエンやジクロロメタンなどがあります。
5. 触媒を変更する
例えばアルカリ水酸化物系の塩基(NaOH, LiOH)などを利用している場合はより、立体障害の高い塩基に変更することで加水分解を防ぐことができます。
基本的に塩基加水分解条件でエステルの加水分解を防ぐのは難しいです。