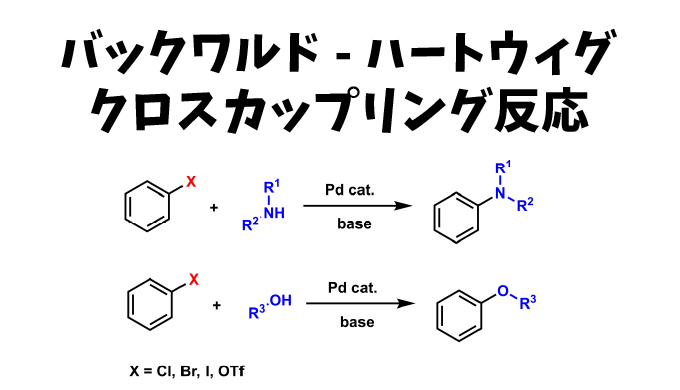
塩基とパラジウム触媒存在下、ハロゲン化アリールとアミン(あるいはアルコール)の反応によりC-N結合(あるいはC-O結合)を形成させる反応はバックワルド-ハートウィグ クロスカップリング反応として知られています。
バックワルド・ハートウィグ クロスカップリングの特徴
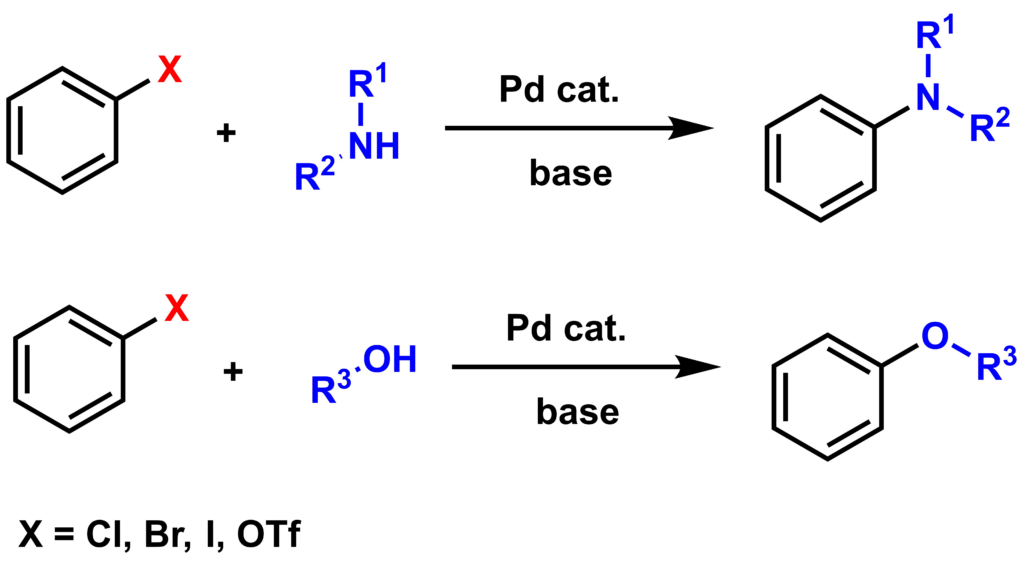
バックワルド・ハートウィグ クロスカップリングでは、パラジウムに配位したアミンを系中で脱プロトン化してアルカリ金属アミドを生成するような強塩基(NaCOBu-tやLHMDS)の存在が必須になります。典型的な実験法では、臭化アリールかヨウ化アリールが用いられており、パラジウム触媒としてはBINAP、DPPF、xantphos、DPBPのような二座キレート型ホスフィン配位子を含むものか、DBAなどの弱い配位子をもつものが効果的であることが知られています。塩基を化学量論量用いることは必須で、25℃程度の温和な反応温度で進行させることも可能です。このカップリングは分子間反応でも分子内反応でも可能です。
バックワルド-ハートウィグ クロスカップリングの歴史
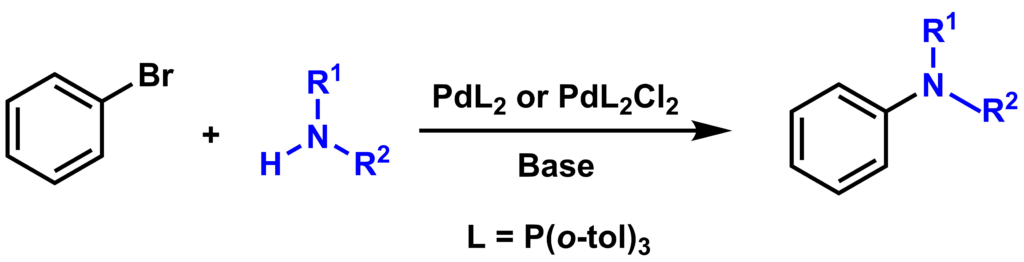
初めてのパラジウム触媒C-N結合形成は、右田らによって1983年に報告されています。その後10年以上たってから、S. Buchwaldらが右田らの方法を基に新しい触媒プロセスを開発しました。初期の反応の欠点は、いずれの反応においてもP(o-tol)3を配位子として用いており、熱や湿気に対して不安定なトリブチルスズアミドを必要とする点がありましたが、1995年にS. BuchwaldらおよびJ.Hartwigらはアミンを系中で脱プロトン化してアルカリ金属アミドを生成するような強塩基を使用することで、アミノスズ化合物の代わりにアミンを使用できることをそれぞれ独立して見出しました。その際に、BuchwaldはNaOtBuを、HartwigはLi(SiMe3)2を塩基として用いています。それ以降は、カップリングに要する反応条件は徐々に温和なものになってきており、適切な配位子を選択することで通常反応しにくいとされていた塩化アリールも、アミンやアルコールとのカップリングに用いることが可能となっています。
基質適応性について
バックワルド-ハートウィグ クロスカップリング反応においては、基質としてハロゲン化アリールおよびアミンあるいはアルコールが用いられますが、その性質によって反応性がどれぐらい変わるのか解説します。
ハロゲン化アリールについて
一般的にバックワルド-ハートウィグ クロスカップリング反応におけるハロゲン化アリールの反応性は、 I > Br > Cl >>>Fということが知られています。これは酸化的付加におけるハロゲン化アリールからハロゲンが脱離する際の脱離能の差によるものだと考えられています。
アミンおよびアルコールについて
一般的にアミンおよびアルコールの求核性は多くの場合関係ありません。実際に求核性の低いアミドも芳香族とのカップリングが可能です。1級、2級の脂肪族および芳香族アミン、1-3級の脂肪族および芳香族アルコールが反応します。
触媒について
酢酸パラジウム Pd (OAc)2
バックワルド-ハートウィグ クロスカップリング反応において、酢酸パラジウムを用いることで電子不足および電子豊富なハロゲン化アリールの反応が種々のアミンに対して可能です。その場合、塩基としてNaOtBuが電子豊富な系において、Cs2CO3が電子不足および中程度のものに用いると効率よく進行します(e-EROS Encyclopedia of Reagents for Organic Synthesis p.7536)
配位子について
反応が発見された初期では、P(o-tol)3が用いられていましたが、そこから種々の配位子を用いたカップリングが報告されています。
ビスホスフィン型配位子
P(o-tol)3配位子の次に報告されたのが、BINAPやdppfなどのビスホスフィン配位子です。P(o-tol)3までは2級アミンのみでしたが、BINAPやdppfでは1級アミンを用いたカップリングも可能となりました。これらのリガンドは、ビスホスフィン配位子のキレート効果によってカップリングしてできた化合物の還元的脱離が、副反応となるβ-水素脱離よりも優先されるためだと考えられています。ビスホスフィン型配位子を使う場合は、電子豊富でかさ高く、配位挟角が小さいホスフィン配位子を用いると副反応が抑えられます。
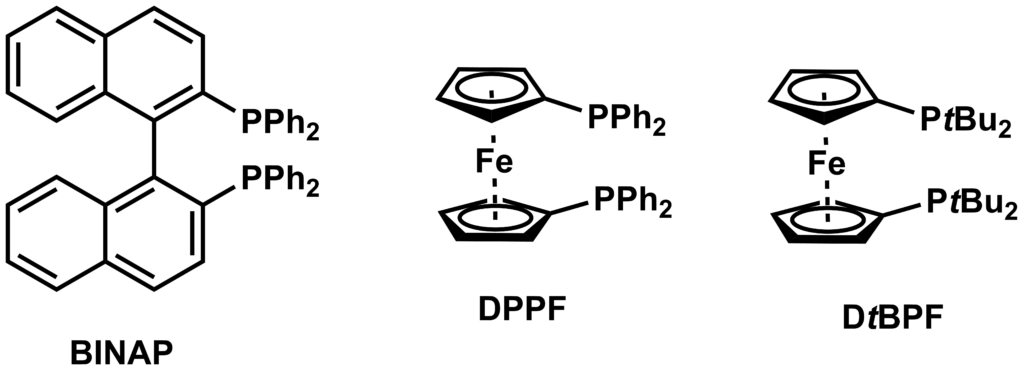
またビスホスフィン型のリガンドとしては、XantPhosに代表されるPOP型リガンドについても報告されています。
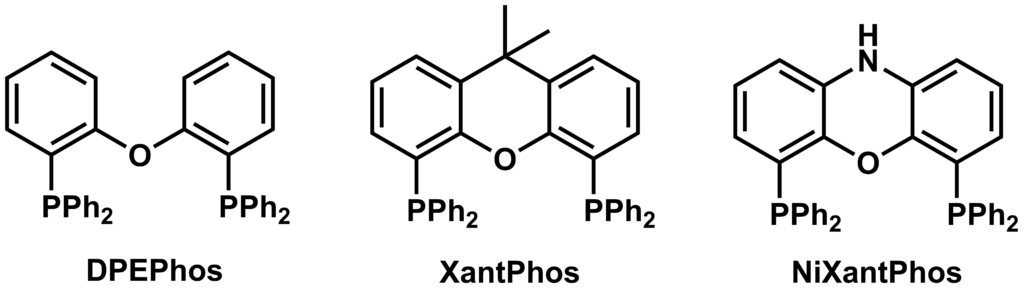
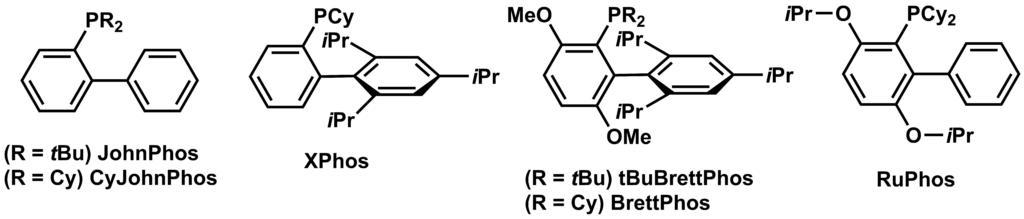
モノホスフィン型配位子
ビスホスフィンでなく、P(o-tol)3以外のモノホスフィン型の配位子についてもバックワルドらを中心に種々の配位子が開発されており、JohnPhosやXPhosは現在多くの反応で用いられています。また、HartwigらによってP(tBu)3などのシンプルな電子豊富でかさ高いホスフィン配位子についても報告されています。これらのモノホスフィン型配位子が優秀な点は、電子豊富なホスフィンであることが酸化的付加を容易にし、かさ高いホスフィンであることが還元的脱離を促進していることです。一般的にバックワルド-ハートウィグ クロスカップリングの律速段階は酸化的付加であると考えられており、還元的脱離は副反応であるβ-水素脱離と競合します。その結果、以前では合成が難しかったような基質の場合でも反応を行うことができます。
反応機構
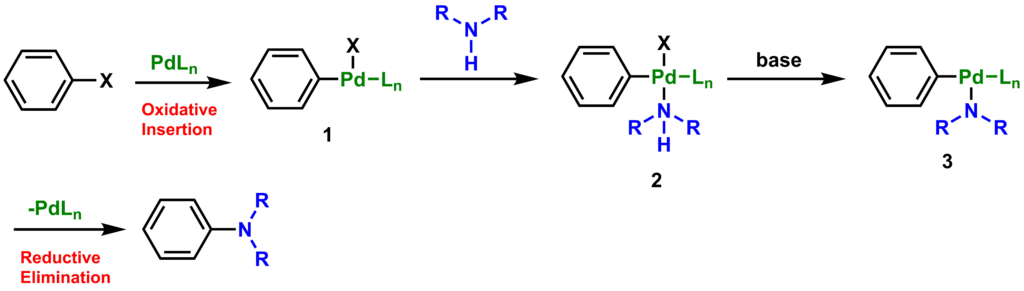
バックワルド-ハートウィグ クロスカップリングの反応機構における第一段階はハロゲン化アリールのPd(0)に対する酸化的付加(Oxidative Insertion)から始まり、中間体1が得られます。次に、アミンがPd(II)錯体に配位して、カップリングする二つ(ベンゼンとアミン)が同じパラジウム原子に結合した状態(中間体2)になります。塩基を使うことで、錯体からH-Xを脱離させて中間体3になった後、最終段階として還元的脱離(Reductive Elimination)が起き、C-N結合を形成すると同時にPd(0)を再生します。配位子(Ligand)はLで示してありますが、モノホスフィン型配位子の場合は一つ(n = 1)、ビスホスフィン型配位子の場合は二つ(n = 2)のホスフィンが配位した状態で反応が進行します。
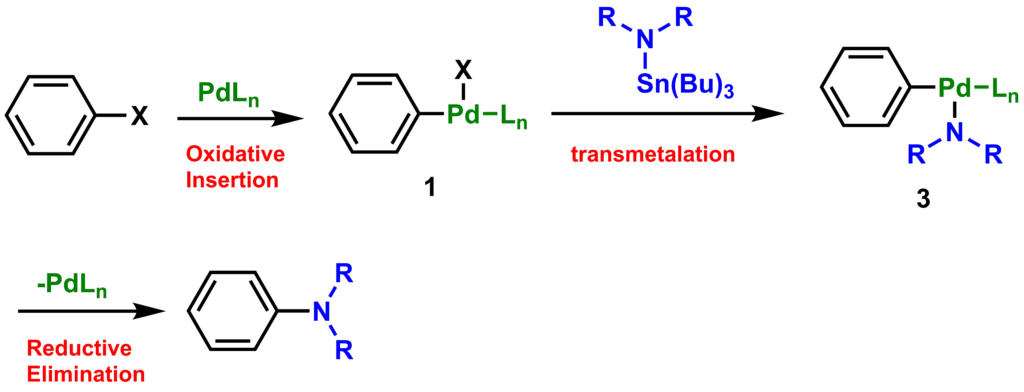
一方で、アミンではなくトリブチルスズなどの金属アミドを使った場合は、中間体1からトランスメタル化(transmetalation)によって中間体3とハロゲン化トリブチルスズが得られ、続く還元的脱離によって目的物になります。反応開発初期で見いだされたトリブチルスズを使った反応に塩基がいらないのは、トランスメタル化によって反応が進行するためです。
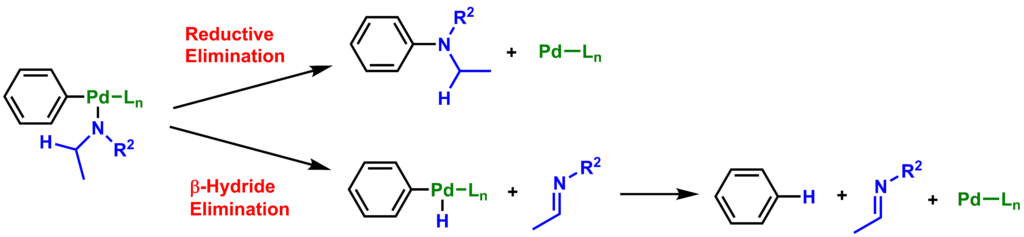
また、図に示すエチルアミンのようなβ位に水素を持つアミンの場合には、副反応として中間体3から還元的脱離(Reductive Eliminatioin)が起きるのではなく、β-水素脱離(β-Hydride Elimination)が起きる場合があります。この場合は生成物としてハロゲンが外れた芳香族化合物とイミンが合成されます。
実験操作
バックワルド-ハートウィグ クロスカップリングでは、酸化されやすいパラジウム触媒を用いることから、脱酸素溶媒を使うことが理想です。それ以外の場合には、溶媒の脱気やアルコンパージを行うとパラジウム触媒の酸化を防ぐことができます。個人的な感覚としては、脱酸素溶媒でない普通の溶媒+アルゴン置換でも簡単な基質なら問題なく合成できますが、きちんとやりたい場合は溶媒脱気(凍結脱気)か脱酸素溶媒を使いましょう。