水酸化ナトリウムは無機塩基のなかでも最も有名な強塩基です。安価な塩基のため、塩基性の水溶液の調製に水酸化ナトリウムはよく利用されます。洗浄用途に利用したり反応以外の用途に利用されることも珍しくありません。
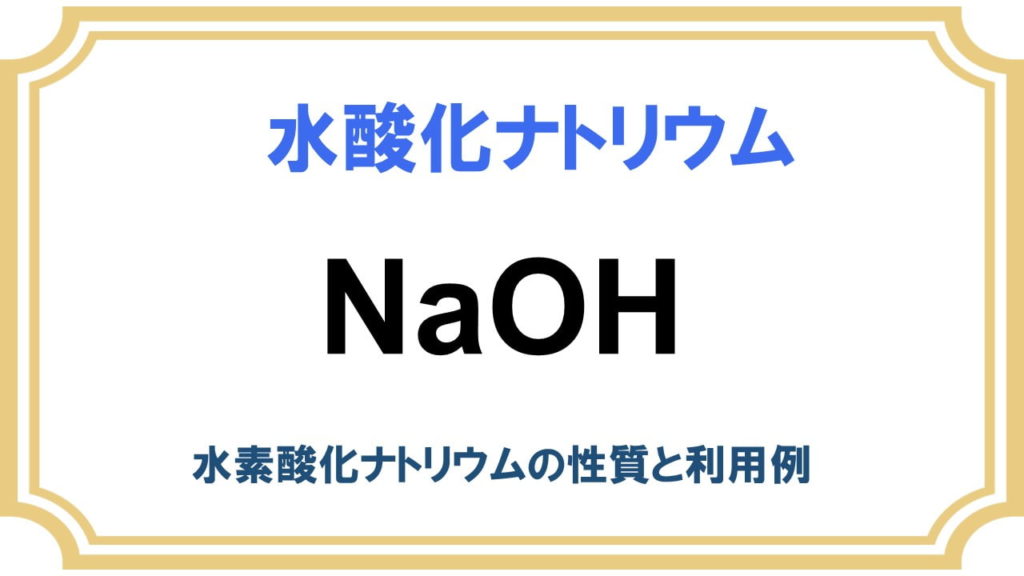
水酸化ナトリウムとは?
水酸化ナトリウムは水酸化物イオンを放出する強塩基として有名です。強塩基であるため皮膚に付着すると皮膚を侵して(腐食性)炎症を起こすので注意が必要です。塩基は蒸発しないので、薄い濃度お水酸化ナトリウム水溶液でも水分の蒸発に伴ってどんどん濃い濃度の水酸化ナトリウム水溶液になるので注意しましょう。一方で、空気中の二酸化炭素を取り込んで炭酸塩に変化していくので作り置きの溶媒を分析に利用する場合は注意が必要です。
水酸化ナトリウムのプロパティ
- MW: 40.00
- 化学式: NaOH
- 融点 : 318.4℃
- 密度 : 2.13
- pKa : 13
- 溶解度 :水に溶解(0℃ 0.42g/mL, 100℃ 3.47g /mL)
- 吸湿性・潮解性があるので秤量はすばやく行う
水酸化ナトリウム水溶液の調製方法
水酸化ナトリウムの水溶液を調製することはたくさんあります。10%NaOHのように質量パーセント濃度で指定されたり、1 mol/L (1M)NaOHなどモル濃度で指定されている例があります。使用用途によって、どの程度厳密な濃度の水溶液を用意する必要があるかが変化します。滴定やpH測定の校正などの分析利用する場合は正確な濃度を用意しましょう。一方で塩基性水溶液で分液する時などでは精密な濃度調製は求められません。
水酸化ナトリウムは割と溶けにくく、溶かす時は超音波にかけたり、熱して溶かすと早く溶けます。溶け始めで熱すると突沸する危険があるのでおすすめしません。また、水酸化カリウムでも問題無い場合は溶けやすく潮解性も少ないのでおすすめです。
20%水酸化ナトリウム水溶液の作り方
重量パーセント濃度の水酸化ナトリウム水溶液を100g作る時は
20gの水酸化ナトリウム (NaOH)と水80g (80 mL)を加えて調製します。水は使用用途によっては蒸留水を使いましょう。
2M NaOH水溶液の作り方
2M NaOH水溶液は、2mol /L NaOH水溶液と同じ意味です。分子量は40.0 g/molなので、80gで2molになります。2 mol/Lの水溶液を作るには、80gの水酸化ナトリウムに水を加えて1Lにすれば 2mol /Lの水溶液ができます。 1Lもいらない場合は、8gに水を加えて100mLにしても2mol /Lの水溶液が作れます。
正確に作る場合はメスフラスコを利用します。メスフラスコに砕いた水酸化ナトリウムを加えて水を加えてメスアップします。
80gの水酸化ナトリウムに1Lの水を加える方法では80gのNaOH分の重さ分の量が多くなってしまうので正確な2 mol/L NaOH水溶液にはなりません。分析用途ではない場合は問題ありませんが、正確さを求める場合は80gの水酸化ナトリウムに水を加えて1Lにしましょう。
電気分解と水酸化ナトリウム
塩化ナトリウム水溶液の電気分解
塩化ナトリウム水溶液を電気分解すると水酸化ナトリウム、塩素、水素が発生します。陽極では塩化物イオンが電子を失って塩素が発生し、陰極では水が電子を得て水酸化物イオンが発生します。陰極でナトリウムイオンが電子を得て還元されないのはイオン化傾向が大きく酸化されやすいため、水が電子を受け取るからです。
水酸化ナトリウムを利用する反応
水酸化ナトリウムはあらゆる場面で利用される試薬のため、その一部を紹介します。
- エステルの加水分解
水酸化ナトリウムは様々な加水分解性の化合物を塩基性条件で加水分解する際によく利用します。特にメチルエステルやエチルエステルをカルボン酸に加水分解する際に利用します。水酸化ナトリウムは1M程度の水溶液を対応するアルコール溶媒中に加えて撹拌することによって得られます。室温でも進行しますが、反応しにくい場合は加熱還流します。
- エステル化
カルボン酸のエステル化は、カルボキシラートアニオンの反応性が低いために求核置換反応によってアルキル化するよりも、カルボン酸と対応するアルコールとの間で脱水縮合によって得る方法(フィッシャーエステル化)によって得るのが普通です。
しかし、HMPA (ヘキサリン酸トリアミド)を溶媒として加える事によって、カルボキシラートアニオンのアルキル化が可能です。反応はHMPAと適当なアルキル化剤(ハロゲン化アルキル)、水酸化ナトリウム水溶液を加えることによってアルキル化が行えます。フェノールのアルキル化も同様に可能です。
- ホフマン転位
ホフマン転位ではアミドを水酸化ナトリウム水溶液中臭素と作用させることによって減炭したアミンが得られます。