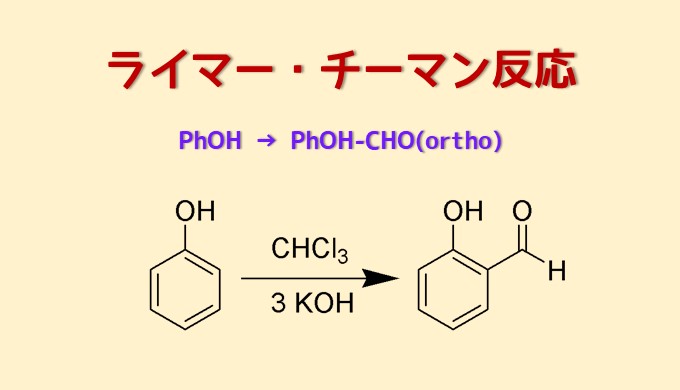
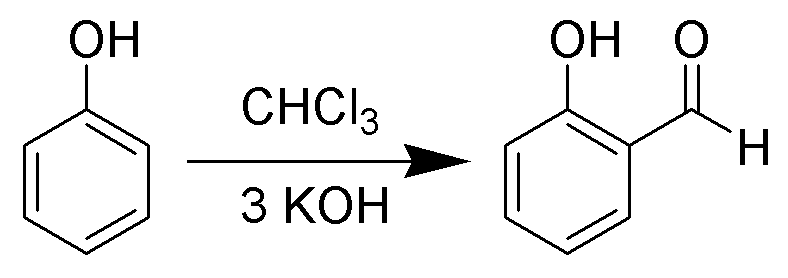
ライマーチーマン反応 (Reimer-Tiemann Reaction)はフェノールを基質として、塩基とクロロホルムを使ってオルト位選択的にホルミル化する方法です。
ライマー・チーマン反応とは?特徴と利点
ライマーチーマン反応は1876年にカール・レイマーとフェルディナンド・ティーマンにより発見されたフェノールのオルト位選択的ホルミル化反応です。
from wikipedia public domain
K.Reinmer, “Ueber eine neue Bildungsweise aromatisch Aldehyde” Berichte der deutschen chemischen Gesellschaft, 9, 1, 1876
上図の化合物はサリチルアルデヒドです(酸化すればサリチル酸→アスピリンの原料。実際は工業的には直接カルボキシル基を導入するコルベシュミット反応を利用)
ライマーチーマン反応の反応機構
ライマー・チーマン反応は代表的なカルベンの反応です。まず加えられた塩基によってクロロホルムの酸性プロトンが引き抜かれたのち、塩素が脱離してジクロロカルベンが生成します。電子不足でもあるカルベンはフェノキシドのアニオンに引き寄せられるため、オルト位と反応しやすいです。カルベンは芳香環からの攻撃を受けて結合を形成してホルミル化します。
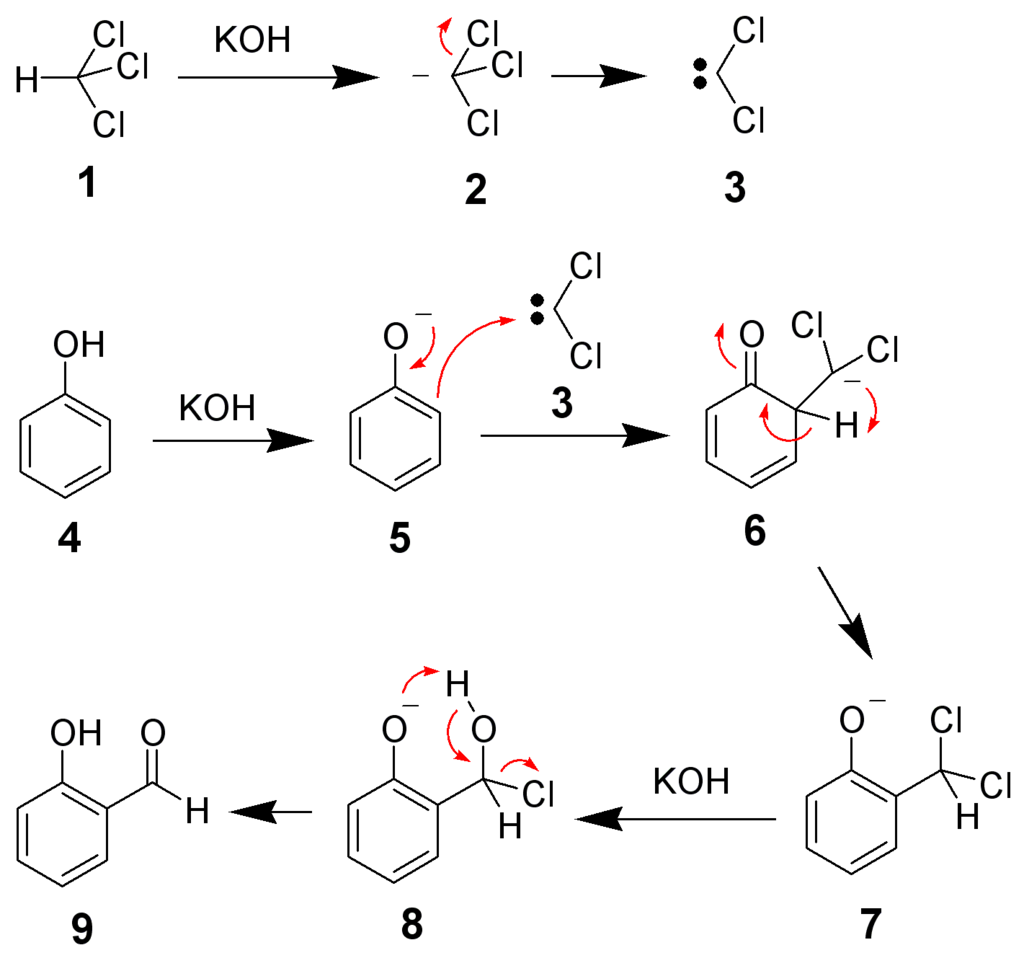
ライマーチーマン反応の反応機構 from wikipedia public domain
Hine, Jack, and James M. Van Der Veen. “The Mechanism of the Reimer-Tiemann Reaction1.” JACS 81.24 (1959): 6446-6449.
ライマーチーマン反応の利点や特徴
ライマーチーマン反応の利点や特徴は
- 安価な原料(KOH, CHCl3)
- 水酸基のオルト位選性がある
- 求核性のあるフェノールをホルミル化できる(ビルスマイヤー反応ではフェノールがホルミル化する:Morimura, S, et al, Bull. Chem. Soc. Jpn.50.8 (1977): 2189-2190.)
- 塩基性条件下で進行
- 含水条件で進行する
などがあげられます。
欠点は
- 強アルカリを使う
- 収率が低い(中程度以下)
- 置換基があると選択性が低下
- 電子求引基の存在により大きく収率が低下する
- アルケンやアミンはカルベンと反応する
などの欠点があげられます。
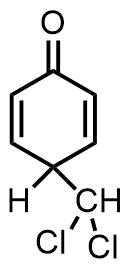
ライマーチーマン反応の副反応例
パラ位に入って安定なキノン型になる副反応が知られています。
また、カニッツァーロ反応が同時に進行することも収率低下の原因と考えられています。
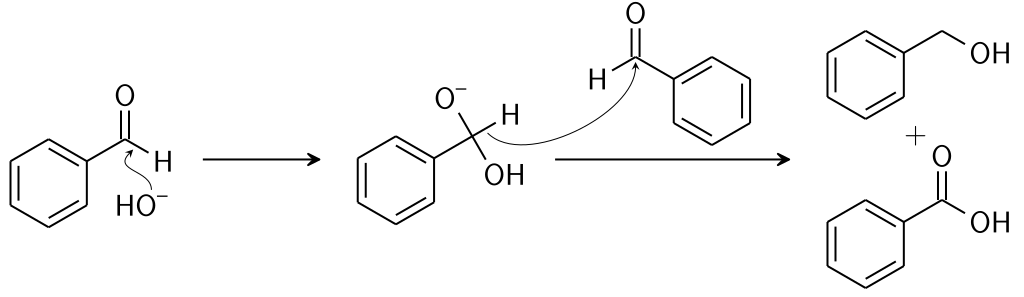
カニッツァーロ反応の概要 from wikipedia public domian
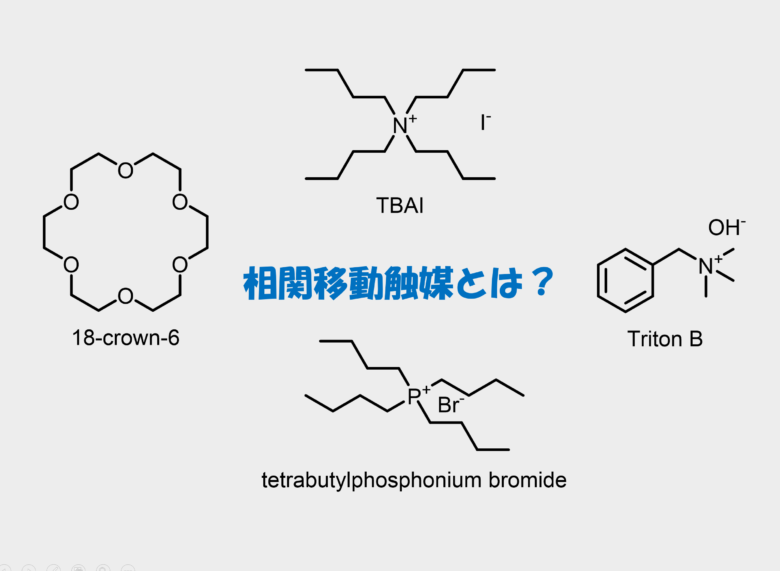
クロロホルムと水酸化物イオンとの反応を促進させるために相間移動触媒が利用されることもあるようです。
ライマーチーマン反応は古典的な合成方法ですが、サリチルアルデヒドの合成においては有力な合成法となりえるかも?
反応条件
サリチルアルデヒドの合成
NaOH(2mol)を80mLの水に溶解し、65℃~70℃として、液化させたフェノール(0.27mol)を加えて激しく降り混ぜる。溶液にクロロホルム(0.75mol)を65℃~70℃を保って攪拌しながら加える(急激な反応に注意する)。その後数時間同じ温度で加熱する。反応後過剰なクロロホルムを除去し、希硫酸で酸性に調整し、目的物を抽出する(30%台)